пентоксифиллин при подагре можно или нет
Артериальная гипертензия у больных подагрой: возможности лечения
Внастоящее время подагра рассматривается как важная общемедицинская проблема, что связано не только с увеличением распространенности болезни, но и с полученными данными о влиянии гиперурикемии на прогрессирование атеросклеротического поражения сосудов.
Внастоящее время подагра рассматривается как важная общемедицинская проблема, что связано не только с увеличением распространенности болезни, но и с полученными данными о влиянии гиперурикемии на прогрессирование атеросклеротического поражения сосудов [1, 2]. По мнению экспертов, подагра является метаболическим заболеванием [3, 4], а гиперурикемия — одним из важнейших компонентов метаболического синдрома. Еще в 60-е годы прошлого века была обнаружена тесная взаимосвязь между нарушениями пуринового обмена и гипертриглицеридемией [6]. По результатам 8-летнего исследования доказана связь между гиперурикемией и инсулинорезистентностью [5]. Гиперурикемия является независимым фактором риска сердечно-сосудистых заболеваний [1, 2, 7], поэтому диагностика и лечение подагры, гиперурикемии, а также осложнений заболевания являются актуальной проблемой терапии.
Помимо непосредственного патологического влияния повышенного уровня мочевой кислоты на стенку сосудов важное значение у больных подагрой приобретает воздействие повышенного артериального давления (АД), которое чрезвычайно часто встречается у данной категории пациентов [8]. Артериальная гипертензия (АГ), в свою очередь, значительно увеличивает риск кардиоваскулярных катастроф [8, 9]. Актуальной проблемой является применение патогенетически обоснованной, безопасной гипотензивной терапии, обеспечивающей адекватный контроль АД в течение суток. У больных подагрой, страдающих АГ, необходимо учитывать взаимосвязь сложных метаболических процессов, чтобы не увеличить риск терапевтически-индуцированной подагры [3]. Важнейшее значение приобретает метаболическая безопасность препаратов, применяемых для лечения АГ у больных подагрой. Под метаболической нейтральностью препаратов понимают влияние их не только на липидный и углеводный обмен, но и на уровень мочевой кислоты [3]. Кроме того, адекватная гипотензивная терапия подразумевает выбор препарата, обладающего возможностью дополнительного снижения риска сердечно-сосудистых осложнений, уменьшения выраженности эндотелиальной дисфункции. Далеко не все препараты, входящие в стандарты лечения сердечно-сосудистых заболеваний, удовлетворяют этим условиям у пациентов, страдающих подагрой. Так, диуретики считаются средствами первого ряда для длительной терапии больных с АГ. Все классы мочегонных препаратов противопоказаны при подагре. Показано, что не существует безопасного класса диуретиков. Все препараты данной группы ингибируют экскрецию мочевой кислоты, приводя к гиперурикемии; β-адреноблокаторы также не являются препаратами выбора при сочетании подагры и АГ, так как они увеличивают инсулинорезистентность, гиперинсулинемию, усугубляя гиперурикемию [4].
В настоящее время известно, что метаболически нейтральными препаратами, обеспечивающими оптимальный контроль АД, являются антагонисты кальция дигидропиридинового ряда длительного действия (амлодипин), ингибиторы ангиотензинпревращающего фермента [4], блокатор АТ1-рецепторов ангиотензина II (лозартан) [10]. Среди указанных групп препаратов особое место принадлежит антагонистам кальция. Механизм действия связан с блокированием медленных кальциевых каналов и препятствованием внутриклеточной гиперкальциемии, с расслаблением гладких мышц и снижением периферического сосудистого сопротивления. Период полувыведения амлодипина равен 35–50 ч. В многочисленных многоцентровых исследованиях (NORDIL, INSIGHT, VHAT, HOT, ALLHAT) показано снижение риска сердечно-сосудистых осложнений на фоне терапии антагонистами кальция пролонгированного действия. Неоспоримым преимуществом препаратов является возможность использования их у пациентов с метаболическим синдромом, так как они не обладают отрицательным влиянием на углеводный, липидный, пуриновый обмены [11, 12].
Несмотря на большое количество исследований, посвященных диагностике, тактике выбора препаратов при АГ, вплоть до настоящего времени недостаточно данных об особенностях суточного профиля АД у больных подагрой, влиянии пролонгированных антагонистов кальция при сочетании подагры и АГ.
Целью нашего исследования явилось изучение циркадных ритмов АД, эффективности применения амлодипина при сочетании подагры и АГ.
Материал и методы
В исследование были включены 40 больных первичной подагрой — основная группа (ОГ) (32 мужчины и 8 женщин), средний возраст 52,88 ± 2,08 года (от 30 до 76 лет). Диагноз подагры был определен на основании классификационных критериев, предложенных Wallace и соавторами, рекомендованных ARA в 2001 г. Критериями невключения являлись наличие ассоциированных с АГ состояний (в том числе сахарный диабет, ишемическая болезнь сердца), сопутствующие хронические болезни в стадии обострения, острый приступ подагрического артрита. Все обследованные пациенты страдали АГ (длительность болезни от 1 года до 30 лет), риск был расценен как высокий и очень высокий.
Группу сравнения (ГС) составили 20 пациентов с артериальной гипертензией, сопоставимых по возрасту, полу, сопутствующей патологии. В контрольную группу (КГ) было включено 20 клинически здоровых лиц. Всем обследованным лицам проводилось общеклиническое исследование, суточное мониторирование АД в условиях стационара, определение антитромбогенной активности сосудистой стенки.
У больных подагрой проводились исследования, необходимые для подтверждения диагноза, выявления особенностей течения заболевания, поражения различных органов и систем (мочевая кислота сыворотки крови и суточной мочи, рентгенография пораженных суставов, пункция суставов, ультразвуковое исследование почек). Наиболее часто поражались суставы нижних конечностей. У подавляющего большинства больных (87%) вовлечение суставов начиналось с артрита плюснефалангового сустава I пальца стопы. Средняя длительность заболевания составила 9,65 ± 2,03 года (от 0,6 до 32 лет), обращались к врачу в среднем на 10 год болезни. У 68% пациентов диагностирована тофусная подагра, к которой относили подкожные, внутрикостные тофусы (симптом «пробойника»), нефролитиаз. Гиперурикемия выявлена у 73% больных подагрой. Артериальная гипертензия у данной категории пациентов клинически отличалась малосимптомностью, в связи с чем более половины пациентов не контролировали АД и не принимали регулярно гипотензивные препараты. На амбулаторном этапе 46% обследованных больных подагрой с гипотензивной целью принимали иАПФ, антагонисты кальция, адреноблокаторы, диуретики (10%), комбинированные препараты, на фоне терапии целевой уровень АД был достигнут лишь у 15% больных.
При поступлении в стационар всем обследованным лицам проводилось суточное мониторирование АД с частотой 15 мин в дневные часы и 30 мин в ночные часы. Оценивались следующие показатели: среднее АД, максимальное, минимальное АД, вариабельность АД, гипертонический индекс времени АД. Все параметры определялись как для систолического АД (САД), так и для диастолического АД (ДАД).
Всем пациентам в качестве гипотензивной терапии назначался амлодипин (Амловас) в начальной дозе 5 мг/сут. Титрование дозы препарата проводилось через 3–5 дней пребывания в стационаре с увеличением до 10 мг/сут при необходимости или комбинирование с иАПФ. Через 3 месяца регулярного приема гипотензивных препаратов проводилось повторное суточное мониторирование АД. В течение этого времени контроль эффективности терапии, наличия побочных эффектов осуществлялся при ежемесячных визитах пациентов.
Статистический анализ проводился с помощью пакета прикладных программ STATISTICA 6.0, описательной статистики. Результаты расценивались как статистически значимые при величинах достигнутого уровня достоверности (p) менее 0,05.
Результаты
Усредненные данные суточного мониторирования АД у больных подагрой и пациентов, страдающих АГ, представлены в табл.
У больных подагрой отмечены более высокие показатели среднего систолического, диастолического, пульсового АД, максимального и минимального АД, индекса времени гипертензии, вариабельности АД, хотя данные различия по сравнению с аналогичными параметрами у лиц группы сравнения не достигали статистически значимых.
Однако существенные отличия были в степени снижения АД в ночное время. Так, у большинства больных подагрой (73,7%) выявлен суточный профиль с недостаточной степенью снижения АД (Non-dipper), у 21% пациентов регистрировалось устойчивое повышение АД в ночные часы (Night-peaker), нормальную степень снижения АД имели лишь 5% больных (Dipper). Тогда как у больных АГ преимущественно (62,5%) наблюдался профиль Dipper, в 25% случаев — Non-dipper, у 12,5% пациентов — Night-peaker. Таким образом, среди больных подагрой достоверно чаще регистрировался профиль Non-dipper по сравнению с лицами, страдающими АГ (р
А. П. Ребров, доктор медицинских наук, профессор
Н. А. Магдеева
СГМУ, Саратов
Современные возможности терапии подагры
Рассмотрены подходы к лечению подагры в соответствии с современными рекомендациями. Уделено внимание и немедикаментозным методам профилактики, представлены рекомендации по диетотерапии при подагре.
Approaches to gout therapy were considered according to modern guidelines. Attention was also paid to non-drug methods of prevention, guidelines on dietary treatment in gout were presented.
Подагра является наиболее частой причиной артрита [1], что обусловлено отложением кристаллов моноурата натрия (МУН) в суставах и мягких тканях. Для формирования кристаллов МУН необходима персистирующая гиперурикемия. При повышении сывороточного уровня мочевой кислоты (МК) происходит насыщение тканей МУН, что создает условия для его кристаллизации и, соответственно, манифестации подагры [2]. Порог насыщения МК составляет около 7 мг/дл (420 мкмоль/л), хотя для пациентов с подагрой рекомендуется достигать сывороточный уровень МК менее 6 мг/дл (360 мкмоль/л), поскольку такой уровень МК приводит к более быстрому уменьшению кристаллических отложений МУН [3–6].
Достигнутые в настоящее время успехи в понимании основных механизмов развития хронической гиперурикемии и подагры позволили пересмотреть многие положения, лежащие в основе диагностики и лечения заболевания. Между тем, несмотря на успехи в понимании патофизиологии подагры и доступность эффективных методов лечения, подагра остается плохо контролируемым заболеванием во всех странах [7, 8]. Пожалуй, самой распространенной проблемой является низкая приверженность пациентов к снижению сывороточного уровня МК, что главным образом связано с недостаточным пониманием цели терапии подагры и врачами, и пациентами. Целесообразно объяснить пациентам цель лечения [9–11], которая заключается в растворении имеющихся отложений кристаллов МУН путем снижения сывороточного уровня МК ниже точки насыщения сыворотки уратами и купировании приступов артрита, если таковые возникают. Следует также поддерживать сывороточный уровень МК ниже порога насыщения, чтобы избежать образования новых кристаллов.
Целью настоящей статьи было предоставить практический обзор существующих подходов к управлению заболеванием в четырех аспектах: немедикаментозные методы профилактики и лечения гиперурикемии; купирование острого приступа артрита; уратснижающая терапия, направленная на профилактику приступов артрита и образование тофусов; профилактика приступов артрита при инициации уратснижающей терапии.
Лечение подагры в соответствии с современными рекомендациями направлено на улучшение исходов заболевания. Эффективность лечебно-профилактических вмешательств при подагре зависит от четкого следования предложенной в них концепции лечения [4, 12, 13].
Немедикаментозные методы профилактики
Немедикаментозные методы профилактики, нацеленные на модификацию факторов образа жизни, связанных с риском развития гиперурикемии, предусматривают индивидуальное или групповое профилактическое консультирование по актуальным вопросам диетотерапии, контролю массы тела при ожирении, достижению целевых уровней артериального давления, коррекции нарушений углеводного и липидного обмена.
Ожирение является ведущим фактором риска подагры, особенно у мужчин, соответственно, контроль массы тела оказывает существенное влияние на частоту приступов подагры [14]. Снижение веса за счет ограничения общей калорийности пищи и потребления углеводов благотворно влияет на уровни сывороточного урата у пациентов с подагрой [15, 16].
Следует отметить, что в настоящее время пересмотрены некоторые принципиальные позиции по диетотерапии при подагре. Так, рекомендация по жесткому ограничению в пищевом рационе пуринсодержащих продуктов распространяется только на животные производные (мясо, морепродукты), поскольку именно такая мера способствует снижению сывороточного уровня мочевой кислоты. При этом богатая пуринами растительная пища не оказывает существенного влияния на урикемию [4, 17]. Показано, что потребление обезжиренных молочных продуктов [18, 19], растительных масел и овощей ассоциируется с уменьшением риска гиперурикемии и приступов подагры [4, 12]. Витамин С увеличивает почечную экскрецию мочевой кислоты, поэтому его можно использовать в качестве дополнительной меры при терапии подагры [20, 21]. Безопасным в отношении сывороточного уровня МК и риска развития подагры считается потребление небольшого количества сухого вина [20, 22]. При этом потребление пива, в т. ч. безалкогольного, крепких спиртных напитков, а также подслащенных безалкогольных напитков с высоким содержанием фруктозы должно быть ограничено максимально [20, 23–25].
Несмотря на то, что основная масса клинических исследований затрагивают оценку эффективности диетотерапии в аспекте профилактики риска развития подагры, а не управления частотой приступов артрита у лиц с верифицированным диагнозом, рекомендации по модификации образа жизни должны даваться всем пациентам с подагрой, в т. ч. получающим медикаментозную терапию.
Купирование острого приступа подагрического артрита
В современных рекомендациях в качестве препаратов первой линии противовоспалительной терапии рассматриваются нестероидные противовоспалительные средства (НПВС), колхицин и глюкокортикостероиды (ГК) [4, 12, 13]. Сравнительно недавний систематический обзор показал, что НПВС (в том числе селективные ингибиторы ЦОГ-2), ГК (перорально и внутримышечно), колхицин и ингибитор ИЛ-1β (канакинумаб) являются эффективными методами лечения острых приступов [26]. Целесообразность персонифицированного выбора режима терапии обусловлена и индивидуальными особенностями больного, и гетерогенностью собственно подагрического процесса, протекающего с вовлечением многих органов и систем организма, что существенно модифицирует фармакодинамику препаратов, приводя к кумуляции нежелательных эффектов.
Терапия НПВС занимает лидирующие позиции в лечении как острого приступа, так и хронического подагрического артрита. Считается, чем раньше назначен препарат, тем быстрее может быть достигнут анальгетический эффект. НПВС следует использовать в максимальных суточных дозах, которые могут быть уменьшены по мере ослабления симптоматики. Выбор конкретного НПВС во многом зависит от личных предпочтений. И селективные ингибиторы ЦОГ-2, и традиционные НПВС эффективны при лечении острых приступов подагрического артрита. Недавний систематический обзор, объединяющий результаты шести рандомизированных клинических исследований (851 пациент), продемонстрировал одинаковый эффект эторикоксиба (120 мг в сутки), индометацина и диклофенака при остром артрите, с лучшей у эторикоксиба переносимостью со стороны желудочно-кишечного тракта [27]. Другой селективный ингибитор ЦОГ-2 — целекоксиб также обнаружил сопоставимый с индометацином эффект в отношении умеренной и выраженной боли у пациентов с острым подагрическим артритом [28]. Еще в одном систематическом обзоре был сделан вывод о том, что НПВС и селективные ингибиторы ЦОГ-2 обнаруживают эквивалентные преимущества в плане уменьшения боли, отечности и улучшения общего самочувствия, однако традиционные НПВС отличаются большей частотой отмены из-за нежелательных явлений [29].
Колхицин — алкалоид, получаемый из растения безвременника осеннего (Colchicum autumnae), используется для лечения острой подагры на протяжении многих десятилетий. Клинические исследования и ежедневная рутинная практика демонстрируют высокую частоту побочных эффектов при применении колхицина, которые, вероятно, можно объяснить назначением в прошлые годы более высоких доз препарата, чем рекомендованы в настоящее время. По крайней мере, большое многоцентровое исследование пациентов с подагрой и сохраненной функцией почек убедительно показало сопоставимую эффективность двух режимов терапии острого подагрического артрита: низкодозового (1,8 мг колхицина в сутки: 1,2 мг сразу и 0,6 мг через час) и высокодозового (4,8 мг колхицина в сутки: 1,2 мг сразу и по 0,6 мг каждый час; 6 раз), с существенно меньшей частотой побочных эффектов со стороны желудочно-кишечного тракта в группе с низкой дозой. Причем эффективность низких доз колхицина была эквивалентна высоким в том случае, если колхицин в низких дозах назначался в течение первых 12 часов после начала острого приступа артрита [30]. Клиническая практика показывает, что колхицин оказывается гораздо менее эффективным, если его назначают после 12–24 часов от начала приступа. Соответственно, более позднее назначение может потребовать больших доз препарата, что практически всегда заканчивается развитием нежелательных лекарственных реакций.
Согласно современным национальным рекомендациям для купирования острой атаки артрита целесообразным считается назначение у большинства пациентов низких доз колхицина (1,5 мг в первые сутки (1 мг сразу и через 1 час еще 0,5 мг) и по 1 мг со следующего дня) [13].
Назначение ГК для купирования острого приступа подагры возможно в виде внутрисуставных (после удаления синовиальной жидкости), внутримышечных инъекций или внутрь.
Пероральный прием преднизолона в суточной дозе 30–35 мг/сут демонстрирует высокую эффективность [31, 32] и рекомендуется группами Американского колледжа ревматологов (American College of Rheumatology, ACR) и Европейской антиревматической лиги (European League Against Rheumatism, EULAR) в качестве терапии первой линии при лечении острого приступа подагры [12, 33]. При этом стартовая доза преднизолона 30–35 мг/сут назначается на несколько (3–6) дней с последующей быстрой (в течение 1 недели) полной отменой.
Внутримышечное введение ГК может быть применено в случаях полиартикулярного поражения суставов [34]. Внутрисуставные инъекции стероидов оказываются очень эффективными и рекомендуются как ACR, так и EULAR при моно- или полиартикулярном поражении суставов, несмотря на отсутствие рандомизированных клинических исследований [12, 33].
Однако важно отметить, что, вопреки бытующему мнению, прием преднизолона не эффективнее НПВС. Так, сравнение двух режимов терапии (преднизолон 35 мг/сут и напроксен 1000 мг/сут) у пациентов с острым подагрическим артритом показало отсутствие различий в динамике интенсивности боли при сопоставимой частоте нежелательных эффектов [35]. Кроме того, ГК не безопаснее НПВС, поскольку способны усугубить течение артериальной гипертонии и сахарного диабета [36]. В исследовании [37] частота побочных эффектов даже на однократное внутрисуставное введение ГК (бетаметазон 7 мг) оказалась чрезвычайно высокой: у 73% пациентов обнаружилось клинически значимое повышение уровня систолического артериального давления, у 23% — гликемия натощак, у 13% — ЭКГ-признаки ишемии миокарда.
При наличии абсолютных противопоказаний и/или неэффективности НПВС, колхицина и ГК, а также отсутствии текущей инфекции, с целью купирования острого артрита возможно применение моноклональных антител к ИЛ-1 (канакинумаб) [12].
Уратснижающая терапия
Уратснижающая терапия, основной целью которой является предупреждение образования и растворение имеющихся кристаллов МУН, возможна посредством достижения уровня МК ниже точки супернасыщения сыворотки уратами (
ФГБОУ ВО ОмГМУ МЗ РФ, Омск
Описание препарата ПЕНТОКСИФИЛЛИН (PENTOXYFILLINE)
Форма выпуска, состав и упаковка
Раствор для инфузий бесцветный или слегка желтоватый, прозрачный.
| 1 амп. | |
| пентоксифиллин | 100 мг |
Вспомогательные вещества: натрия хлорид, натрия гидроксида раствор 0.01 М, вода д/и.
Фармакологическое действие
Средство, улучшающее микроциркуляцию, ангиопротектор, производное диметилксантина. Пентоксифиллин уменьшает вязкость крови, вызывает дезагрегацию тромбоцитов, повышает эластичность эритроцитов (за счет воздействия на патологически измененную деформируемость эритроцитов), улучшает микроциркуляцию и увеличивает концентрацию кислорода в тканях. Повышает концентрацию цАМФ в тромбоцитах и АТФ в эритроцитах с одновременным насыщением энергетического потенциала, что в свою очередь приводит к вазодилатации, снижению ОПСС, возрастанию ударного объема крови и минутного объема крови без значительного изменения ЧСС.
Расширяя коронарные артерии, увеличивает доставку кислорода к миокарду, расширяя сосуды легких, улучшает оксигенацию крови. Повышает тонус дыхательной мускулатуры (межреберных мышц и диафрагмы).
В/в введение, наряду с указанным выше действием, приводит к усилению коллатерального кровообращения, увеличению объема протекающей крови через единицу сечения.
Повышает концентрацию АТФ в головном мозге, благоприятно влияет на биоэлектрическую деятельность ЦНС. Улучшает микроциркуляцию в зонах нарушенного кровоснабжения.
При окклюзионном поражении периферических артерий (перемежающейся хромоте) приводит к удлинению дистанции ходьбы, устранению ночных судорог икроножных мышц и болей в покое.
Фармакокинетика
Выведение пентоксифиллина уменьшается у пациентов пожилого возраста и при заболеваниях печени.
Диагностика и лечение подагрического артрита
Подагра — хроническое прогрессирующее заболевание, связанное с нарушением пуринового обмена, которое характеризуется повышением мочевой кислоты в крови и отложением в тканях опорно-двигательного аппарата и внутренних органах натриевой соли мочевой кислот
Подагра — хроническое прогрессирующее заболевание, связанное с нарушением пуринового обмена, которое характеризуется повышением мочевой кислоты в крови и отложением в тканях опорно-двигательного аппарата и внутренних органах натриевой соли мочевой кислоты (уратов) с развитием рецидивирующего острого артрита и образованием подагрических узелков (тофусов).
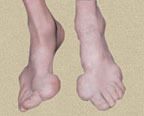
Подагра относится к «старым» болезням и известна со времен глубокой древности. Термин «подагра» происходит от греческих слов pus, что означает стопа, и agra — захват. Таким образом, уже в названии заболевания подчеркивается одно из кардинальных проявлений подагрического артрита. Подагра рассматривается не только как недуг, при котором патологический процесс локализуется в опорно-двигательном аппарате, но и как системное заболевание, характеризующееся поражением жизненно важных органов, и прежде всего почек. Распространенность подагры в различных регионах варьирует в широких пределах и во многом связана с особенностями питания населения, составляя в среднем 0,1%. В США этот показатель равен 0,84% (возможно, эта цифра завышена).
Подагрой болеют преимущественно мужчины (отношение мужчины/женщины составляет 9:1). У мужчин и в норме наблюдается более высокий уровень мочевой кислоты. У женщин репродуктивного возраста повышенное содержание эстрогенов способствует увеличению почечного клиренса уратов. В постменопаузальном периоде уровень мочевой кислоты у них такой же, как и у мужчин соответствующего возраста. Поэтому, если пик заболеваемости у мужчин падает на возраст 35–50 лет, то у женщин — на 55–70 лет. Однако подагра может развиваться и в более молодом возрасте и отмечается даже у детей.
Как известно, мочевая кислота является конечным продуктом расщепления пуринов и выделяется из организма почками. У здоровых лиц за 24 ч выделяется с мочой 400–600 мг мочевой кислоты. Для понимания патогенеза подагры следует остановиться на клиренсе мочевой кислоты. Он характеризует объем крови, способный очиститься в почках от мочевой кислоты за 1 мин. В норме этот показатель равен 9 мл/мин. Источником образования мочевой кислоты в организме являются пуриновые соединения, которые поступают с пищей или образуются в организме в процессе обмена нуклеотидов. В плазме крови мочевая кислота находится в виде свободного урата натрия. В норме верхняя граница этого показателя для мужчин составляет 0,42 ммоль/л (7 мг%) и для женщин — 0,36 ммоль/л (6 мг%). Содержание мочевой кислоты выше этих цифр расценивается как гиперурикемия и рассматривается в качестве фактора высокого риска развития подагры. Так, по данным Фремингемского исследования, развитие подагрического артрита наблюдается у 17% мужчин и женщин с урикемией 7,0–7,9 мг%, у 25% — с 8–8,9 мг% и у 90% — при уровне мочевой кислоты выше 9,0 мг%.
При наличии стойкого повышения мочевой кислоты в сыворотке крови выше для данного индивидуума уровня она начинает откладываться в тканях в виде свободного урата натрия, который в мочевых путях переходит в мочевую кислоту.
Выделяются следующие клинические варианты подагры:
Гиперурикемия может длительное время протекать без каких-либо субъективных и объективных симптомов и лишь случайно диагностироваться при обследовании больного. Однако она не столь безобидна, как это может показаться на первый взгляд, и нередко ассоциируется с нарушениями жирового и углеводного обмена, а также, что еще более серьезно, приводит к уратной нефропатии. Следует отметить условность дефиниции «асимтоматическая подагра». Для ее выявления необходимо повторно исследовать уровень мочевой кислоты, особенно у «подагрической личности», т. е. у мужчин молодого возраста с пристрастием к алкоголю, ожирением и артериальной гипертонией. В некоторых случаях период асимптоматической (химической) гиперурикемии длится несколько лет и только после этого происходит клиническая презентация подагры. Следует иметь в виду, что гиперурикемии обычно предшествует гиперурикозурия. Поэтому у больных с мочекислым диатезом нужно повторно исследовать уровень мочевой кислоты не только в крови, но и в моче с целью своевременного выявления подагры.
Содержание мочевой кислоты в крови может повышаться под влиянием различных факторов, как внутренних, так и внешних. Эти факторы способствуют либо увеличению образования эндогенных пуринов, либо замедлению их выделения почками. С этих позиций выделяют два типа гиперурикемии — метаболический и почечный. Метаболический тип характеризуется повышением синтеза эндогенных пуринов при наличии высокой урикозурии и нормальном клиренсе мочевой кислоты. Напротив, при почечном типе наблюдается низкий клиренс мочевой кислоты и, следовательно, нарушение выделения мочевой кислоты почками. Представленные типы гиперурикемии имеют первостепенное значение в выборе противоподагрических модифицирующих болезнь препаратов, используемых в терапии этого заболевания.
Причины повышенного биосинтеза пуринов
Нозологические формы и клинические синдромы:
Лекарства, диета и хронические интоксикации:
Причины замедления выведения мочевой кислоты почками
Нозологические формы и клинические синдромы:
Лекарства и хронические интоксикации:
Выделяют также первичную и вторичную подагру. При первичной подагре какое-либо фоновое заболевание, предшествующее ее развитию, отсутствует. В основе такой подагры лежит семейно-генетическая аномалия пуринового обмена, детерминированная несколькими генами, или так называемый «конституциональный диспуризм». Исследования уратного гомеостаза показали аутосомно-доминантный тип наследования таких аномалий. В частности, это наблюдается при врожденных нарушениях в содержании энзимов, занимающих ключевое положение в метаболизме пуринов. Так, при снижении активности гипоксантин-гуанин-фосфорибозилтрансферазы происходит увеличение ресинтеза пуринов из нуклеотидов, что способствует развитию синдрома Леша-Найхана. Этот синдром встречается только у детей и у лиц молодого возраста и обычно заканчивается уратной нефропатией с летальным исходом. При высоком содержании фосфорибозилпирофосфата также наблюдается метаболический тип гиперурикемии, так как этот фермент участвует в синтезе предшественников мочевой кислоты. Что касается вторичной подагры, то она является одним из синдромов другого заболевания, «второй болезнью», развивающейся при многих патологических процессах и чаще всего при хронической почечной недостаточности.
Большое значение в распознавании подагры, особенно ее ранней стадии, имеет клиническая картина острого подагрического артрита. Она хорошо известна, однако частота диагностических ошибок в первый год заболевания достигает 90%, а через 5–7 лет правильный диагноз ставится только в половине случаев. Поздняя диагностика связана с недооценкой классических ранних признаков заболевания, а также с многообразием дебюта и течения подагры. Ее диагностика строится на особенностях клинической картины заболевания, повышенного содержания мочевой кислоты в крови и обнаружения кристаллов урата натрия в тканях. На практике широко применяются следующие так называемые Римские диагностические критерии подагры:
Диагноз подагры считается достоверным при наличии любых двух из четырех критериев.
Менее распространены диагностические критерии подагры, предложенные Американской коллегией ревматологов (АСК) в 1977 г., которые скорее характеризуют острый воспалительный артрит или его рецидивирующие атаки, нежели подагру в целом. Согласно этим критериям, достоверный диагноз ставится при наличии 6 из 12 признаков:
В первые 3–4 года подагра протекает по типу рецидивирующего острого воспалительного моноартрита с полным обратным развитием и восстановлением функции суставов, при этом межприступный период продолжается от нескольких месяцев до 1–2 лет. В дальнейшем этот период укорачивается, в процесс вовлекаются все новые и новые суставы и воспалительные явления локализуются не только в суставах стоп, но распространяются на суставы верхних конечностей, что обычно совпадает с образованием тофусов. Тофусы представляют собой депозиты кристаллов мочевой кислоты. Они появляются в среднем спустя 6 лет после первого приступа подагры, но иногда и через 2–3 года. Ураты чаще всего откладываются на поверхности суставного хряща, в синовиальной оболочке, синовиальных влагалищах, сухожилиях, а также в субкортикальной области эпифизов костей. Наиболее часто они располагаются на ушных раковинах и на задней поверхности локтевых суставов. Тофусы подразделяются на единичные и множественные, а также классифицируются в соответствии с их размерами, при этом к мелким относят тофусы до 1 см в диаметре, к средним — от 1 до 2,5 см и к крупным — более 2,5 см. Подагрические узлы с локализацией в опорно-двигательном аппарате являются основным элементом формирования хронического подагрического артрита. Тофусы могут располагаться в почках и других висцеральных органах.
Хроническое течение подагры не ограничивается только вовлеченностью суставов и формированием тофусов, но и характеризуется поражением внутренних органов. Подагрическая нефропатия является наиболее важным с прогностической точки зрения проявлением подагры и самой распространенной причиной летальных исходов при этом заболевании. Среди отдельных вариантов подагрической нефропатии выделяют острую мочекислую блокаду канальцев почек, мочекислый нефролитиаз, обусловленный отложением солей мочевой кислоты в чашечках и лоханках почек, хроническую уратную нефропатию и диффузный гломерулонефрит. Острая мочекислая блокада канальцев почек происходит, например, при распаде опухоли вследствие массивной медикаментозной или рентгенотерапии. Хроническая уратная нефропатия связана с отложением уратов в интерстиции почек, а развитие диффузного гломерулонефрита — с иммунными нарушениями у лиц с дисрегуляцией пуринового обмена. Такой гломерулонефрит по своей иммуноморфологии чаще всего является мезангиопролиферативным и при нем выявляют депозиты IgG и комплемента. Следует иметь в виду, что подагра часто ассоциируется с такими патологическими состояниями, как артериальная гипертония, ожирение, гиперлипидемия, жировая дистрофия печени, атеросклероз, нарушения мозгового кровообращения, алкогольная зависимость.
Течение подагры характеризуется разнообразием темпов развития болезни. Возможно относительно доброкачественное течение с редкими приступами, небольшой гиперурикемией и урикозурией и длительным сохранением функциональной недостаточности опорно-двигательного аппарата. В других случаях, напротив, с самого начала заболевания наблюдаются частые атаки острого артрита с сильными болями или непрерывные атаки с множественным поражением суставов на протяжении нескольких недель или месяцев (подагрический статус). Рефрактерное к проводимой терапии течение подагры приводит к быстрому развитию функциональной недостаточности суставов и почек.
В основе выделения вариантов течения подагры лежат: количество приступов артрита в течение года, число пораженных суставов, выраженность костно-хрящевой деструкции, наличие тофусов, патология почек и ее характер.
Варианты течения подагры
Легкое: приступы артрита 1–2 раза в год и захватывают не более 2 суставов, нет поражения почек и деструкции суставов, тофусы отсутствуют или они единичные и не превышают 1 см в диаметре.
Средней тяжести: 3–5 приступов в год, поражение 2–4 суставов, умеренно выраженная костно-суставная деструкция, множественные мелкие тофусы, поражение почек ограничено почечно-каменной болезнью.
Тяжелое: частота приступов более 5 в год, множественное поражение суставов, множественные тофусы крупных размеров, выраженная нефропатия.
Основными задачами терапии подагрического артрита являются:
Купирование острого подагрического артрита проводится противовоспалительными средствами. Для этих целей используются: колхицин — колхицин, колхикум-дисперт; нестероидные противовоспалительные препараты (НПВП) — вольтарен, дикловит, диклоран, целебрекс, мовалис); кортикостероиды — полькортолон, преднизолон, метилпреднизолон; или комбинация НПВП и кортикостероидов — амбене. Как колхицин, так и НПВП способствуют обратному развитию острого артрита в течение нескольких часов, в то время как у не прошедших лечение больных он может длиться несколько недель. До недавнего времени полагали, что лучшим препаратом для купирования приступа острого артрита при подагре является колхицин. Ярко выраженный и быстрый (в течение 48 ч) эффект колхицина рассматривался как один из диагностических признаков этого заболевания. Колхицин способен предупредить дальнейшее развитие острого приступа подагры при его назначении в первые 30–60 мин атаки. Его лечебное действие обусловлено угнетением фагоцитарной активности нейтрофилов. При остром приступе подагры мононатриевые соли уратов, фагоцитированные нейтрофилами, приводят вследствие мембранолитического их действия к гибели этих клеток и высвобождению лизосомальных ферментов, которые отвечают за развитие острого воспаления.
Из НПВП предпочтение отдают индометацину (индотард, метиндол) и диклофенаку (вольтарен, диклоран, диклофен). Эти препараты назначают в дозе 200–250 мг/сут, причем в первые часы приступа применяют большую часть суточной дозы. Проведенные контролированные исследования не выявили более высокой эффективности традиционных НПВП по сравнению с селективными ингибиторами ЦОГ-2 (нимесил, нимулид, целебрекс), например целекоксибами (коксиб, целебрекс). Однако окончательное суждение о сравнительной эффективности этих препаратов можно вынести только в ходе дальнейших исследований. Суточная доза колхицина составляет 4–6 мг/сут, причем 2/3 этой дозы больной принимает до 12 ч дня в первый день приступа. Обычно разовая доза составляет 0,6 мг и ее принимают каждый час до явного снижения подагрического воспаления. После значительного уменьшения воспаления дозу колхицина начинают снижать по 0,6 мг 2 раза в день, вплоть до полной отмены. Нередко у больных не удается наращивать суточную дозу до оптимальной из-за появления побочных реакций. Основными побочными эффектами колхицина являются тошнота, рвота, понос, возможны также геморрагический гастроэнтерит, лейкопения, нейропатия. При подагрическом статусе, характеризующемся непрерывными атаками острого артрита, рефрактерными к терапии НПВП, возможно внутривенное введение колхицина.
Противоподагрическая терапия (базисная, модифицирующая болезнь) направлена на профилактику рецидивов острого артрита, снижение содержания мочевой кислоты в крови, предупреждение дальнейшего формирования тофусов и их обратное развитие. Все противоподагрические препараты делятся на две большие группы: урикодепрессоры (урикостатики) и урикозурики. Урикодепрессоры тормозят синтез мочевой кислоты путем ингибирования фермента ксантиноксидазы, превращающего гипоксантин в ксантин, а ксантин в мочевую кислоту. Урикозурики повышают экскрецию мочевой кислоты, подавляя обратную реабсорбцию уратов почечными канальцами.
К препаратам первой группы относится аллопуринол (аллопуринол, аллопуринол-эгис, аллупол, пуринол, ремид, тиопуринол, милурит), который занимает лидирующее положение среди дру-гих противоподагрических средств. Показанием к применению аллопуринола являются метаболическая подагра, высокая гиперурикемия, частые острые атаки артрита, мочекислая болезнь, генетически обусловленный дефицит гипоксантин-гуанин-фосфорибозилтрансферазы. Применение аллопуринола возможно и у больных с подагрической нефропатией с начальными проявлениями хронической почечной недостаточности и небольшой азотемии. Начальная доза аллопуринола составляет 300 мг/сут. В случае неэффективности такой дозы ее увеличивают до 400–600 мг/сут, а при достижении клинического эффекта постепенно снижают. Поддерживающая доза определяется уровнем гиперурикемии и обычно составляет 100–300 мг/сут.
Аллопуринол способствует исчезновению атак острого артрита или их заметному ослаблению, обратному развитию тофусов и отчетливому их размягчению, снижению уровня мочевой кислоты до субнормальных цифр, нормализации показателей мочевого синдрома, урежению почечных колик и выделительной функции почек. У некоторых больных он поначалу вызывает повышение уровня мочевой кислоты и обострение подагрического артрита, поэтому на первом этапе терапии его комбинируют с противовоспалительными препаратами, в частности с низкими дозами колхицина или НПВП. По этой причине его не следует принимать при остром подагрическом артрите. При лечении аллопуринолом нередко развиваются побочные реакции, которые проявляются желудочно-кишечной токсичностью, аллергическими реакциями (кожная сыпь, эозинофилия), гепатотоксичностью с повышением сывороточных аминотрансфераз.
Урикозурические препараты, представляющие собой слабые органические кислоты, имеют меньшее значение в терапии подагры, чем урикостатики. Их не следует назначать при высоком содержании мочевой кислоты в крови, а также при нефропатии даже с начальными проявлениями почечной недостаточности. Из урикозурических препаратов сульфинпиразон и пробенецид особенно широко используются в США. Сульфинпиразон (сульфинпиразон, апо-сульфинпиразон, антуран) назначают по 200–400 мг/сут в два приема. Его, как и другие урикозурические средства, принимают с большим количеством жидкости, которую для профилактики нефролитиаза следует ощелачивать. Побочные реакции встречаются относительно часто и проявляются желудочной и кишечной диспепсией, лейкопенией, аллергическими реакциями. Противопоказанием к назначению сульфинпиразона является язвенная болезнь желудка и, конечно, подагрическая нефропатия.
Пробенецид (бенемид) является производным бензойной кислоты. Препарат назначается по 1,5–2,0 г/сут. Бензойная кислота содержится в клюкве, а также в ягодах и листьях брусники. Поэтому отвары и морсы из ягод и листьев этих растений показаны больным подагрой и в большей степени больным с подагрической нефропатией, тем более что помимо бензойной кислоты они содержат гиппуровую кислоту, обладающую урикосептическими свойствами. Урикозурическая активность присуща блокатору рецептора ангиотензина II и фенофибрату (грофибрат, нофибал). Наиболее эффективны производные бензбромарона, которые обладают не только урикозурическими свойствами, но и урикодепрессорными. Они используются в качестве монотерапии или в сочетании с аллопуринолом. Таким комбинированным препаратом является алломарон. Алломарон содержит 20 мг бензбромарона и 100 мг аллопуринола, его обычно принимают по 1 таблетке 2 раза в день.
Составной частью комплексной терапии подагры являются ощелачивающие препараты и ощелачивающие растворы, которые способны снизить риск развития нефропатии и, в частности, мочекаменной болезни. К этим препаратам относятся магурлит, блемарен и уралит. Их применение должно регулярно контролироваться показателем рН мочи. Помимо этих средств, можно принимать питьевую соду 2–4 г в день или щелочные минеральные воды.
При выраженных симптомах артрита необходимо также проводить местное лечение (долобене, финалгон, диклоран плюс, долгит крем, немулид гель, бишофит-гель).
Диете при подагре придают наибольшее значение по сравнению с другими ревматическими болезнями. Она предусматривает снижение общего калоража пищи, тем более что при подагре обычно наблюдается повышенная масса тела. Необходимо уменьшить поступление в организм экзогенных пуринов и животных жиров. Жиры снижают экскрецию мочевой кислоты почками. Крайне осторожно следует подходить к употреблению любых алкогольных напитков, включая пиво и красное вино. Исключают из пищевого рациона печенку, почки, жирные сорта мяса, мясные бульоны, копчености, горох, бобы, чечевицу, шпинат, цветную капусту, шпроты, сельдь. Следует ограничить потребление мяса до 2–3 раз в неделю, при этом лучше употреблять его в отварном виде.
Сочетание строгой диеты с длительным применением противоподагрических препаратов, а также активное воздействие на заболевания, которые повышают содержание мочевой кислоты в крови, способны существенно замедлить темпы прогрессирования костно-хрящевой деструкции, предупредить дальнейшее формирование тофусов и сохранить функциональное состояние опорно-двигательного аппарата и почек.
В. В. Бадокин, доктор медицинских наук, профессор
РМАПО, Москва