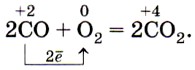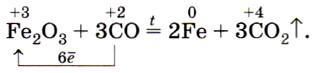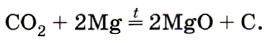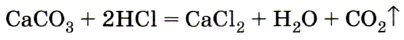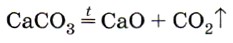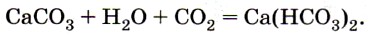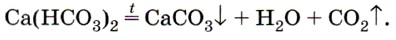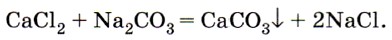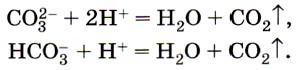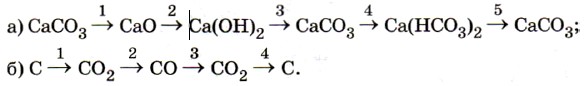оксид углерода можно обнаружить по
Тест по теме УГЛЕРОД и его соединения Вариант 2 1. Количество энергетических уровней и внешних…
Тест по теме УГЛЕРОД и его соединения
1. Количество энергетических уровней и внешних электронов в атоме углерода равно соответственно
1) 2, 2 2) 2, 4 3) 3, 4 4) 3, 6
2. Окислителем углерод является в реакции с
1) кислородом 2) хлором 3) водород 4) серой
3. Оксид кремния (IV) взаимодействует с
1) серной кислотой 2) гидроксидом натрия 3) сульфатом магния 4) нитратом серебра
4. Оксид углерода (IV) можно обнаружить по
1) вспыхиванию тлеющей лучины 2) помутнению известковой воды
3) посинению лакмусовой бумаги 4) малиновой окраске фенолфталеина
5. Оксид углерода (IV) взаимодействует с каждым из веществ
1) водой и гидроксидом бария 2) кислородом и гидроксидом кальция
3) водородом и серной кислотой 4) железом и оксидом кальция
6.Карбонат кальция превращается в гидрокарбонат под действием раствора
1) HCl 2) Ca(OH)2 3) CO2 4) BaCl2
7. Гидрокарбонат кальция превращается в карбонат под действием раствора
1) CO2 2) Ca(OH)2 3) HNO3 4) CuSO4
8. Укажите, какое суждение является правильным:
а) качественной реакцией на карбонаты является реакция с известковой водой; б) качественной реакцией на углекислый газ является реакция с сильной кислотой.
А) верно только а) Б) верно только б) В) верны оба суждения Г) оба суждения неверны
9. Адсорбционные свойства наиболее характерны для:
А) алмаза; б) активированного угля; в) графита; г) каменного угля.
10. Металлический блеск характерен:
А) графиту; б) алмазу; в) карбину; г) фуллерену.
Углерод
Углерод
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Природные соединения
Получение
Химические свойства
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
Может восстановить и собственный оксид:
В реакциях с кислотами углерод проявляет себя как восстановитель:
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Тест по теме УГЛЕРОД и его соединения
1. Количество энергетических уровней и внешних электронов в атоме углерода равно соответственно
1) 2, 2 2) 2, 4 3) 3, 4 4) 3, 6
2. Окислителем углерод является в реакции с
1) кислородом 2) хлором 3) водород 4) серой
3. Оксид кремния (IV) взаимодействует с
1) серной кислотой 2) гидроксидом натрия 3) сульфатом магния 4) нитратом серебра
4. Оксид углерода (IV) можно обнаружить по
1) вспыхиванию тлеющей лучины 2) помутнению известковой воды
3) посинению лакмусовой бумаги 4) малиновой окраске фенолфталеина
5. Оксид углерода (IV) взаимодействует с каждым из веществ
1) водой и гидроксидом бария 2) кислородом и гидроксидом кальция
3) водородом и серной кислотой 4) железом и оксидом кальция
6.Карбонат кальция превращается в гидрокарбонат под действием раствора
1) HCl 2) Ca(OH)2 3) CO2 4) BaCl2
7. Гидрокарбонат кальция превращается в карбонат под действием раствора
1) CO2 2) Ca(OH)2 3) HNO3 4) CuSO4
8. Укажите, какое суждение является правильным:
а) качественной реакцией на карбонаты является реакция с известковой водой; б) качественной реакцией на углекислый газ является реакция с сильной кислотой.
А) верно только а) Б) верно только б) В) верны оба суждения Г) оба суждения неверны
9. Адсорбционные свойства наиболее характерны для:
А) алмаза; б) активированного угля; в) графита; г) каменного угля.
10. Металлический блеск характерен:
А) графиту; б) алмазу; в) карбину; г) фуллерену.
Оксид углерода. Обнаружение и определение
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Оксид углерода. Обнаружение и определение
Оксид углерода. Токсикологическое значение
Из ядовитых газообразных веществ особое токсикологическое значение имеет оксид углерода (II), который можно обнаружить и определить количественно без изолирования непосредственно в биологическом объекте.
Оксид углерода (II), угарный газ (СО) – газ без цвета и запаха. С воздухом образует взрывоопасные смеси. Угарный газ находится везде, где существуют условия для неполного сгорания веществ, содержащих углерод.
Токсическое действие. Окись углерода присоединяется к гемоглобину крови, образуя карбоксигемоглобин (НЬСО), в результате чего понижается содержание кислорода в крови и тканях (аноксемия и гипоксия). Низкие концентрации кислорода оказывает токсическое действие на клетки, нарушая дыхание тканей.
Для хронического отравления СО характерно разнообразие многочисленных симптомов, наиболее типичными из которых являются психическая и физическая астения, головные боли и головокружения.
Оксид углерода. Поступление в организм и всасывание.
Оксид углерода (II) поступает в организм через дыхательные пути и определяется концентрацией во вдыхаемом воздухе угарного газа и кислорода, длительностью воздействия СО и интенсивностью лёгочной вентиляции. Окись углерода взаимодействует с двухвалентным железом гемоглобина крови, вытесняя из оксигемоглобина (НЬО2) кислород и образуя карбоксигемоглобин (НЬСО).
Грамм гемоглобина может связать 1,34 мл кислорода или окиси углерода. Сродство гемоглобина к окиси углерода в 220-290 раз больше, чем к кислороду, поэтому СО легко вытесняет кислород из оксигемоглобина, образуя более стойкое соединение. Карбоксигемоглобин диссоциирует в 3600 раз медленнее, чем оксигемоглобин, что приводит к накоплению карбоксигемоглобина в крови и усилению кислородной недостаточности.
Окись углерода также связывается с двухвалентным железом миоглобина, цитохрома, цитохромоксидазы, пероксидазы и каталазы. В незначительной степени СО окисляется в углекислоту.
Оксид углерода. Распределение в организме.
При остром отравлении высокими концентрациями СО большая часть яда, находящегося в крови, связана с эритроцитами. Повторные острые отравления приводят к повышению уровня СО в плазме, а при хроническом отравлении в плазме обнаруживается 25-30% общего количества окиси углерода, связанной кровью. В значительном количестве СО переходит из крови в ткани. При остром отравлении в скелетных мышцах и миокарде обнаруживается до 13,5% от общего количества адсорбированной СО, где она связана с миоглобином.
Оксид углерода. Выделение из организма.
Выделение СО происходит через дыхательные пути и продолжается несколько часов. Около 60-70% яда выделяется в течение первого часа, а за 4 часа составляет 96% от адсорбированной организмом дозы. Некоторое количество СО выводится через ЖКТ, ничтожные количества выделяются через кожу, а также с мочой в виде комплексного соединения с железом.
Объектами исследования являются кровь из трупа и воздух, содержащий СО.
При острых отравлениях концентрация карбоксигемоглобина в крови составляет около 40%, а при смертельных исходах до 60% и более.
Обнаружение карбоксигемоглобина в крови является доказательством отравления угарным газом. Для обнаружения и количественного определения СО используют химические, газохроматографические, фотоколориметрические, спектрофотометрические и спектроскопические методы анализа.
1. Спектроскопический метод. При исследовании крови спектроскопом в спектре можно увидеть тёмные полосы поглощения определённых длин волн для гемоглобина и его производных. В судебно-медицинской практике часто используют микроспектроскоп (спектроскоп, соединённый с окуляром).
Оксигемоглобин в видимой части спектра имеет две полосы поглощения при длинах волн 577-589 и 536-556 нм. Карбоксигемоглобин также имеет две полосы поглощения при 564-579 и 523-536 нм.
Кровь для исследования разбавляют водой до светло-розовой окраски (чётко видны спектральные полосы). К четырём объёмам водного раствора крови добавляют 1 мл свежеприготовленного раствора аммония сульфида или другого восстановителя. При этом оксигемоглобин восстанавливается до дезоксигемоглобина – исчезают полосы поглощения оксигемоглобина и появляется широкая полоса поглощения дезоксигемоглобина при длинах волн 543-596 нм. Карбоксигемоглобин при этом не восстанавливается и его полосы поглощения не исчезают. По этим полосам делают заключение об отравлении СО.
Спектроскопический метод можно использовать при содержании в крови от 10% до 30% карбоксигемоглобина.
2. Спектрофотометрическое определение. Кровь в количестве 0,1 мл растворяют в 10 мл аммиака, наливают в кювету и измеряют оптическую плотность (D) при длинах волн 578 и 564 нм. Содержание карбоксигемоглобина в крови рассчитывают по формуле:
При содержании карбоксигемоглобина до 30% точность метода составляет около 1,5% а при содержании его в крови до 50%, точность до 5%. Проведение анализа требует 3-5 мин.
3. Фотометрическое определение. Кровь в количестве 0,1 мл растворяют в 5 или 10 мл аммиака и 0,5 мл полученного раствора вносят в кювету. В кювету сравнения вносят раствор аммиака. Измеряют экстинкцию при длинах волны пропускаемого света 530 и 470 нм. По полученным средним значениям экстинкций вычисляют:
Процент карбоксигемоглобина определяют по формуле:
%СОНb = (97,5Q – 100) : (0,0955Q + 0,342)
Процент карбоксигемоглобина можно определить также по калибровочному графику (зависимость между величиной Q и содержанием карбоксигемоглобина в крови). Ошибка определения не более 4%, время выполнения анализа около 10 мин.
4. Химические методы обнаружения СО в крови. Суть этих методов состоит в том, что при добавлении соответствующих реактивов окраска нормальной крови изменяется, а кровь, содержащая карбоксигемоглобин окраску не изменяет или изменяет незначительно. Поэтому всегда проводят два опыта.
Заключение о наличии карбоксигемоглобина можно сделать на основании большинства этих реакций. Если в крови мало карбоксигемоглобина, то окраска может измениться, поэтому эти реакции непригодны для определения малых количеств СОНb.
Оксид углерода. Количественное определение.
1.Определение СО в воздухе. Метод основан на окислении СО в СO2 йодноватым ангидридом и его определении.
Избыток гидроксида бария оттитровывают кислотой соляной.
Метод основан на определении карбоксигемоглобина спектроскопически. Для этого готовят ряд растворов: раствор А – раствор исследуемой крови;
раствор Б – раствор крови, содержащей СОНb и дезоксигемоглобин. Его готовят из раствора А добавлением натрия дитионата.
раствор В – раствор крови, в котором все формы гемоглобина переведены в СОНb.
Расчёт содержания СОНb в исследуемой крови в процентах производят по следующей формуле:
Р = 100 – (DCOHb – DHbCOHb) 100 : (DCOHb, К )где
Р = 100 – (DCOHb – DHbCOHb) 100 : (DCOHb, К )где
DCOHb – оптическая плотность раствора В (при 538 нм)
DHbCOHb – оптическая плотность раствора Б (при 538 нм)
DHb – оптическая плотность раствора Б в изобестической точке (точка в которой оптические плотности растворов СОНb и дезоксигемоглобина равны) при 550 нм К- коэффициент, равный 0,372.
При концентрациях СОНb от 3% до 20% ошибка не более 3%, а при концентрациях свыше 20% не более 5%.
§ 34. Кислородные соединения углерода
Углерод образует два оксида — оксид углерода (II) СО и оксид углерода (IV) CO2.
Оксид углерода (II) СО — бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, так как он очень ядовит. Попадая при дыхании в кровь, он быстро соединяется с гемоглобином, образуя прочное соединение карбоксигемоглобин (объясните происхождение этого термина), тем самым лишая гемоглобин возможности переносить кислород. При вдыхании воздуха, содержащего 0,1% СО, человек может внезапно потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива (напишите уравнение соответствующей химической реакции), вот почему так опасно преждевременное закрывание дымоходов печей (рис. 152).
Оксид углерода (II) относят, как вы уже знаете, к несолеобразующим оксидам. Будучи оксидом неметалла, он должен реагировать с щелочами и основными оксидами с образованием соли и воды, однако этого не наблюдается.
Оксид углерода (II) способен отнимать кислород у оксидов металлов, т. е. восстанавливать металлы из их оксидов:
Именно это свойство оксида углерода (II) используют в металлургии при выплавке чугуна.
Оксид углерода (IV) СO2 — бесцветный, не имеющий запаха газ, широко известный под названием углекислый газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в одном объёме воды растворяется один объём углекислого газа.
При давлении примерно 60 атм углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твёрдую снегообразную массу, которую в промышленности прессуют, — это известный вам «сухой лёд», который применяют для хранения пищевых продуктов. Вы уже знаете, что твёрдый углекислый газ имеет молекулярную решётку и способен к возгонке (что это такое?).
Углекислый газ СO2 как типичный кислотный оксид взаимодействует с щелочами (например, вызывает помутнение известковой воды), с основными оксидами и водой. Он не горит и не поддерживает горения (рис. 153) и потому применяется для тушения пожаров. Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
Углекислый газ получают, действуя на соли угольной кислоты — карбонаты растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии соляной кислоты на мел или мрамор (рис. 154):
В промышленности углекислый газ получают обжигом известняка:
Углекислый газ используют также для изготовления шипучих напитков и получения соды.
Применение углекислого газа показано на рисунке 155.
При растворении оксида углерода (IV) в воде образуется очень нестойкая угольная кислота Н2СO3, которая легко разлагается на исходные компоненты — углекислый газ и воду:
Будучи двухосновной, угольная кислота образует два ряда солей: средние — карбонаты, например СаСO3, и кислые — гидрокарбонаты, например Са(НСO3)2. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Кислые соли, как правило, растворимы в воде.
При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
Именно наличием гидрокарбонатов кальция и магния в природной воде и объясняется её временная жёсткость. Почему временная? Потому что при нагревании растворимый гидрокарбонат кальция снова превращается в нерастворимый карбонат:
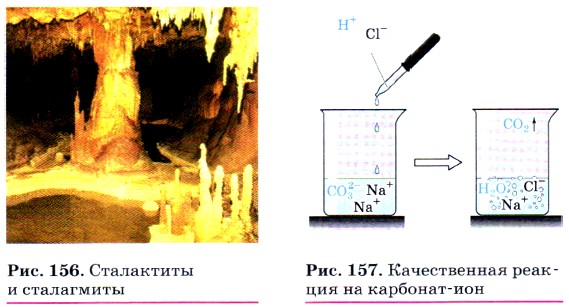
Эта реакция приводит к образованию накипи на стенках котлов, труб парового отопления и домашних чайников. В природе в результате этой реакции в пещерах формируются свисающие вниз причудливые сталактиты, навстречу которым снизу вырастают сталагмиты (рис. 156).
Другие соли кальция и магния, в частности хлориды и сульфаты, придают воде постоянную жёсткость, которую невозможно устранить кипячением. Для удаления солей, вызывающих постоянную жёсткость, приходится использовать другой карбонат — соду Na2CO3, которая переводит ионы Са 2+ в осадок, например:
Соду можно использовать и для устранения временной жёсткости воды.
Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот: при действии на них кислот наблюдается характерное «вскипание» из-за выделяющихся пузырьков углекислого газа (рис. 157):
Эта реакция является качественной на соли угольной кислоты.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Рассмотрите реакцию восстановления оксида железа (III) оксидом углерода (II) как окислительно-восстановительный процесс.
2. Какие несолеобразующие оксиды вам ещё известны, кроме оксида углерода (II)? Верно ли с химической точки зрения другое синонимическое название их — безразличные, или индифферентные, оксиды?
3. Напишите уравнения реакций, характеризующие свойства оксида углерода (IV). Рассмотрите взаимодействие оксида углерода (IV) с магнием как окислительно-восстановительный процесс.
4. Почему раствор углекислого газа окрашивает лакмус в красный цвет? Почему при длительном хранении этого раствора лакмус снова приобретает фиолетовую окраску?
5. Напишите формулы следующих солей: карбоната меди (II), гидрокарбоната меди (II), гидроксокарбоната меди (II). К какой группе солей относится каждая соль? Как ещё называют последнюю соль?
6. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Рассмотрите процессы окисления-восстановления.