об отличиях и сходствах вирусов и прионов можно сказать следующее
Параграф 86 вирусы и прионы
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив НЕ НУЖНО зубрить.
Замечания и отзывы можно прислать по почте: exam_bch@mail.ru
https://vk.com/bch_5
ПАРАГРАФ 86:
«ВИРУСЫ и прионы».
См. сначала параграфы 57, 58, 73, 74, 77, 79, 80, 83, 87.
86. 1. Определение, химический состав вирусов, функции компонентов.
Функция нуклеиновой кислоты вируса: …
Функция белков вирусных частиц: …
Размножение вирусов, синтез их нуклеиновых кислот.
Где размножается вирус?
О видах вирусов
86. 2. (Молекулярные механизмы действия вирусов.)
Реакция иммунной системы на обнаружение вируса.
Как вирусная частица попадает в клетки.
Что происходит с вирусной частицей после её попадания в клетку.
86. 3. Онкогенные вирусы. См. п.87.
86. 4. ВИЧ. См. п.77 и 80.
86. 5. Прионы.
86. 1. Определение, химический состав вирусов, функции компонентов. –
Опеределение вируса.
Вирусами называют КОМПЛЕКСЫ НУКЛЕИНОВЫХ КИСЛОТ С БЕЛКАМИ,
которые могут находиться во внешней среде вне клеток и
могут при попадании в организм проникать в клетки и размножаться внутри клеток.
Некоторые вирусы вдобавок к НК и белкам содержат липиды и углеводы.
Таким образом, вирусы не являются клетками, у вирусов нет органелл.
Отдельный комплекс нуклеиновых кислот с белками называется вирусной частицей или вирионом.
Функция нуклеиновой кислоты вируса:
нуклеиновые кислоты используются для синтеза белков вирусных частиц (кодируют первичную структуру белка).
Функция белков вирусных частиц:
1 – защищают НК от повреждений (НК сами по себе очень неустойчивы), образуя оболочку вокруг НК,
2 – участвуют в размножении вирусов в качестве ферментов и т.д. см. далее.
Углеводы вирусных частиц часто находятся на поверхности вирусных частиц и могут помогать вирусным частицам проникать в клетки.
Отдельная вирусная частица и вирусные частицы данного вида вирусов содержат только один вид НК – или ДНК, или РНК.
Вирусы, в вирионе которых находится ДНК, называются ДНК-овые вирусами,
а вирусы, в вирионе которых находится РНК, называются, РНК-овыми вирусами.
ДНК вируса может быть не только двухцепочечной, но и ОДНОЦЕПОЧЕЧНОЙ.
РНК вируса может быть как одноцепочечной (как в клетках), так и ДВУХЦЕПОЧЕЧНОЙ.
Размножение вирусов, синтез их нуклеиновых кислот.
Синтез нуклеиновых кислот вирусов происходит разными способами. –
1) Наряду с репликацией ДНК (см. п. 78),
2) у вирусов есть репликация РНК
3) и обратная транскрипция (см. п.80).
Вирусы, при размножении которых происходит обратная транскрипция, называются ретровирусами («ретро» – обратно, назад).
Какой бы ни была нуклеиновая кислота в самом вирионе,
при размножении вируса происходит синтез вирусных матричных РНК для синтеза вирусных белков (для трансляции).
Где размножается вирус?
Синтез вирусных нуклеиновых кислот и синтез вирусных белков может происходить только внутри клеток,
так как для синтезов нужны среда, рибосомы (осуществляются синтез белка), нуклеотиды и аминокислоты и т.д.
Поэтому размножаться вне клеток вирусы не могут. –
Пока вирус не проник в клетку, он не может размножаться, не может как-то влиять на обмен веществ в организме.
Поэтому наличие вируса (вирионов) в крови
не означает, что человек будет болеть болезнью, которая вызывается этим вирусом.
Он может заболеть, только если вирусные частицы проникнут в клетки,
а если они не проникнут в клетки, то человек не заболеет, хоть и будет носителем вируса.
Вирусы, содержащие разные нуклеиновые кислоты (то есть с разными последовательностями нуклеотидов) и разные белки, относят к разным видам вирусов.
Вирусные частицы с одинаковыми (или очень похожими) последовательностями нуклеотидов в НК, относятся к вирусу одного и того же вида.
Кроме того, последовательность нуклеотидов нуклеиной кислоты вируса данного вида
может меняться, то есть вирус может мутировать.
В итоге получается другой ШТАММ данного вида вируса, но сам вирус относится к тому же виду вирусов, что и до мутации.
Эукариотические и прокариотические клетки поражаются разными вирусами.
Нуклеиновые кислоты вирусов, поражающих эукариотические клетки, содержат интроны, как и ДНК эукариот,
а нуклеиновые кислоты вирусов, поражающих прокариотические клетки, НЕ содержат интронов, как и ДНК прокариот.
Есть гипотеза, согласно которой вирусы образовались из фрагментов ДНК клеток.
Предполагают, что вирусы – это «потомки» транспозонов
(мобильных генов, «прыгающих») – участков ДНК, способных перемещаться из одного участка ДНК в другие.
Вирусы, которые поражают бактерии, называются БАКТЕРИОФАГАМИ.
Бактериофаги могут использоваться для внесения в клетку бактерии чужих для неё генов для синтеза клеткой белков, кодируемых этими генами,
То есть бактериофаги могут играть роль векторов – это используется генной инженерией.
В эукариотические клетки вирусы попадают не так, как в бактериальные (далее).
86. 2. (Молекулярные механизмы действия вирусов.)
Реакция иммунной системы на обнаружение вируса.
Когда антитела встречаются с вирусными частицами, антитела должны «заметить»,
что белки вирусной частицы – чужеродные (не свойственные данному организму),
то есть что они являются АНТИГЕНАМИ.
И связаться с этими антигенами, что позволит иммунным клеткам
вирусную частицу и уничтожить её,
расщепив её белки и нуклеиновые кислоты на аминокислоты и нуклеотиды.
Если иммунная система (антитела и клетки) не успела уничтожить вирус, то
вирус может оказаться на поверхности тех клеток, которые являются «мишенями» данного вируса
(например, вирусы гепатитов поражают клетки печени,
а ВИЧ поражает иммунные клетки).
Как вирусная частица попадает в клетки.
Проникновение вирусной частицы в клетку начинается с того, что
вирус связывается с определённым белком на поверхности клетки,
который таким образом выполняет функцию РЕЦЕПТОРА клетки для этого вируса.
Роль рецептора вируса обычно играют белки, предназначенные для других целей –
например, ВИЧ использует рецепторы хемокинов.
Если рецепторы вируса отличаются от обычных так, что вирус не может с их помощью проникнуть в клетку, то вирус не приведёт к заболеванию.
Причиной отличия рецептора может быть мутация гена, который кодирует этот рецептор.
Что происходит с вирусной частицей после её попадания в клетку.
После связывания вируса с его рецептором происходит ЭНДОЦИТОЗ («поглощение»),
в результате чего вирусная частица оказывается внутри клетки.
(Эндоцитоз – это «впячивание» участка мембраны внутрь клетки,
после которого происходит «отшнуровывание» этого участка от мембраны –
в итоге вещества, которые были на поверхности участка мембраны, оказываются внутри клетки).
После попадания вирусной частицы внутрь клетки
вирусная нуклеиновая кислота высвобождается, после чего
могут синтезироваться новые молекулы вирусной нуклеиновой кислоты (см. п.77)
и новые молекулы вирусных белков (п.82).
После этого из молекул вирусных нуклеиновых кислот и молекул вирусных белков
могут образовываться новые вирусные частицы –
так происходит РАЗМНОЖЕНИЕ ВИРУСОВ.
Новые вирусные частицы могут покидать клетку, в которой образовались,
и поступать в новые клетки, заражая всё новые и новые клетки.
Если заражённые вирусом клетки подвергнутся АПОПТОЗУ (см. п. 79),
то распространение вирусных частиц может затормозиться.
Поэтому замедленный апоптоз способствует распространению вирусной инфекции.
Накопление вирусных частиц в клетке может приводить к РАЗРУШЕНИЮ КЛЕТКИ;
кроме того, оно нарушает нормальную жизнедеятельность клетки и организма –
всё это приводит к появлению симптомов вирусной инфекции.
Нуклеиновые кислоты некоторых вирусов (см. ВИЧ далее) могут использоваться
в качестве матриц для образования двухцепочечных ДНК (вирусных ДНК),
которые способны встраиваться в ДНК человека –
это встраивание называется интегрированием в геном,
оно относится к ПЕРЕСТРОЙКАМ генома – см. п.79.
86. 3. Онкогенные вирусы. См. п.87.
Некоторые вирусы способствуют появлению онкологических заболеваний.
Такие вирусы называются онкогенными вирусами.
Примеры онкогенных вирусов:
вирус папилломы человека способен приводит к раку матки,
вирусы гепатитов В и С приводят к раку печени.
Онкогенные вирусы относят к группе биологических мутагенов – см. п.79.
Почему некоторые вирусы могут приводить к онкологическим заболеваниям (см. п.87 и п.92, 98):
потому что онкогенные вирусы приводят к таким МУТАЦИЯМ,
которые способствуют появлению онкологических заболеваний.
Например, считается, что онкогенными являются те вирусы,
которые приводят к встраиванию вирусных ДНК в ДНК (геном) человека (интегрируется).
Потому что это встраивание может изменить тот участок ДНК,
в который встраивается вирусная ДНК (то есть привести к мутации).
Мутация ДНК человека может привести к появлению гена, который кодирует белки, «заставляющие» клетку слишком часто делиться (то есть привести к превращению протоонкогена в онкоген – п.87).
В норме, до мутации, протоонкоген кодирует белки, которые стимулируют деление клеток и относятся к онкобелкам.
В норме активность онкобелков регулируется,
поэтому они стимулируют деление клетки только тогда, когда нужно –
и поэтому деление клетки (и образованных при её делении клеток) не приводит к образование опухоли.
Но после мутации протоонкогена он может измениться так, что
кодируемые им онкобелки не смогут регулироваться
и станут стимулировать деление клетки постоянно, без остановки,
что может привести к появлению опухоли,
если мутантные клетки не подвергнутся апоптозу
или не уничтожатся клетками иммунной системы.
Мутация ДНК человека может привести к мутации тех генов, которые кодируют белки,
«запускающие» апоптоз, который мог бы предотвратить рост опухоли.
В результате мутации генов, кодирующих белки апоптоза,
эти белки могут потерять способность участвовать в апоптозе
и предотвратить развитие онкологического заболевания.
86. 4. ВИЧ. См. п.77 и 80.
ВИЧ – это вирус иммунодефицита человека.
Размножение ВИЧ в организме человека может привести к развитию СПИДа –
Синдрома Приобретённого Иммунодефицита Человека.
ВИЧ повреждает клетки иммунной системы (Т-хелперы, макрофаги),
что приводит к дефициту иммунных клеток и снижению иммунитета (иммунодефициту).
1. После попадания ВИЧ в организм человека
ВИЧ, как и все вирусы, сначала связывается с рецепторами на поверхности клеток:
ВИЧ связывается с рецепторами хемокинов
(хемокиновыми рецепторами;
хемокины – это гормоны, относятся к цитокинам)
и СД4 рецепторами на поверхности клеток иммунной системы.
Связыванию ВИЧ с рецепторами помогают гликопротеины, расположенные на поверхности вирусной частицы ВИЧ.
Есть люди, в организме которых есть ВИЧ, но у которых не развивается СПИД –
то есть они являются носителями вируса, они могут заразить ВИЧ,
но больными они не являются.
Предполагают, что это связано с тем, что ВИЧ не может размножаться в организме этих людей,
поскольку не проникает в их клетки из-за особенностей строения рецепторов ВИЧ у этих людей:
возможно, из-за мутаций генов, кодирующих эти рецепторы.
2. В качестве нуклеиновой кислоты в ВИЧ содержится одноцепочечная РНК.
В клетках РНК вируса становится матрицей для синтеза комплементарной ей цепи ДНК
(комплементарной ДНК, кДНК),
который катализируется ферментом обратная транскриптаза
(потому что синтез ДНК на матрице РНК называется обратной транскрипцией),
который содержался в вирусной частице ВИЧ.
Затем на матрице первой цепи ДНК синтезируется вторая цепь ДНК,
в результате чего образуется двухцепочечная ДНК.
Эта вирусная ДНК способна встраиваться в ДНК человека
с помощью фермента ИНТЕГРАЗЫ, который тоже содержится в вирусной частице ВИЧ.
3. В некоторый момент вирусная ДНК, находящаяся в составе ДНК человека,
может использоваться для синтеза вирусных РНК (то есть для транскрипции – п.80).
4. Вирусные РНК могут использоваться для синтеза вирусных белков (для трансляции) с помощью рибосом самой клетки.
5. Один из ферментов ВИЧ осуществляет расщепление полипептидной цепи, синтезированной на вирусной РНК;
этот фермент называется ПРОТЕАЗОЙ.
В итоге образуются вирусные белки, в том числе уже названные протеаза, интеграза и обратная транскриптаза.
6. Объединение вирусных белков с вирусной РНК приводит
к появлению новых вирусных частиц ВИЧ,
которые могут разрушать клетки, поступать в кровь и проникать в новые клетки.
Диагностика ВИЧ
осуществляется методом ПЦР и с помощью иммуноферментного анализа.
Метод ПЦР быстрее и надёжнее.
СПИД пока считается неизлечимым заболеванием.
Но замедлить развитие СПИДа и продлить жизнь человека, инфицированного ВИЧ, можно за счёт замедления размножения ВИЧ в организме заражённого.
Размножение ВИЧ замедляется за счёт применения лекарств,
снижающих активность ферментов ВИЧ, участвующих в размножении ВИЧ (см. выше),
то есть за счёт применения ИНГИБИТОРОВ ферментов ВИЧ.
Чем раньше начинают лечение инфицированного ВИЧ – тем дольше он проживёт. Поэтому важно вовремя делать анализ на ВИЧ при наличии оснований предполагать, что человек мог заразиться ВИЧ.
При наличии ВИЧ у беременной есть шанс родить здорового ребёнка,
если вовремя сделать анализ на ВИЧ и провести лечение.
Прионами называют белки с особой структурой, которая приводит к так называемым прионовым болезням:
куру, болезни Крейцфельдта-Якобы, почесухе овец, коровьему бешенству.
Особенность структуры прионов в том, что в них много бета-структур – п.58.
Из-за этого прионы образуют нерастворимые в воде «агрегаты»,
накопление которых в клетках и в межклеточной среде приводит к повреждению тканей и развитию заболеваний.
У прионов есть способность
превращать молекулы нормальных белков в прионы
за счёт того, что под влиянием структуры уже имеющихся молекул прионов
структура молекул ряда других белов может измениться так,
что эти молекулы тоже становятся прионами –
нерастворимыми в воде молекулами,
под влиянием которых могут стать прионами другие молекулы белков –
то есть происходит как бы цепная реакция;
из-за этого число прионов в организме становится всё больше.
Из-за этого свойства прионы считаются инфекционными белками,
а прионовые болезни считаются заразными
(заражение происходит при попадании прионов в организм – обычно в качестве пищи).
В случае с прионами увеличение числа болезнетворных молекул
происходит не путём деления клеток
(в отличие от бактериальных и других инфекций, где бактерии размножаются делением)
и не путём синтеза нуклеиновых кислот (см. выше о размножении вирусов),
а под влиянием уже имеющихся молекул прионов.
ЗдоровьеПрионы: Что мы знаем
о белках, которые убивают
И при чём здесь каннибалы из Новой Гвинеи
Текст: Марина Левичева
Белок — главный строительный материал организма и неизменная составляющая здорового рациона. Хотя белки всегда волновали исследователей, сегодня внимание последних переключилось на особый вид — прионы. В интернете как их только не называют: «идеальные убийцы», «ключ к бессмертию» и даже «молекулы-зомби». Научное сообщество ломает голову над тем, как использовать белки, способные стремительно и неотвратимо разрушить мозг, на благо человечества. Мы решили разобраться, что такое прионы, и спросили экспертов, чем белки-убийцы потенциально могут быть полезны для человека.
Почему о них заговорили
Прионы стали изучать, потому что именно они — причина редких, но очень опасных болезней человека и животных. В их числе так называемое коровье бешенство, почесуха овец и, например, летальная семейная бессонница, при которой человек практически перестаёт спать, а в течение 12–18 месяцев умирает на фоне прогрессирующей деменции. Другой пример прионного заболевания — болезнь Крейтцфельдта — Якоба, приводящая к смерти в течение полугода или года после появления первых симптомов; болезнь поражает головной мозг, поэтому развиваются нарушения памяти и внимания, а затем расстройство координации и судороги. Последняя входит в список самых опасных заболеваний в мире, потому что врачи просто-напросто не знают, что с ней делать. А началось всё с загадочной болезни куру в Папуа — Новой Гвинее, которой, казалось, не было никакого разумного объяснения.
Как их обнаружили
Что это вообще такое
Поначалу учёные думали, что нашли новый вирус или вирусную частицу. Прионы действительно схожи с вирусами тем, что не имеют клеточной структуры — то есть не состоят из клеток, в отличие от бактерий. При этом вирус представляет собой нуклеиновую кислоту, то есть ДНК или РНК, в белковой оболочке. Но когда на прионы воздействовали средствами, уничтожающими эти кислоты, опасные инфекционные качества сохранялись. Постепенно был сделан вывод, что прион — это просто белок, только с необычной структурой. Все белковые молекулы имеют определённую трёхмерную конфигурацию — если сильно упростить, это то, как цепочка аминокислот уложена в пространстве. Так вот, у прионов эта структура аномальная; удивительно, но при «обычном» химическом составе именно эта аномалия конфигурации делает прион смертельно опасным.
Как из нормального белка получается аномальный
Название белкам, работающим против человека, дал американский врач Стенли Прузинер. Объединив слова protein (белок) и infection (инфекция), он получил «прионы», обозначил их как новейший тип биологических возбудителей инфекции и впервые описал принцип их действия. В 1997 году и он получил Нобелевскую премию за проделанную работу. Прузинер обнаружил и белок, порождающий прионы — его назвали прионным белком, PrP. Самое интересное, что кодирующий PrP ген содержится в двадцатой хромосоме человека — то есть он имеется в ДНК любого из нас. Но шанс его преобразования в прион минимален, и большинство людей спокойно живут без риска прионных заболеваний. Тем не менее всего одна ошибка в синтезе белка может привести к преобразованию нормального PrPC в аномальный PrPSc.
Как объясняет Валерий Ильинский, генетик и генеральный директор Genotek, прионы — это обычные белки, которые приобрели необычную структуру. Это позволяет им менять структуру аналогичных белков, также превращая их в прионы, то есть происходит процесс, подобный заражению. Для начала заболевания необходимо проявление первого повреждённого белка — это может произойти либо в результате спонтанной ошибки при его синтезе, либо после попадания приона извне, от другого человека или животного. А дальше запускается цепная реакция.
Рустам Зиганшин, кандидат химических наук, отмечает, что причина и механизм преобразования «нормальной» формы прионного белка в опасную сегодня очень слабо изучена. В экспериментах in vitro (в пробирке) для такого преобразования требуются различные дополнительные факторы. В то же время в экспериментах на животных прионные болезни развивались, когда «нормальный» прионный белок вводили мышам, вообще лишённым программирующего его гена. Непонятно, что заставляло его становиться «агрессивным» в этом случае.
Вечная молодость или неизбежная смерть
Сейчас заговорили и о том, что с прионным механизмом могут быть связаны, например, болезнь Альцгеймера или болезнь Паркинсона. Если это так, то можно ожидать появления новых методов лечения или профилактики этих серьёзных заболеваний. Интересно, что на прионы по механизму действия похожи и дрожжевые белки — вполне возможно, что дрожжи помогут в изучении этих странных молекул. Возникают и разговоры о том, что именно прионы помогут найти лекарство от разных злокачественных опухолей или ВИЧ-инфекции, да и вообще станут «философским камнем», который приведёт человечество к вечной жизни или вечной молодости. Впрочем, пока эти высказывания необоснованны.
Рустам Зиганшин поясняет, что, как и любые исследования в области биологии, изучение прионных белков расширяет границы наших знаний о живом. С практической точки зрения результаты могут помочь разобраться с тем, как развивается ряд опасных, пока ещё неизлечимых, заболеваний. Возможно, мы получим и инструмент для борьбы с ними. Если понять, как из нормального белка получается аномальный, и научиться контролировать этот процесс, то, может быть, мы сумеем запускать его и в обратную сторону — то есть превращать патологические белки в здоровые, а с ними и возвращать здоровье тканям и органам.
Прионы — страх и ужас будущего
«Предрассветная дымка нехотя отступала по оврагам, проступали стебли ржи, переливающиеся под взмахами ветра. Птицы уже успели обрадоваться утру и ненавязчиво щебетали над ухом. Последние капли сна упали в чашку ароматного кофе. Приятно встречать диск солнца, растягивая заиндевевшие суставы и вглядываясь в даль. Кто это? Застыла мысль, когда взгляд скользнул на тропинку, бегущую из леса. Широкая улыбка озарила лицо. С первых движений он узнал ее. Только она могла двигаться с такой грацией и изяществом лани. Рука замерла на полпути к столу. Продолжая улыбаться, он вдруг резко повернулся и зашагал на кухню. Появились на столе еще одна чашка и поднос с ягодами. Аромат лавандового сиропа заполонил веранду. Хороший будет день, подумалось ему, приятный завтрак – уж точно.
Горсть малины быстро исчезала с подноса ягода за ягодой. Нежный женский голос рассказывал последние вести. За прошедшую неделю не поставили ни одного креста на городском кладбище. Мы дожили! — Выдох радости вырвался из уже скукоженных от возраста легких. Да!- ответила она ему. Эти чертовы четверть века. Четверть века, которые не оставили на твоем лице ни одного гладкого участка.
Его уже глубоко близорукие глаза смотрели на нее и в них она видела бесконечные линии графиков масс-спектрометра, видела ту бездонную усталость, которая не отступала в попытках уложить его в ящик. Он справился, выдержал. У людей больше не было ужасного животного страха сгинуть, наверное, самой ужасной смертью, что можно было представить…»
Великобритания, первая половина 18 века. Туман рассеивается над зелеными сочными полями. Большое стадо овец не спеша продвигается в сторону реки. Вдруг мы замечаем что-то необычное. Как минимум пятая часть овец неистово катается по траве и трется шкурой о камни, выступающие над поверхностью земли, оставляя за собой беспорядочные клочья. Расчесанные, потерявшие шерсть бока покрыты страшными язвинами и эррозиями. Часть овец уже не способна чесаться, они просто медленно, трясущейся походкой, скрежеща зубами идут по полю, к месту последнего успокоения. Что же это за напасть такая, думали скотоводы, называя болезнь по ее главному проявлению – СКРЕПИ («почесуха»). Эта зараза не отступала столетиями, то и дело появляясь то там, то здесь, оставляя после себя разоренные семьи.
Настоящие ученые – не совсем обычные люди, знакомясь с их биографиями, часто поражаешься, каким же сумасшедшим вихрем крутилась шарманка судьбы.
Одна из ниточек нашего повествования начнется с жизнеописания Даниэля Карлтона Гайдусека (1923-2008). Представим себе молодого человека, ему 23 года, он только что получил степень магистра в Гарварде, с огромным воодушевлением едет работать в Калифорнийский технологический, да не абы с кем, а с самим Лайнусом Полингом (дважды Нобелевский лауреат). Спустя три года он принимает приглашение и занимает должность научного сотрудника факультета педиатрии и инфекционных болезней уже в своей альма-матер. Несмотря на столь успешную карьеру, что-то не ладится и не дает ему покоя. Не проработав и 3-х лет бросает все и уезжает сначала в Тегеран в институт Пастера, а через три года странным зигзагом через Гиндукуш, оказывается в медицинском институте Уолтера и Элизы Холл в Мельбурне. Дауншифтинг, не иначе.
Именно в Австралии, состоялось судьбоносное знакомство Даниэля Гайдусека с медицинским работником Винсентом Зигасом (1920-1983), который тесно общался с племенами Папуа Новой Гвинеи, оказывая им медицинскую помощь. Зигас рассказывает Даниэлю о неизвестной болезни, странные симптомы которой проявляются у единственного народа – Форе. Гайдусек в нетерпении бросается изучать язык аборигенов и спустя несколько месяцев Зигас привозит и представляет Гайдусека народности Форе. Почти год они живут среди дикого племени, отслеживая все привычки, обычаи. Наблюдают больных и проводят вскрытия погибших. [1]
Вот как они описывают последовательность развития столь заинтересовавшей их болезни в своей статье:
После проведения вскрытия, у многих погибших от болезни Зигас и Гайдусек обнаруживали превращения мозга в губчатую субстанцию. [2]
Длительное проживание внутри племени позволило Гайдусеку и Зигасу обнаружить причину развития болезни. Оказалось, что племя Форе практиковало каннибализм.
После смерти одного из старших членов рода его тело разделывали, вскрывали черепную коробку и съедали мозг, так как считалось, что поедание головного мозга представляет собой ритуал последних почестей умершему, а тот, кто съест мозг, приобретёт его мудрость, смелость и остальные благородные качества, которыми он владел. Обычно большую часть мозга съедали женщины и потому среди них число заболевших было выше.[3] С искоренением столь пагубного обычая практически полностью была побеждена и болезнь «куру».
За описание болезни «куру» в 1976 году Гайдусек получил Нобелевскую премию. И тут не ясны мотивы Нобелевского комитета, который обошел вниманием Винсента Зигаса. В своей Нобелевской лекции Гайдусек рассказывал про вирусную природу болезни «куру». Узнаем прав он был или нет чуть позже.

Больной, пораженный «куру».
Пока же перенесемся в Германию. Начало 20 века, психиатрическая клиника в Бреслау, кафедра под началом Алоиза Альцгеймера. На работу приходит молодой судовой врач, который решил стать неврологом. Пока он упорно постигает азы профессии ему удается обнаружить пациентов с никому дотоле неизвестным заболеванием. Исследования прерывает Первая мировая война, которая вернула доктора Ганса-Герхарда Крейтцфельда в состав военно – морского флота. Только в 1920 году, спустя 6 лет, он публикует описание болезни.
В описании обнаруживаем, что пациенты с высокой скоростью теряли память, переставали осознавать себя и через 8-12 месяцев после первых проявлений клинической картины умирали. В препаратах мозга, полученных от таких пациентов, были обнаружены характерные «губчатые структуры».
Стоит сказать, что ему несказанно повезло, опоздай он еще на полгода, и ветер времени развеял бы его имя в веках, так как спустя несколько месяцев выходит работа Альфонса Якоба с описанием той же самой болезни, которая обрела имя своих открывателей – болезнь Крейтцфельда – Якоба(БКЯ).
Что может быть общего между скрепи, куру и БКЯ? Именно такой вопрос начали задавать ученые к 50-м годам 20 века, ведь эти заболевания были так похожи длинным инкубационным периодом в 5 – 10 лет и неизменной печальной судьбой пораженного, будь то животное или человек. Причем повреждения прежде всего настигали мозг. Так и назвали эту группу заболеваний нейродегенерации с длительным инкубационным периодом.
Основная часть
Эксперименты
С развитием экспериментальных методов биохимии стало возможным наконец подступиться к этим патологиям. Неимоверно сложно было искать источник заражения при условии, что проявления болезни можно обнаружить только спустя годы, несмотря на трудности, попытки выяснить причины болезни не прекращались. В лабораториях искали способы упростить экспериментальную работу, сократив срок инкубационного периода до приемлемого.
Так Пэтисон и Гуили смогли передать болезнь от овечки к овечке с помощью бесклеточных фильтратов. Для начала лабораторных экспериментов оставался один шаг – передать болезнь от овцы к лабораторному животному. И его делает Чандлер в 1960 году, о чем пишет небольшую, но очень известную статью в 1961 году[4]. Ему удалось заразить лабораторную мышь с помощью вещества из мозга больного животного. Причем в последних исследованиях проявление заболевания пришлось ждать всего 7 месяцев. Стало удобно исследовать болезнь в лабораторных условиях.
Активизировались поиски инфицирующего агента. Установить его долгое время не удавалось. Сначала искали неизвестный вирус, похожий на герпес или энцефалит, но ничего не находили. Всех исследователей удивляло, что способность к заражению у этой субстанции, выделенной из мозга больных животных, сохранялась и после сильного длительного нагрева, и после обработки ацетиэтилениминам. Были поставлены эксперименты, в которых фильтрат подвергли обработке жестким УФ и ионизирующим излучением. Несмотря на это, фильтрат сохранил способность к заражению.[5] Стали закрадываться подозрения, что вирусы в этом случае ни при чем, ведь нуклеиновые кислоты (непременная составляющая любого вируса) при таком воздействии попросту разрушаются.
Гриффит в небольшой заметке на полторы страницы текста в 1967 году озвучивает еретическую мысль – инфекционный агент не содержит нуклеиновых кислот.[6] Это белок, который способен к самовоспроизводству в клетке. Именно с этой заметки началась новая эра.
Инфекционный белок
Эксперименты по исследованию скрепи все также оставались сложными и длительными. Только спустя 15 лет, Стенли Прузинер в калифорнийском университете Сан-Франциско выделил и описал агент, способный в чистом виде вызывать развитие болезни скрепи. Выяснилось, что это удивительное вещество устойчиво к нагреванию, сохраняет инфекционность после обработки различными повреждающими агентами, такими как: протеиназа К, мочевина, гуанидинхлорид, детергенты, SDS и нуклеазы — ферменты повреждающие ДНК, но было также обнаружено, что данный инфекционный агент чувствителен к ионизирующему излучению в присутствии кислорода, что характерно для гидрофобных белков имеющих большое сродство к липидам. [8]
Прузинер придумал название для агента, вызывающего скрепи – «ПРИОН» (prion –proteinacious infectious particle). Прионный белок (Prione Protein PrP) был выделен чуть позже. Методы секвенирования в то время уже были развиты достаточно хорошо и быстро позволили установить первичную последовательность PrP. Все начали искать источник PrP. Статья в Nature от 1985 года, ознаменовавшая собой окончание поисков, поставила многих исследователей в тупик: матричная РНК (молекула – шаблон по которой потом синтезируются белки) необходимая для синтеза PrP обнаружилась в здоровом мозге. [7]
Это означало только одно — белок, ответственный за развитие болезни всегда присутствует в головном мозге, не зависимо от развития болезни. Позже выяснили, что ген, кодирующий PrP есть у всех млекопитающих, а также у птиц и рыб.
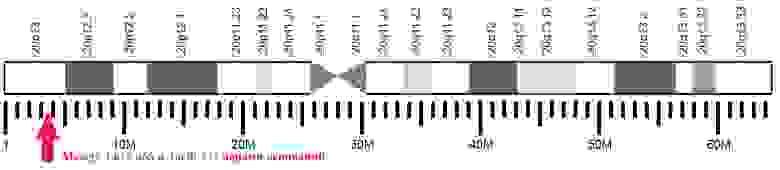
Расположение отдельных участков 20-й хромосомы человека с отметкой места нахождения гена, кодирующего PrPС.
Структура белка
Что же это за удивительный белок? Функция его и спустя 37 лет с момента обнаружения не выяснена (тут стоит сказать спасибо западной модели грантово-статейной науки). Известно, что этот белок связан с клеточной мембраной. И возможно отвечает за межклеточные взаимодействия в мозге.
Чтобы понять, как же обычный белок становится заразным необходимо обратиться к структуре белков. Первичная структура белка – это последовательность аминокислотных остатков. Эта последовательность и у нормального PrPC и у инфекционной формы PrPSc одинаковая.
Отличия удалось обнаружить на уровне вторичной и третичной пространственной структуры. У PrPC вторичная структура представлена 42% α-спиралей и 3% β-структур, а в тоже время PrPSc содержит 30% α-спиралей и 43% β-структур. Этот факт позволил предположить, что патологическая форма белка образуется при неправильном сворачивании аминокислотной последовательности в β-складчатые слои.
На изображении вверху аминокислотная последовательность PrP, с выделенными участками различных белковых структур H1,H2, Р3 – α спирали. Внизу показано превращение спиралей в β-складчатые слои. Изображение: By Olivia May, Ph.D
Прионная гипотеза
На основе накопленных данных в 1991 году Прузинер формирует «Прионную гипотезу», в которой постулирует следующее:
Несмотря на ярые атаки критиков этой теории, сейчас практически все соглашаются с тем, что Прузинер был прав, и этому есть значительный объем экспериментальных подтверждений. К примеру, если представить, что воспроизведение PrPSc после попадания в организм происходит путем передачи патологической конформации на PrPC, то организмы, лишенные PrPC, должны быть устойчивы к прионной инфекции. Такой эксперимент провели с использованием трансгенных мышей, гомозиготных по делеции гена Prnp (Prnp0/0). Введение растертой ткани мозга мышей, больных скрепи, трансгенным мышам Prnp0/0 не приводило к развитию болезни ввиду отсутствия нормального PrP. Более того, оказалось, что в отсутствие PrPC не происходит не только воспроизведения приона, но и повреждения нервной ткани.
Окончательное доказательство концепции прионов долгое время сдерживалось невозможностью получения значительного количества PrPres – формы PrPSc, образуемой in vitro, которая устойчива к частичному протеолизу и способна вызывать болезнь при введении экспериментальным животным. Недавно было показано, что фрагмент рекомбинантного PrP мыши, синтезированный в Escherichia coli, образует фибриллы in vitro, которые при введении трансгенным мышам, экспрессирующим этот же фрагмент PrP, приводят к развитию прионного заболевания. [13]
Также в недавнее время была разработана система циклической амплификации прионной формы белка PrP, с помощью которой возможно формирование значительного количества PrPres (искусственной патологической версии приона) in vitro. Это позволило получить и продемонстрировать инфекционность искусственно синтезированного приона.
Внимательный читатель заметит, что прионы, образующиеся в мозге овцы, вряд ли будут патогенны по отношению к человеку. И будут почти правы. Известно, что передача прионной инфекции между видами млекопитающих ограничена межвидовыми барьерами. Например, болезнь Крейцфельда-Якоба передается от человека человеку, и от человека шимпанзе; скрепи же передается среди овец и коз, но не передается шимпанзе. В то же время межвидовые барьеры не абсолютны. Межвидовые барьеры могут выражаться не столько в невозможности передачи инфекции животным отдаленного вида, сколько в удлинении инкубационного периода, а также в том, что заболевают не все, а какая-то часть экспериментально зараженных животных. Считается, что межвидовые барьеры вызваны различиями в первичной структуре PrP и модификациях у млекопитающих разных видов. Подтверждением этому послужили следующие наблюдения. Трансгенные мыши, экспрессирующие PrP хомяка, оказались высокочувствительны к заражению прионами хомяка в отличие от мышей дикого типа. Передача болезни Крейцфельда-Якоба от человека к мыши ограничена межвидовым барьером, однако трансгенные мыши, экспрессирующие PrP человека, подвержены заражению этой болезнью.
Также до сих пор встречаются трудности по заражению животных с помощью чистого прионного белка. Эти трудности можно легко объяснить.
Первая причина в том, что в клетках обычного организма белки подвергаются посттрансляционной модификации, которую достаточно трудно воспроизвести в экспериментальных условиях.
Вторая причина в том, что прион является белком мембранным и следует предполагать, что и структура его наиболее стабильна в условиях мембранно-подобного окружения, что и было показано недавними исследованиями.
В них было показано, что прионы в присутствии холестерина и фосфатидилэтаноламина гораздо легче образовывали патогенную форму и обладали гораздо большей инфекционностью.
Прионы — биологическое оружие
На самом деле ситуация с возможными путями заражения оказалась гораздо хуже, чем можно было себе представить. В 1974 году был описан первый случай ятрогенного (из-за внешнего воздействия) заболевания болезнью Крейтцфельда-Якоба, обычно считавшейся генетической патологией.
Имеются описания 3 случаев передачи БКЯ в результате переливания крови от донора, у которого был диагностирован БКЯ во время вспышки этого заболевания в Великобритании [28]. От чего же произошла эта вспышка… Как обычно из-за жадности. БКЯ развилась у людей после употребления в пищу говядины, зараженной прионами.
В 1986 г. в Великобритании вспыхнула эпидемия заболевания прионнной болезнью у коров, также названной «коровьим бешенством», которая привела к гибели более чем 160 000 голов крупного рогатого скота [29]. Причиной было использование пищевых добавок мясокостной муки, когда из-за слабо контролируемых правил переработки побочных продуктов животного происхождения PrPSc от зараженных скрепи овец и другого крупного рогатого скота, попадал в корм для коров. Обычно в технологию получения такой муки после процессов тщательного измельчения исходного сырья включена обработка активными жирорастворителями, а также термообработка при температуре 130 оС. Однако в конце 70-х годов предприниматели, решив повысить питательную ценность мясокостной муки, снизили режим термообработки до 110 оС, а также уменьшили количество веществ, экстрагирующих жир. Именно эти изменения способствовали появлению и развитию эпидемии среди поголовья крупного рогатого скота.
Доказано, что эпидемия у коров привела к появлению нового типа БКЯ, получившего название «вариант БКЯ» [15]. Первые случаи вБКЯ были зарегистрированы в 1995 г., когда заболевание диагностировали у 2 британских подростков [16,17]. Из-за длительного инкубационного периода связь между заболеванием и зараженным мясом в Великобритании не была установлена до тех пор, пока заболеваемость у коров не переросла в эпидемию. Эпидемия была взята под контроль после массивного убоя скота и изменений в технологии производства, которые резко сократили загрязнение мяса компонентами нервной ткани. В Великобритании ежегодное число новых случаев вБКЯ, которое достигло пика в 2000 г., неуклонно снижается, и в 2013 г. был подтвержден только 1 случай заболевания [18].
У всех пациентов БКЯ развился после употребления в пищу мяса, полученного от заболевшего крупного рогатого скота. Но, несмотря на широкое распространение эпидемии, поразившей сотни тысяч голов крупного рогатого скота, относительно у немногих людей, которые употребляли в пищу мясо больных животных, развился БКЯ [33]. (вспомним про межвидовой барьер).
Инкубационный период (время между употреблением в пищу зараженной говядины и манифестацией симптомов) был длительным: большинство пациентов были заражены в конце 80-х годов, а пик заболеваемости пришелся на начало 2000-х, т. е. инкубационный период составил 11—12 лет. В последних диагностированных случаях инкубационный период достигал от 12 до более 20 лет [18.19].
Клинические проявления варианта БКЯ имеют отличия от других форм БКЯ. Болезнь настигает молодых людей в возрасте в среднем до 30 лет, ее начало характеризуется изменениями личности: больной утрачивает прежние интересы, начинает сторониться близких людей, у него развиваются тревожное состояние, бессонница, депрессия. Двигательные нарушения проявляются примерно через полгода после начала заболевания. Слабоумие наступает позднее, чем при классической форме, пациент осознает свое ухудшающееся состояние. Довольно быстро он теряет способность самообслуживания. Для вБКЯ типичны не только начало в более молодом возрасте, но и средняя выживаемость, превышающая 14 мес [18,19]. Вероятно, что различия в выживаемости между классической БКЯ и ее вариантом отчасти связаны с молодым возрастом пациентов.
К глубочайшему сожалению в 2011 году во время экспериментальных работ по изучению болезни Крейтцфельда – Якоба на мышах была показана возможность воздушно – капельного заражения аэрозолями, содержащими прионные частицы.
В чем же заключаются главные достоинства:
Помогаем террористам осуществить хитрый замысел
Прионы — это идеальная технология для террора. Существует и хорошо описана технология синтеза патогенных форм прионных белков[13].
Даже если представить, что обычному террористу сложно будет организовать биохимическую лабораторию, то бесчисленные стада животных никто не мешает использовать для получения большого количества мозгового вещества, зараженного БКЯ.
Никто и ничто не помешает террористам начать массовый синтез прионных белков и их добавление к сухому молоку, детским молочным смесям, мясному фаршу, мясо-костным субпродуктам, соевому шроту или любой другой субстанции, завод по производству которой окажется в зоне их досягаемости.
Если же представить, что в руки террористов попадет насильственным способом или по финансовым, идейным, иным соображениям талантливый биохимик, то никто не помешает ему синтезировать липидно-белковый аэрозоль с прионными частицами. Потом распылять ничем не определяемый аэрозоль в системах вентиляции. Этот способ более страшный, чем через пищу, так-как у носоглоточного узла есть тесная связь с мозгом и вероятность заражения увеличивается многократно.
Представим себе последствия заражения. Спустя 3-7, а может и все 15 лет на неограниченной территории начинается массовое развитие прионной болезни мозга. Паника, ужас, страх, разрушение. Целые города людей — зомби, чей мозг в буквальном смысле превращается в губку. Нет лекарства, нет надежды, только ужас неотвратимой скорой гибели.
Заключение
Новогоднее пожелание
Пожелаю никогда не встретить ни одной молекулы PrPSC!
Сам пока поищу возможность достать высокочувствительную диагностическую тест — систему, чтобы определить, не успели ли нас уже заразить…