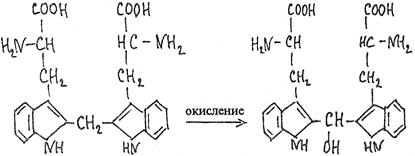
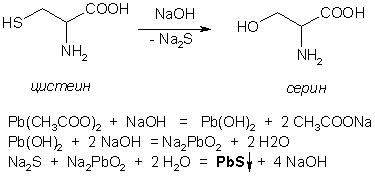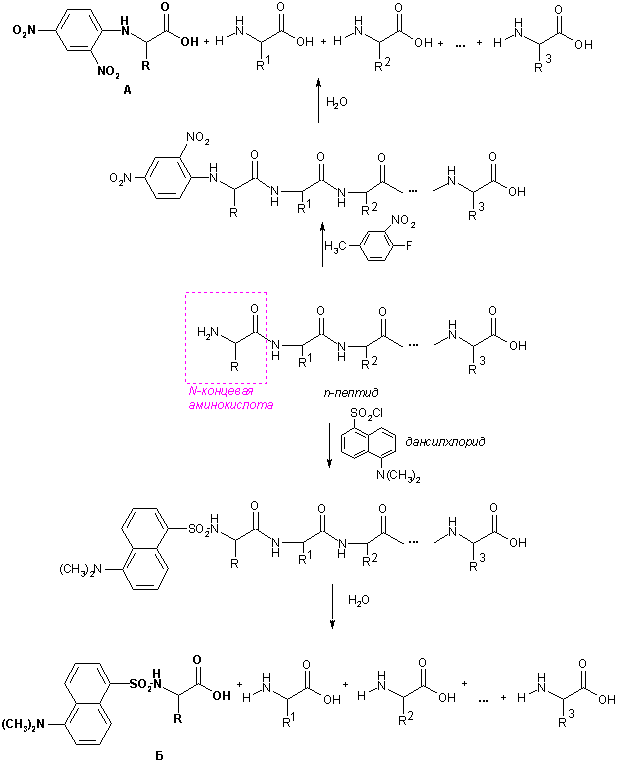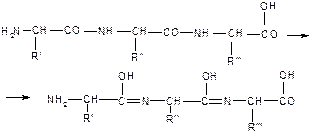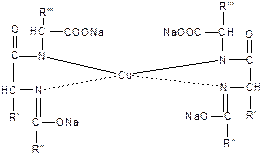наличие пептидной связи в белках можно обнаружить с помощью
Наличие пептидной связи в белках можно обнаружить с помощью
Анализ белковых молекул
Для определения аминокислот, входящих в состав белка используют методы, основанные, как правило, на частичном или полном гидролизе полипептидной цепи. Обычно проводят кислотный или ферментативный гидролиз белка и аминокислоты анализируют различными хроматографическими методами. Таким способом можно установить количественный и качественный состав аминокислот, входящих в состав белка, но не их последовательность. Остановимся на некоторых химических способах анализа белковых молекул.
Свободные аминокислоты обнаруживают нингидринной реакцией (см. Нингидринная реакция). Эту же реакцию дают и белки, но в более жестких условиях – при кипячении с водным раствором нингидрина.
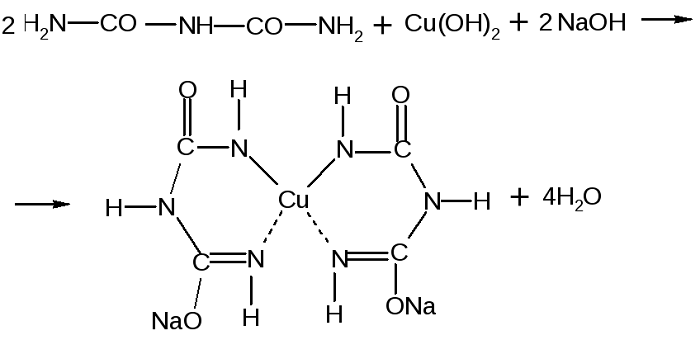
Для обнаружения пептидных связей в белках служит биуретовая реакция (реакция Пиотровского) – образование ярко-окрашенных комплексов при взаимодействии белков с гидроксидом меди (II) в присутствии щелочи. В эту реакцию вступают все пептиды, имеющие минимум две пептидные связи. Цвет комплекса, получаемый при биуретовой реакции с различными пептидами, несколько отличается и зависит от длины пептидной цепи. Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий. Реакцию используют не только для качественного, но и для количественного определения белков.
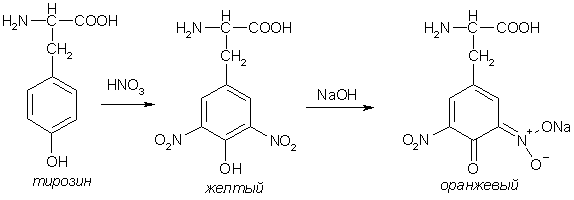
Пептиды, содержащие ароматические и гетероароматические аминокислоты дают положительную ксантопротеиновую реакцию (реакция Мульдера) – появление желтого окрашивания при действии конц. азотной кислоты. При добавлении щелочи цвет смеси меняется на оранжевый.
Серосодержащие аминокислоты в составе белка определяют по образованию черного осадка сульфида свинца при нагревании с ацетатом свинца – сульфгидрильная реакция (реакция Фоля).
Определение С- и N-концевых аминокислот
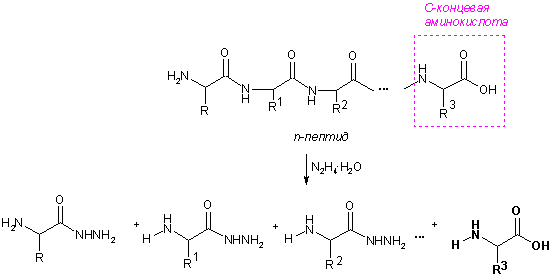
N-Концевые аминокислоты определяют по реакции с 2,4-динитрофторбензолом или дансилхлоридом. Свободная аминогруппа N-концевой аминокислоты арилируется или ацилируется, белок гидролизуют, образовавшиеся N-(2,4-динитрофенил)- (А) или N-(5-диметиламинонафтил-1-сульфо)производные (Б) существенно отличаются по физико-химическим свойствам от остальных аминокислот, поэтому их легко отделяют и идентифицируют.
С-Концевые аминокислоты определяют методом Акароби – при нагревании пептида с гидразингидратом пептидные связи гидролизуются и образуется смесь гидразидов аминокислот. С-Концевая аминокислота не реагирует с гидразином, остается в свободном виде, ее выделяют и идентифицируют.
Удобным методом определения последовательности аминокислот (первичной структуры белка) является способ деградации полипептидной цепи с помощью фенилизотиоцианата (метод Эдмана). N-Концевые аминокислоты последовательно отщепляются от цепи в виде фенилтиогидантоинов и идентифицируются.
Ход работы. 1. Обнаружение в молекулах белков пептидных связей (биуретовая реакция)
1. Обнаружение в молекулах белков пептидных связей (биуретовая реакция). К 1-2 мл разбавленного раствора белка прибавляют двойной объем 30%-ного раствора гидроксида натрия, хорошо перемешивают и добавляют 2-3 капли 1%-ного раствора сульфата меди. Снова тщательно перемешивают. Развивается сине-фиолетовое окрашивание. При малом содержании белка чувствительность реакции можно повысить, наслаивая на раствор белка в щелочи 1 мл 1%-ного раствора сульфата меди. При стоянии на границе двух слоев появляется фиолетовое кольцо.
Биурет в щелочной среде претерпевает енолизацию по схеме:
Две молекулы биурета в енольной форме взаимодействуют с гидроксидом меди (II) с образованием комплексного соединения меди:
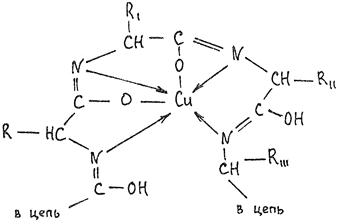
Аналогично построено комплексное соединение меди с енолизированными пептидными группами любого белка:
2. Нингидриновая реакция
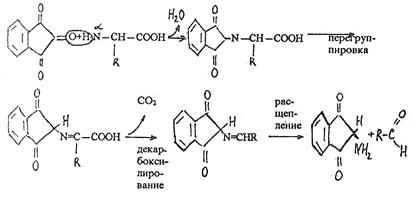
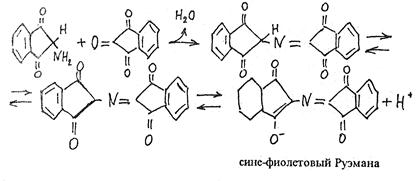
Сначала в результате взаимодействия a-аминогруппы аминокислоты (или белка) с нингидрином возникает Шиффово основание. Затем оно претерпевает перегруппировку, декарбоксилируется и расщепляется на альдегид и аминодикетогидринден.
В присутствии органических растворителей (ацетона, этанола, пиридина и др.), на которых обычно готовят раствор нингидрина, протекает реакция:
Продукт этой реакции содержит в своем составе радикал (R) исходной аминокислоты, который обусловливает различную окраску (голубую, красную и т.п.) соединений, возникших при реакции аминокислот с нингидрином.
В настоящее время нингидриновая реакция широко используется как для открытия отдельных аминокислот, так и для определения их количеств.
3. Ксантопротеиновая реакция. К 1 мл разбавленного белка добавляют 5-6 капель концентрированной азотной кислоты до появления белого осадка или мути от свернувшегося белка. При нагревании раствор и осадок окрашиваются в ярко-желтый цвет. При этом осадок почти полностью растворяется.
Охлаждают смесь и осторожно добавляют к раствору, имеюще-му кислую реакцию, не взбалтывая, по каплям избыток щелочи до щелочной реакции. Выпадающий вначале осадок кислотного альбумината растворяется, и жидкость окрашивается в ярко-оранжевый цвет.
Ксантопротеиновая реакция происходит только при наличии в белках остатков ароматических аминокислот (фенилаланина, тирозина и триптофана). Желатин, не содержащий ароматических аминокислот, не дает ксантопротеиновой пробы. В результате реакции нитрования по радикалам ароматических аминокислот образуются желтоокрашенные нитросоединения. Изменение желтой окраски на оранжевую в щелочной среде обусловлено появлением хромофорной группы.
Рассмотрим в качестве примера механизм ксантопротеиновой реакции по радикалу тирозина:
4. Реакция Сакагучи. Берут в пробирку 2 мл разбавленного раствора белка, добавляют 1 мл 10%-ного раствора гидроксида натрия и вслед за этим несколько капель 0,2%-ного спиртового раствора 1-нафтола. Перемешивают, доливая 0,5 мл раствора гипобромида натрия и вновь перемешивают. Развивается оранжево-красное окрашивание. Появление окраски объясняется взаимодействием 1-нафтола в присутствии окислителя с гуанидиновыми группировками радикалов аргинина.
Хотя механизм реакции еще полностью не выяснен, ряд наблюдений свидетельствует в пользу следующей схемы. Сначала 1-нафтол в присутствии окислителя соединяется с гуанидиновой группировкой аргинина:
Затем при дальнейшем окислении нафтиларгинина образуется соединения типа хинонимина:
Так как производные хинониминов (в данном случае нафтохинонимина), у которых водород иминогруппы замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именного производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления NH-групп гуанидинового остатка и бензольного ядра 1-нафтола.
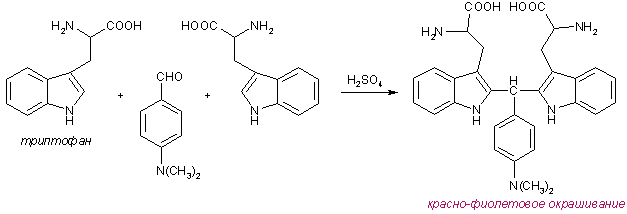
5. Реакция Адамкевича. Наливают в пробирку несколько капель неразбавленного белка и прибавляют 2 мл уксусной кислоты, к которой добавляют немного глиоксиловой кислоты. Смесь слегка нагревают до растворения образующегося осадка. Охлаждают пробирку со смесью, а затем, сильно наклонив ее, осторожно, по стенке приливают 1 мл концентрированной серной кислоты так, чтобы обе жидкости не смешивались. При стоянии на границе двух жидкостей получается красно-фиолетовое кольцо. Окраска возникает за счет реакции триптофана с глиоксиловой кислотой, всегда присутствующей в уксусной кислоте в виде примеси.
Триптофан в этой реакции конденсируется с формальдегидом, выделяющимся из глиоксиловой кислоты под воздействием концентрированной серной кислоты:
Продукт конденсации окисляется до бис-2-триптофанилкарбинола:
Последний в присутствии минеральных кислот образует окрашенные в сине-фиолетовый цвет соли (явление галохромии).
6. Реакция Паули. К 1 мл 1%-ного раствора сульфаниловой кислоты в 5%-ном растворе соляной кислоты приливают 2 мл 0,5%-ного раствора нитрита натрия, сильно встряхнув, быстро добавляют сначала 2 мл разбавленного раствора белка, а затем, после перемешивания содержимого, 6 мл 10%-ного раствора карбоната натрия. После смешивания растворов развивается вишнево-красное окрашивание.
Возникновение окраски обусловлено наличием в белковой молекуле остатков гистидина и тирозина.
При взаимодействии кислого раствора сульфаниловой кислоты с нитритом натрия осуществляется реакция диазотирования и образуется диазобензолсульфоновая кислота
кислота (диазобензолсульфоновая кислота)
При реакции последней с гистидином образуется соединение вишнево-красного цвета:
К горячей щелочной жидкости приливают раствор плюмбита натрия, образуется черный осадок.
Под действием щелочи наблюдается отщепление части аминогрупп (реакция дезаминирования) в виде аммиака. В щелочной среде происходит также постепенное отщепление ионов серы со степенью окисления +2 от радикалов аминокислот, содержащих серу. Образование ионов серы можно обнаружить с помощью ионов свинца, образующих с ионами серы черный нерастворимый осадок сульфида свинца:
Работа 4. Выделение рибонуклеопротеинов из дрожжей и качественное определение
продуктов их гидролиза (белка, рибозы,
пуриновых оснований и фосфорной кислоты)
Нуклеопротеины – сложные белки, простетической группой которых являются нуклеиновые кислоты – ДНК или РНК. В дезоксирибонуклеопротеинах (ДРНП) и рибонуклеопротеинах (РНП) нуклеиновые кислоты и белки связаны друг с другом в основном солевыми связями, которые могут легко диссоциировать, что и происходит достаточно часто в процессе выделения ДРНП и РНП, особенно в момент воздействия крепких растворов солей.
Оборудование, реактивы: центрифуга, колба круглодонная на 100 мл с обратным прямым воздушным холодильником, ступка (диаметр 110 мм), стакан стеклянный на 200 мл, цилиндр мерный на 50 мл, воронка стеклянная, пробирки химические, песок промытый и прокаленный, гидроксид натрия (0,4%-ный), уксусная кислота (10%-ная), соляная кислота (конц.), сульфат меди (1%-ный), орциновый реактив, аммиак (конц.), аммиачный раствор оксида серебра, молибдат аммония, диэтиловый эфир, серная кислота (10%-ная).
Материал: дрожжи пекарские (высушенные).
Биуретовая реакция на обнаружение пептидных связей



в белках
Принцип реакции: белки (полипептиды) в щелочном растворе в присутствии сульфата меди (II) образуют комплексные соединения меди, окрашенные в сине-фиолетовый цвет, интенсивность которого зависит от количества пептидных связей в молекуле белка.
Первоначально пептидные группы полипептида претерпевают в щелочной среде енолизацию:
Енольная форма полипептида взаимодействует с гидроксидом меди (II) и образует окрашенный в сине-фиолетовый цвет комплекс:
Продукты неполного гидролиза белка (пептиды) дают красное или розовое окрашивание в биуретовой реакции.
Материалы и реактивы: разбавленный 1%-ный раствор яичного белка, 10%-ный раствор гидроксида натрия (или калия), 1%-ный раствор сульфата меди.
Оборудование: стеклянные палочки, штатив с пробирками, пипетки, капельница.
Порядок выполнения работы: к 3 см 3 раствора яичного белка добавляют 1 см 3 раствора гидроксида натрия, 1…2 капли раствора сульфата меди, перемешивают.
Содержимое пробирки окрашивается в красно-фиолетовый цвет.
1.2.2.2 Цветные реакции с белками на обнаружение
карбоновых аминокислот
Принцип реакции: для обнаружения с помощью цветных реакций остатков карбоновых аминокислот, входящих в состав белков, используют характерные для этих аминокислот цветные реакции. Так, при выявлении α-аминокислот используют нингидриновую реакцию (см. п. 1.2.1.1), цистеина и цистина – реакцию Фоля (см. п. 1.2.1.2).
Материалы и реактивы: раствор яичного белка (1%-ный ), 1%-ный раствор нингидрина в 95 %-ном растворе ацетона, реактив Фоля.
Оборудование: стеклянные палочки, пробирки, штатив для пробирок, пипетки градуировочные, водяная баня, термометр лабораторный, часы.
Порядок проведения работы.
Нингидриновая реакция. К 1 см 3 раствора яичного белка (исследуемого продукта) добавляют 3 капли раствора нингидрина. Смесь перемешивают и ставят на водяную баню при температуре 70 °С на 5 мин. Наблюдают образование сине-фиолетового окрашивания, свидетельствующего о присутствии в молекуле белка остатков
α-аминокислот.
Реакция Фоля. К 3 см 3 раствора яичного белка добавляют 3 см 3 реактива Фоля и после перемешивания кипятят на водяной бане в течение 2 мин. После остывания наблюдают образование бурого или чёрного осадка, свидетельствующего о наличии в молекуле белка остатков цистеина и цистина.
1.2.2.3 Цветные реакции с белками на обнаружение
циклических аминокислот
Ксантопротеиновая реакция. Принцип реакции: для обнаружения циклических аминокислот в составе молекулы белка с помощью цветных реакций используют характерные для этих аминокислот реакции. При выявлении остатков ароматических аминокислот используют ксантопротеиновую реакцию.
Материалы и реактивы: раствор яичного белка (1%-ный ), концентрированная азотная кислота, 10%-ный раствор гидроксида натрия.
Оборудование: стеклянные палочки, пробирки со штативом, пипетки градуировочные, капельницы, водяная баня, термометр лабораторный, часы, горелка.
Порядок проведения работы: к 1 см 3 раствора яичного белка (исследуемого вещества) добавляют 3 капли раствора нингидрина. Смесь перемешивают и ставят на водяную баню при температуре 70 °С на 5 минут. Развивается сине-фиолетовое окрашивание.
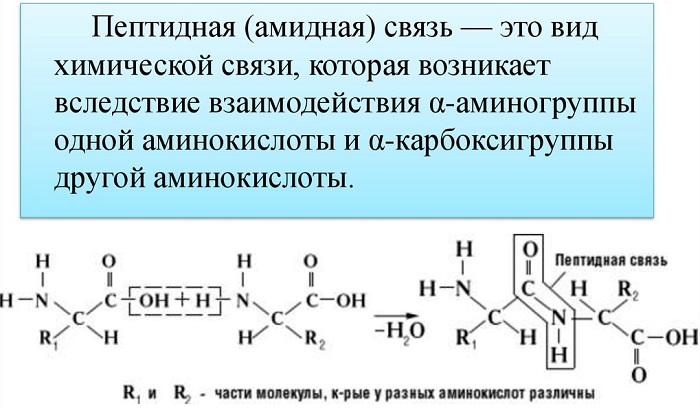
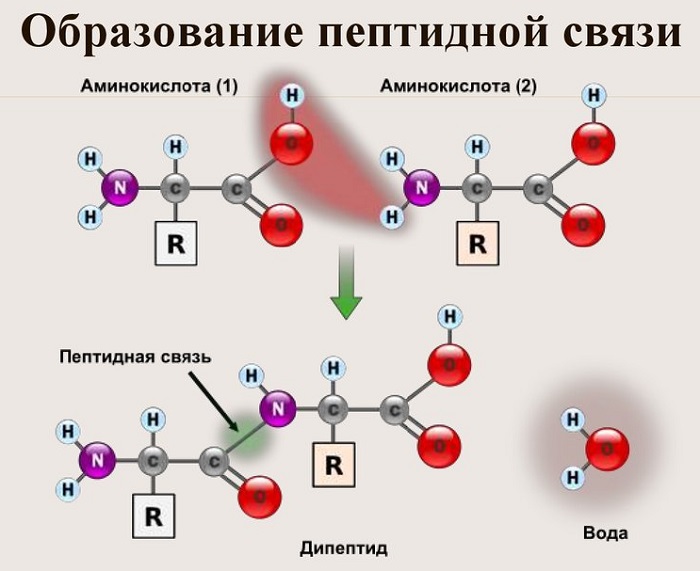
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
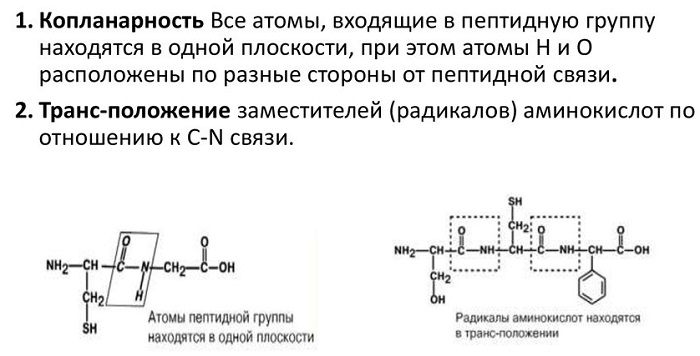
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
Резонансные формы пептидных связей
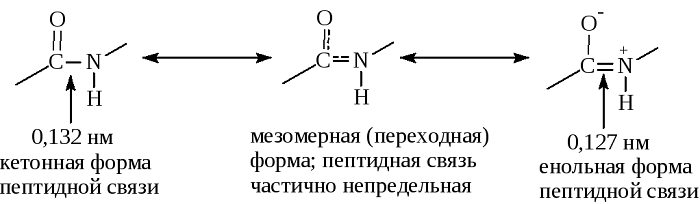
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
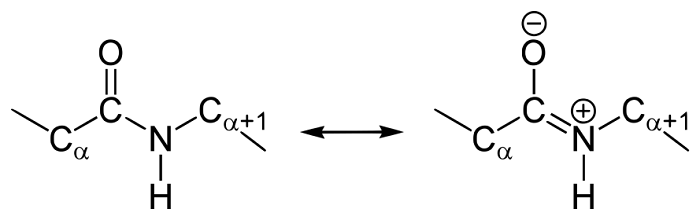
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
Методы определения пептидных связей
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Аминокислоты. Пептиды
Ищем педагогов в команду «Инфоурок»
Описание презентации по отдельным слайдам:
Описание слайда:
Основы биохимии.
Лекция №2
Аминокислоты.
Пептиды.
Белки.
Описание слайда:
Аминокислоты и пептиды
Белки – природные высокомолекулярные полимеры, состоящие из остатков α-аминокарбоновых кислот, связанных амидной (пептидной) связью.
Характерны неразветвленные пептидные связи
Высокая молекулярная масса (кол-во аминокислотных остатков в белках 50 – 1000 )
Число аминокислот = n Возможное число пептидов = n!
2 2
4 24
10 3 628 800
20 2· 10¹²
Всего в природе насчитывается несколько млрд различных белков
Описание слайда:
Строение белков
N-конец
C-конец
Пептидная связь
Описание слайда:
Описание слайда:
20 стандартных
аминокислот
Описание слайда:
Описание слайда:
Стандартные аминокислоты (20 а.к.)
Глицин (Gly)
Аланин (Ala)
Пролин (Pro)
Валин (Val)
Метионин (Met)
Изолейцин (Ile)
Лейцин (Leu)
Неполярные алифатические R группы
Описание слайда:
Стандартные аминокислоты (20 а.к.)
Серин (Ser)
Треонин (Thr)
Цистеин (Cys)
Глутамин (Gln)
Аспарагин (Asn)
Полярные незаряженные R группы
Описание слайда:
Стандартные аминокислоты (20 а.к.)
Фенилаланин (Phe)
Тирозин (Tyr)
Триптофан (Trp)
Ароматические R группы
Описание слайда:
Стандартные аминокислоты (20 а.к.)
Лизин (Lys)
Аргинин (Arg)
Гистидин (His)
Положительно заряженные R группы
Описание слайда:
Стандартные аминокислоты (20 а.к.)
Аспартат (Asp)
Глутамат (Glu)
Отрицательно заряженные R группы
Описание слайда:
Описание слайда:
Открытие аминокислот в составе белков
Аминокислота Год Источник Кто впервые выделил
Глицин 1820 Желатина А. Браконно
Лейцин 1820 Мышечные волокна А. Браконно
Тирозин 1848 Казеин Ф. Бопп
Серии 1865 Шелк Э. Крамер
Глутаминовая к-та 1866 Растительные белки Г. Риттхаузен
Аспарагиновая к-та 1868 Ростки спаржи Г. Риттхаузен
Фенилаланин 1881 Ростки люпина Э. Шульце, И, Барбьери
Аланин 1888 Фиброин шелка Т. Вейль
Лизин 1859 Казеин Э. Дрексель
Аргинин 1895 Вещество рога С. Гедин
Гистидин 1896 Гистоны А. Кессель
Цистин 1899 Вещество рога К. Мёрнер
Валин 1901 Казеин Э. Фишер
Пролин 1901 Казеин Э. Фишер
Гидроксипролин 1902 Желатина Э. Фишер
Триптофань 1902 Казеин Ф.Гопкинс, Д, Кол
Изолейцин 1904 Фибрин Ф.Эрлих
Метионин 1922 Казеин Д. Мёллер
Треонин 1925 Белки овса С. Шрайвер и др.
Гидроксилизин 1925 Белки рыб С. Шрайвер и др.
Описание слайда:
Классификация аминокислот
По химической структуре
По отношению к воде (гидрофильные и гидрофобные)
По кислотно-основным свойствам:
Кислые а.к. Asp, Glu (2)
Основные а.к. Lys, Arg, His (3)
Нейтральные а.к. (15)
4. По пищевой ценности:
Заменимые а.к. (10) (синтезируются в организме)
Незаменимые а.к. (10) (должны поступать извне)
Val, Leu, Ile, Thr, Met, Phe, Trp, Lys, Arg, His
Описание слайда:
Физические свойства аминокислот
Белые кристаллические вещества
Имеют высокие и нехарактерные Тпл., разлагаются при Т > 200°С
Растворимы в воде, растворах кислот и щелочей
Не растворяются в неполярных растворителях
Обладают либо сладким, либо горьким вкусом
Описание слайда:
Описание слайда:
Оптические свойства а.к.
L-Глицеральдегид
L-Аланин
D-Глицеральдегид
D-Аланин
Все стандартные а.к. (кроме Gly) обладают оптической активностью
и относятся к L-ряду (число изомеров 2¹ или 2² (Thr, Ile)
Описание слайда:
Оптические свойства а.к.
L-Аланин
L-Аланин
L-Аланин
D-Аланин
D-Аланин
D-Аланин
Описание слайда:
Особенности Cys
Цистеин
Цистеин
Цистин
В составе белка остатки Cys подвергаются самопроизвольному
окислению с образованием дисульфидных мостиков, которые
ковалентно связывают участки полипептидных цепей
Описание слайда:
Пептидная связь
Основной структурной единицей
белков и пептидов является
пептидная (амидная) связь C-N
Описание слайда:
Образование пептидной связи
Пептидная (амидная)
связь
Пептидная связь C-N 0,132 нм
Одинарная связь C-N 0,149 нм
Двойная связь С=N 0,127нм
Пептидная связь имеет характер “частично двойной” связи, является практически плоской
Описание слайда:
Строение пептидной связи
Особую природу пептидной связи C-N объясняют
существованием 2 резонансных форм (Л. Полинг, Р. Кори).
Это приводит к затрудненному свободному вращению
вокруг связи C-N (барьер вращения 63-84 кДж/моль)
Описание слайда:
Строение пептидной связи
N-конец
C-конец
Пептидная связь имеет транс-конфигурацию
Пептидная связь может существовать в плоской цис-форме:
В напряженных циклических системах (циклопептиды, производные пролина)
При большом размере заместителей у атома N (алкилированные производные)
Описание слайда:
Уровни структурной организации белка
Первичная
структура
Последовательность
аминокислот
α-Спираль
Полипептидная цепь
Ансамбль субъединиц
Вторичная
структура
Третичная
структура
Четвертичная
структура
Описание слайда:
Описание слайда:
Вторичная структура белка
Вторичная структура белка– упорядоченные структуры
полипептидных цепей, стабилизированные водородными связями
между пептидными СО и NH-группами.
Типы вторичных структур:
α-спираль
β-складчатая структура
неупорядоченный клубок (random coil)
Первичная структура
Вторичная структура
Описание слайда:
Стабилизируют α-спираль:
Ala, Val, Leu, Phe, Trp, Met, His, Gln
Дестабилизируют α-спираль:
Gly, Glu, Asp, Ile, Lys, Arg, Tyr, Asn, Ser, Cys
Описание слайда:
Описание слайда:
Описание слайда:
Описание слайда:
Сверхвторичная структура белка
Сверхвторичная структура – наличие ансамблей взаимодействующих между собой вторичных структур.
Пример – агрегация α-спиралей (суперспирализованная система). ( Белок α-кератин шерсти).
Т.о., полипептидная цепь белка содержит определенное число участков вторичной структуры (α, β), а также участки неупорядоченной структуры.
Описание слайда:
Третичная структура белка
Полипептидная цепь, содержащая определенное число участков вторичной структуры, обычно свертывается в относительно компактную систему, в которой элементы вторичной структуры взаимодействуют между собой
и с участками неупорядоченной структуры.
Для многих белков третичная структура эквивалентна
пространственной структуре белка
Каждый белок обладают своей уникальной пространственной структурой
Описание слайда:
Третичная структура белка
α
β
α/β
Описание слайда:
Четвертичная структура белка
Четвертичная структура характерна для белков, состоящих
из нескольких полипептидных цепей.
Она возникает в результате ассоциации нескольких субъединиц в компактную глобулу. Это взаимное расположение субъединиц
белка в пространстве.
4 субъединицы
в белке
2 субъединицы
в белке
12 субъединиц
в белке
Описание слайда:
Стадии образования нативной конформации белка ( Folding белков )
Образование пространственной структуры белка – процесс сложный и многостадийный
36 а.к. – 1 мс
Описание слайда:
Описание слайда:
Проблема правильного сворачивания белка. Прионы
Нейродегенеративные болезни (губчатые энцефалопатии) вызывают
белковые факоры – прионы, функционирующие как антишапероны
Описание слайда:
История открытия прионных болезней
1898 г. – необычное заболевание
овец «скрепи»
1939 г. – экспериментальное заражение
овец болезнью «скрепи»
1961 г. – инфекционная природа «скрепи»
(заболевания клеток головного
мозга) доказана
Описание слайда:
1992 г., Англия
Эпидемия коровьего бешенства,
заболело примерно 180000 коров
Болезнь передавалась людям,
в конце 90-х годов скончалось
около 200 чел
Описание слайда:
Описание слайда:
Устойчивость прионов к различным воздействиям
Описание слайда:
Неправильное сворачивание белка-приона –причина болезней
Накопление белковых агрегатов
в нервной ткани
Строение нормального белка-приона (слева)
и аномально свернутого (справа)
Описание слайда:
Прионные болезни человека и животных
Описание слайда:
2 модели превращения нормального α-спирального приона (РrРс) в неправильно свернутый β-складчатый прион (РrPsc)
а – модель плохого шаблона
б – модель затравок
Описание слайда:
Возможные модели нейротоксического действия агрегатов
неправильно свернутых белков
Описание слайда:
Возможные способы для предотвращения неправильного сворачивания белка и его агрегации
Описание слайда:
Описание слайда:
Глобулярные и фибриллярные белки
Глобулярные белки:
более сложные по конформации, чем фибриллярные белки
способны выполнять самые разные функции в клетках
активность этих белков носит динамический характер (ферменты)
Фибриллярные белки:
представляют собой вытянутые и складчатые структуры
выполняют в клетках и тканях структурную функцию
нерастворимые в воде, плотные белки
Примеры:
α-кератин, β-кератин, коллаген, эластин
Описание слайда:
Денатурация и ренатурация белка
Денатурация белка – это структурные изменения в молекуле белка
(без разрыва ковалентных связей), которые приводят к потере его
биологической активности.
Денатурацию белков ызывает нагревание, изменение рН, обработка
детергентами, органическими растворителями и др.
Денатурация белка – обратимая и необратимая.
Ренатурация – восстановление структуры и биологической активности
Нативный белок
Денатурированный белок
Описание слайда:
Как определить структуру белка
РСА (третичная и четвертичная структура)
Методы КД и ДОВ (вторичная структура)
ИК- и ЯМР-спектроскопия высокого разрешения (вторичная и третичная структура)
Электроно- и нейтронографические методы (третичная и четвертичная структура)
Описание слайда:
Функции белков
Регуляция
Движение
Структура
Катализ
Транспорт
Сигнализация
Третичная структура
Вторичная структура
Первичная структура
Четвертичная структура
Супрамолекулярная структура
Описание слайда:
Белки-Ферменты
Ферменты – это специфические и высокоэффективные катализаторы
биохимических реакций, протекающих в живой клетке (скорость реакции может увеличиваться в 10¹º раз).
Особенности белков-ферментов:
Высокая активность
Высокая специфичность
Высокая стереоспецифичность
Описание слайда:
Белки-Ферменты растительного происхождения
Фермент бромелин из ананаса
Фермент папаин из плодов
папайи
Описание слайда:
Белки-Ферменты
Принципы ферментативной кинетики
Описание слайда:
Описание слайда:
Описание слайда:
Транспортные белки
Транспортные белки участвуют в переносе различных веществ и ионов.
Примеры:
Гемоглобин ( переносит О2 от легких к тканям )
Миоглобин ( переносит О2 в мышечной ткани )
Цитохром с (транспорт электронов в дыхательной цепи)
Сывороточный альбумин (транспорт жирных кислот в крови)
Мембранные белки – каналообразователи (транспорт веществ и ионов через биологические мембраны)
Описание слайда:
Гемоглобин
Структура гема
Структура активного
центра гемоглобина
Гемоглобин –тетрамер:
2 α-субъединицы (141 а.к.)
2 β-субъединицы (146 а.к.)
Описание слайда:
Гемоглобин и миоглобин
Структура миоглобина
Кривые оксигенации
миоглобина (а)
и гемоглобина (б)
Описание слайда:
Гемоглобин
Серповидноклеточная анемия – это
“молекулярная болезнь” гемоглобина, наследственная генетическая аномалия.
Серповидные эритроциты очень хрупкие, легко разрываются – низкий уровень гемоглобина в крови, а также эритроцитами неправильной формы блокируются кровенсные капилляры.
Описание слайда:
Транспортные белки
Мембранные белковые каналы
К –канал бактерий
+
Описание слайда:
Защитные белки
Защитные белки участвуют в проявлении защитных реакций организма.
Белки иммунной системы (иммуноглобулины, белки системы комплемента (20 белков), антигены тканевой совместимости, интерлейкины, интерфероны и т.п.)
Белки системы свертывания крови (фибриноген, фибрин, тромбин)
Структура Ig
Связыванием иммуноглобулином (Ат) чужеродной молекулы (Аг)
Описание слайда:
Пищевые и запасные белки
Пищевые белки:
Казеин молока
Альбумин яичный
Глиадин пшеницы
Зеин ржи
Запасные белки:
Ферритин (“депо” Fe в селезенке)
Описание слайда:
Белки-гормоны
Гормоны – биологически активные регуляторы, вырабатываются в эндокринных железах и разносятся по кровяному руслу к клеткам-мишеням.
Существует 3 класса гормонов – пептидно-белковые, стероидные, биогенные амины (адреналин).
Белковые гормоны – все гормоны гипоталамуса, некоторые гормоны гипофиза и др. (соматотропин, тиротропин, гонадотропин, пролактин, инсулин, паратропин).
Пептидные гормоны – окситоцин, вазопрессин, глюкагон, гастрин, кальцитонин, тканевые гормоны брадикинин и ангиотензин.
Описание слайда:
ЦНС
Гипоталамус
Гормоны гипоталамуса
Передняя доля гипофиза
Задняя доля гипофиза
Первичные
мишени
Вторичные
мишени
Конечные
мишени
Сенсорные сигналы
Функциональная иерархия
гормональной
регуляции
Описание слайда:
Описание слайда:
Описание слайда:
Регуляторные белки и пептиды
Регуляторные белки необходимы для функционирования различных звеньев клеточного метаболизма:
Гистоны, репрессоры, рибосомальные факторы инициации транскрипции и т.п. (регулируют активность генов и биосинтез белка).
“Воротные” белки мембранных каналов (регулируют транспорт через биомембраны).
Описание слайда:
Структурные белки
Структурные белки составляют остов многих
тканей и органов.
Являются фибриллярными белками
Это белки соединительной ткани:
коллаген (кости, хрящи, кожа, сухожилия)
α- и β-кератины (волосы, шерсть, чешуя, панцири и т.д.)
эластин (связки, стенки сосудов и др.)
фиброин (шелк, паутина)
протеогликаны (клеточные стенки бактерий)
Описание слайда:
Описание слайда:
Структурные белки
Поперечное сечение волоса
α- Кератины – нерастворимые в воде, плотные белки
(присутствие большого числа α-спиральных участков –
2-3 а.к. цепи закручиваются одна вокруг другой):
Волосы, шерсть, чешуя рыб, рога, копыта, панцири и т.п.
Описание слайда:
Структурные белки
α- Кератин
Пример биохимической технологии
Что здесь изображено?
Описание слайда:
Описание слайда:
Двигательные белки
Двигательные белки :
Актин и миозин
(сократительный
аппарат мышц)
Динеин (реснички и жгутики
простейших)
Спектрин (мембраны эритроцитов)
Описание слайда:
Антибиотики белково-пептидной природы
Антибиотики – химические агенты, продуцируемые микроорганизмами, обладают прямым и избирательным ингибирующим действием на живые клетки (антибактериальные, противовирусные, противогрибковые, противоопухолевые антибиотики).
Пептидные антибиотики: грамицидины А, В, С, S, полимиксины, актиномицины, валиномицин и многие другие.
Белковые антибиотики: неокарциностатин, актиноксантин и другие.
Описание слайда:
Токсины пептидно-белковой природы
Белками являются самые мощные из известных токсинов микробного происхождения:
Ботулинический токсин
Столбнячный токсин
Дифтерийный токсин
Холерный токсин
Белки – зоотоксины (змей, скорпионов, пауков, и др.)
Белки – фитотоксины (рицин из клещевины)
Пептидные токсины (ядовитых грибов, яда пчел, морских беспозвоночных)
Описание слайда:
Пептиды со вкусовыми качествами
Пептиды со вкусовыми качествами:
Заменители сахара – аспартам Asp-Phe-OMe (в 200 раз слаще сахара, низкая калорийность)
“Вкусный пептид” Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala (получают при обработке мяса папаином)
Белки с интенсивным сладким вкусом – тауматин (207 а.к.) и монеллин (94 а.к.) из плодов африканских растений (слаще сахара в 100 000 раз)
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Курс профессиональной переподготовки
Библиотечно-библиографические и информационные знания в педагогическом процессе
Курс повышения квалификации
Охрана труда
Курс профессиональной переподготовки
Организация деятельности библиотекаря в профессиональном образовании
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Общая информация
Международная дистанционная олимпиада Осень 2021
Похожие материалы
С++ Ввод и вывод
CELLEND Совершенный фитокосмецевтический комплекс
Overview of the Immune System Innate (Nonspecific)
Cell Injury, Cell Death, and Adaptations
MARKETING MIX — PLACE
Единая аграрная политика (ЕАП)
CAREER OR FAMILY
NATIONAL INCOME ACCOUNTING COMPONENTS OF GDP
Не нашли то что искали?
Воспользуйтесь поиском по нашей базе из
5267694 материала.
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
В Туве предложили ввести антиковидные паспорта для школьников
Время чтения: 2 минуты
Рособрнадзор оставил за регионами решение о дополнительных школьных каникулах
Время чтения: 1 минута
Рособрнадзор открыл горячую линию по вопросам контрольных в школах
Время чтения: 1 минута
Роспотребнадзор продлил действие санитарных правил для школ
Время чтения: 1 минута
В школе в Пермском крае произошла стрельба
Время чтения: 1 минута
Минобрнауки утвердило перечень вступительных экзаменов в вузы
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.