какое выражение соответствует первому закону термодинамики в адиабатном процессе
Первый закон термодинамики.
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
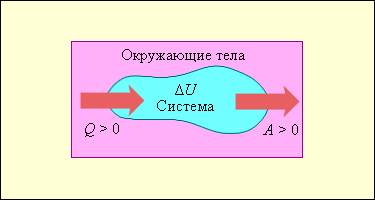
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
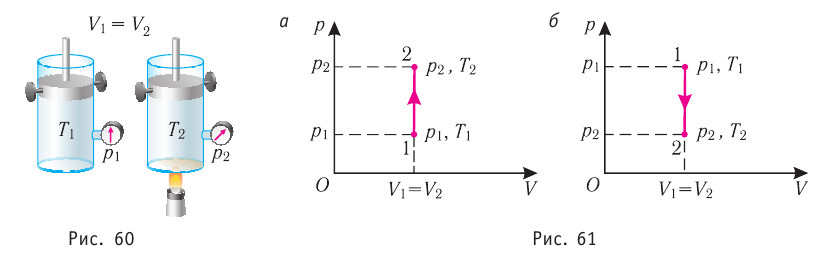
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики 
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
Первый закон термодинамики. Как рассказать просто о сложном?
Термодинамика — раздел физики, в котором изучаются процессы изменения и превращения внутренней энергии тел, а также способы использования внутренней энергии тел в двигателях.
1. Определение первого закона термодинамики
Термодинамика — раздел физики, в котором изучаются процессы изменения и превращения внутренней энергии тел, а также способы использования внутренней энергии тел в двигателях. Собственно, именно с анализа принципов первых тепловых машин, паровых двигателей и их эффективности и зародилась термодинамика. Можно сказать, что этот раздел физики начинается с небольшой, но очень важно работы молодого французского физика Николя Сади Карно.
Самым важным законом, лежащим в основе термодинамики является первый закон или первое начало термодинамики. Чтобы понять суть этого закона, для начала, вспомним что называется внутренней энергией. ВНУТРЕННЯЯ ЭНЕРГИЯ тела — это энергия движения и взаимодействия частиц, из которых оно состоит. Нам хорошо известно, что внутреннюю энергию тела можно изменить, изменив температуру тела. А изменять температуру тела можно двумя способами:
Нам, также известно, что работа, совершаемая газом, обозначается Аг, а количество переданной или полученной внутренней энергии при теплообмене называется количеством теплоты и обозначается Q. Внутреннюю энергию газа или любого тела принято обозначать буквой U, а её изменение, как и изменение любой физической величины, обозначается с дополнительным знаком Δ, то есть ΔU.
Сформулируем ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ для газа. Но, прежде всего, отметим, что когда газ получает некоторое количество теплоты от какого-либо тела, то его внутренняя энергия увеличивается, а когда газ совершает некоторую работу, то его внутренняя энергия уменьшается. Именно поэтому первый закон термодинамики имеет вид:
Так как работа газа и работа внешних сил над газом равны по модулю и противоположны по знаку, то первый закон термодинамики можно записать в виде:
Понять суть этого закона довольно просто, ведь изменить внутреннюю энергию газа можно двумя способами: либо заставить его совершить работу или совершить над ним работу, либо передать ему некоторое количество теплоты или отвести от него некоторое количество теплоты.
2. Первый закон термодинамики в процессах
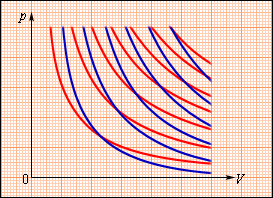
Применительно к изопроцессам первый закон термодинамики может быть записан несколько иначе, учитывая особенности этих процессов. Рассмотрим три основных изопроцесса и покажем, как будет выглядеть формула первого закона термодинамики в каждом из них.
3. Применение
Первое начало термодинамики (первый закон) имеет огромное значение в этой науке. Вообще понятие внутренней энергии вывело теоретическую физику 19 века на принципиально новый уровень. Появились такие понятия как термодинамическая система, термодинамическое равновесие, энтропия, энтальпия. Кроме того, появилась возможность количественного определения внутренней энергии и её изменения, что в итоге привело учёных к пониманию самой природы теплоты, как формы энергии.
Ну, а если говорить о применении первого закона термодинамики в каких-либо задачах, то для этого необходимо знать два важных факта. Во-первых, внутренняя энергия идеального одноатомного газа равна: 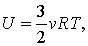
Содержание:
Первый закон термодинамики:
При изучении физики в 9 классе вы узнали, что полная механическая энергия замкнутой системы тел сохраняется только при отсутствии трения, а при наличии трения она уменьшается. Куда девается механическая энергия? Если бутылку, заполненную до половины водой при комнатной температуре, встряхивать в течение нескольких минут, то окажется, что вода нагрелась на 1—2 °С. Каким образом нагрелась вода?
В середине XIX века известный английский физик Дж. Джоуль (1818— 1889), проведя многочисленные опыты, показал, что совершённая при перемешивании воды механическая работа практически равна увеличению её внутренней энергии. Опыты Джоуля, а также исследования немецкого врача и естествоиспытателя Р. Майера (1814—1878), немецкого профессора физиологии и одного из самых знаменитых физиков второй половины XIX века Г. Гельмгольца (1821 —1894) позволили сформулировать закон сохранения и превращения энергии, распространив его на все явления природы. Согласно этому закону при любых взаимодействиях материальных объектов энергия не исчезает и не возникает из ничего, она только передаётся от одних объектов к другим или превращается из одной формы в другую.
Для термодинамических систем (в термодинамике обычно рассматривают макроскопически неподвижные системы) закон сохранения и превращения энергии называют первым законом термодинамики. Согласно первому закону термодинамики, приращение внутренней энергии термодинамической системы при переходе из одного состояния в другое равно алгебраической сумме работы, совершённой внешними силами, и количества теплоты, полученного или отданного системой при взаимодействии с внешними телами:
Поскольку работа внешних сил равна работе, совершаемой термодинамической системой, взятой с противоположным знаком (
Если система представляет собой действующее устройство, периодически возвращающееся в исходное состояние, то при этом AU-0 и A-Q. Механизм, который мог бы совершать работу без изменения состояния составляющих его тел и без теплопередачи от внешних тел, называют «вечным двигателем первого рода». Поэтому первый закон термодинамики можно сформулировать и следующим образом: невозможен вечный двигатель первого рода, т. е. такой двигатель, который при неизменном значении собственной внутренней энергии совершал бы работу большую, чем энергия, получаемая им извне.
Применим первый закон термодинамики к различным изопроцессам, происходящим с идеальным одноатомным газом.
Изохорный процесс
Пусть идеальный одноатомный газ находится в цилиндрическом сосуде, закрытом неподвижным поршнем (V = const). Нагреем сосуд с газом. Объём газа остаётся практически постоянным (тепловым расширением сосуда пренебрегаем) (рис. 60), следовательно, работа силы давления газа А= 0. Тогда первый закон термодинамики примет вид 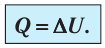
Это означает, что всё передаваемое газу количество теплоты идёт на увеличение его внутренней энергии. При этом приращение внутренней энергии газа 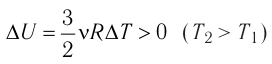
процессе отдаёт количество теплоты, то его внутренняя энергия убывает:
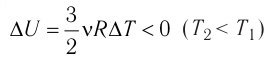
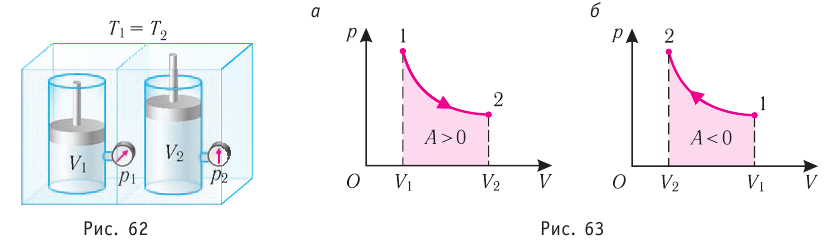
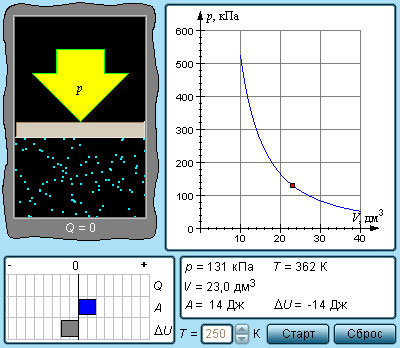
Изотермический процесс
Пусть цилиндрический сосуд с газом под поршнем находится в термостате — устройстве, в котором поддерживается постоянная температура. В этом случае внутренняя энергия идеального одноатомного газа 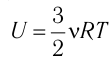
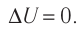
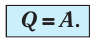
Какие выводы следуют из этого? Если с помощью внешнего устройства медленно перемещать поршень в сосуде так, чтобы объём газа увеличивался (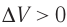
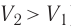
Если же внешнее устройство обеспечивает медленное уменьшение объёма газа в сосуде (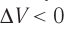
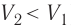
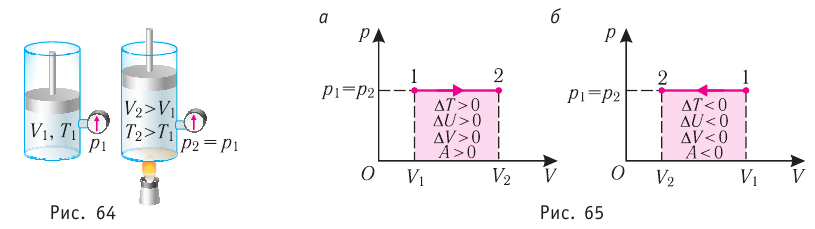
Изобарный процесс
Пусть газ находится в цилиндрическом сосуде, закрытом поршнем, который может свободно или под постоянной нагрузкой перемещаться (рис. 64). Нагреем газ, передав ему некоторое количество теплоты (Q > 0). Согласно первому закону термодинамики (11.2) переданное газу количество теплоты частично расходуется на увеличение внутренней энергии 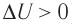
При изобарном процессе работа расширения (сжатия) газа 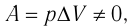
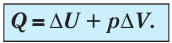
При изобарном сжатии газа внешние силы совершают работу А’ > 0. Чтобы давление газа при этом оставалось постоянным, газ необходимо охлаждать, т. е. он должен отдавать в окружающую среду некоторое количество теплоты (Q
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Первый закон термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В этом случае справедливой будет формула внутренней энергии газа:
Первый закон термодинамики для изобарного процесса дает:
Первый закон термодинамики для изотермического процесса выражается соотношением
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
Адиабатический процесс относится к изопроцессам.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Физика. 10 класс
§ 14. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам изменения состояния идеального газа
В 9-м классе вы узнали, что полная механическая энергия замкнутой системы тел сохраняется только при отсутствии трения, а при наличии трения она уменьшается. Куда девается механическая энергия?
Закон сохранения энергии. В середине XIX в. известный английский физик Дж. Джоуль (1818–1889), проведя многочисленные опыты, показал, что совершённая при перемешивании воды механическая работа практически равна увеличению её внутренней энергии. Опыты Джоуля, а также исследования немецкого врача и естествоиспытателя Р. Майера (1814–1878), немецкого профессора физиологии и одного из самых знаменитых физиков второй половины XIX в. Г. Гельмгольца (1821–1894) позволили сформулировать закон сохранения и превращения энергии, распространив его на все явления природы.
Закон сохранения и превращения энергии: при любых взаимодействиях материальных объектов энергия не исчезает и не возникает из ничего, она только передаётся от одних объектов к другим или превращается из одной формы в другую.
Закон сохранения и превращения энергии является всеобщим законом природы и связывает воедино все физические явления. Этот закон выполняется абсолютно точно, на нём базируется всё современное естествознание.
Если бутылку, заполненную до половины водой при комнатной температуре, встряхивать в течение нескольких минут, то окажется, что вода нагрелась на 1–2 °С. Что является причиной повышения температуры воды?


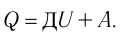
Warning: Use of undefined constant expert_review_likes - assumed 'expert_review_likes' (this will throw an Error in a future version of PHP) in /var/www/www-ars1963/data/www/ck62.ru/wp-content/themes/colormag/comments.php on line 93