какое расстояние между атомами
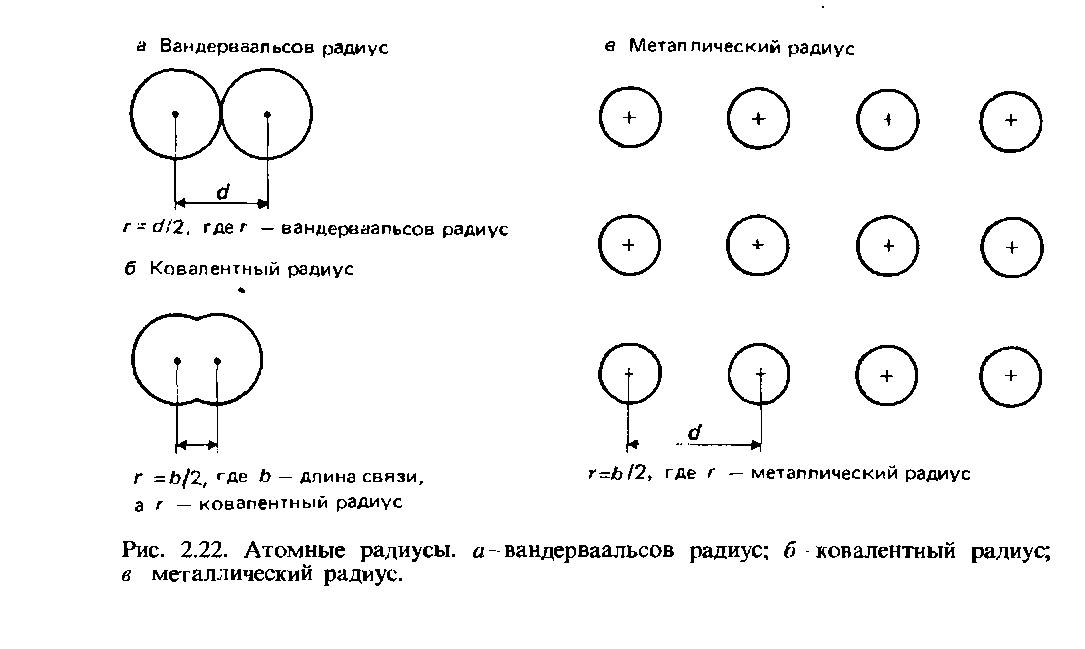
Атомные радиусы
Определение атомных радиусов также связано с некоторыми проблемами. Во-первых, атом не является сферой со строго определенными поверхностью и радиусом. Напомним, что атом представляет собой ядро, окруженное облаком электронов. Вероятность обнаружения электрона по мере удаления от ядра постепенно возрастает до некоторого максимума, а затем постепенно уменьшается, но становится равной нулю только на бесконечно большом расстоянии. Во-вторых, если мы все же выберем некоторое условие для определения радиуса, такой радиус все равно нельзя будет измерить экспериментально.
Эксперимент позволяет определять только межъядерные расстояния, другими словами-длины связей (и то с определенными оговорками, приведенными в подписи к рис. 2.21). Для их определения используется рентгеноструктурный анализ или метод электронографии (основанный на дифракции электронов). Радиус атома полагают равным половине наименьшего межъядерного расстояния между одинаковыми атомами.
Вандерваальсовы радиусы. Для несвязанных между собой атомов половина наименьшего межъядерного расстояния называется вандерваальсовым радиусом. Это определение поясняет рис. 2.22.
Рис. 2.21. Длина связи. Вследствие того что молекулы непрерывно колеблются, межъядерное расстояние, или длина связи, не имеет фиксированного значения. Этот рисунок схематически изображает линейное колебание простой двухатомной молекулы. Колебания не позволяют определить длину связи просто как расстояние между центрами двух связанных атомов. Более точное определение выглядит так: длина связи это расстояние между связанными атомами, измеренное между центрами масс двух атомов и соответствующее минимуму энергии связи. Минимум энергии показан на кривой Морзе (см. рис. 2.1).
Ковалентные радиусы. Ковалентный радиус определяется как половина межъядерного расстояния (длины связи) между двумя одинаковыми атомами, связанными друг с другом ковалентной связью (рис. 2.22, б). В качестве примера возьмем молекулу хлора Cl2, длина связи в которой составляет 0,1988 нм. Ковалентный радиус хлора полагается равным 0,0944 нм.
Зная ковалентный радиус атома одного элемента, можно вычислить ковалентный радиус атома другого элемента. Например, экспериментально установленное значение длины связи С—Cl в CH3Cl равно 0,1767 нм. Вычитая из этого значения ковалентный радиус хлора (0,0994 нм), находим, что ковалентный радиус углерода равен 0,0773 нм. Такой метод вычисления основан на принципе аддитивности, согласно которому атомные радиусы подчиняются простому закону сложения. Таким образом, длина связи С—Cl представляет собой сумму ковалентных радиусов углерода и хлора. Принцип аддитивности применим только к простым ковалентным связям. Двойные и тройные ковалентные связи имеют меньшую длину (табл. 2.7).
Длина простой ковалентной связи зависит еще от ее окружения в молекуле. Например, длина связи С—H изменяется от 0,1070 нм у тризамещенного атома углерода до 0,115 нм в соединении CH3CN.
Металлические радиусы. Металлический радиус полагается равным половине межъядерного расстояния между соседними ионами в кристаллической решетке металла (рис. 2.22, в). Термин атомный радиус обычно относится к ковалентному радиусу атомов неметаллических элементов, а термин металлический радиус
к атомам металлических элементов.
Ионные радиусы. Ионный радиус-это одна из двух частей межъядерного расстояния между соседними одноатомными (простыми) ионами в кристаллическом ионном соединении (соли). Определение ионного радиуса тоже сопряжено с немалыми проблемами, поскольку экспериментально измеряют межионные расстояния, а не сами ионные радиусы. Межионные расстояния зависят от упаковки ионов в кристаллической решетке. На рис. 2.23 показаны три возможных способа упаковки ионов в кристаллической решетке. К сожалению, экспериментально измеренные межионные расстояния
Рис. 2.23. Ионные радиусы, с-анионы соприкасаются друг с другом, но катионы не соприкасаются с анионами; б-катионы соприкасаются с анионами, но анионы не соприкасаются друг с другом; в условно принятое расположение ионов, при котором катионы соприкасаются с анионами и анионы соприкасаются друг с другом. Расстояние а определяется экспериментально. Оно принимается за удвоенный радиус аниона. Это позволяет вычислить межионное расстояние b, представляющее собой сумму радиусов аниона и катиона. Зная межионное расстояние Ь, можно вычислить радиус катиона.
не позволяют судить о том, какой из этих трех способов упаковки действительно осуществляется в каждом конкретном случае. Проблема заключается в том, чтобы найти пропорцию, в которой следует разделить межионное расстояние на две части, соответствующие радиусам двух ионов, другими словами, решить, где же на самом деле кончается один ион и где начинается другой. Как показывает, например, рис. 2.12, этот вопрос не позволяют решить и карты электронной плотности солей. Для преодоления указанной трудности обычно предполагают, что: 1) межионное расстояние представляет собой сумму двух ионных радиусов, 2) ионы имеют сферическую форму и 3) соседние сферы соприкасаются друг с другом. Последнее предположение соответствует способу упаковки ионов, изображенному на рис. 2.23, е. Если известен один ионный радиус, другие ионные радиусы можно вычислить на основании принципа аддитивности.
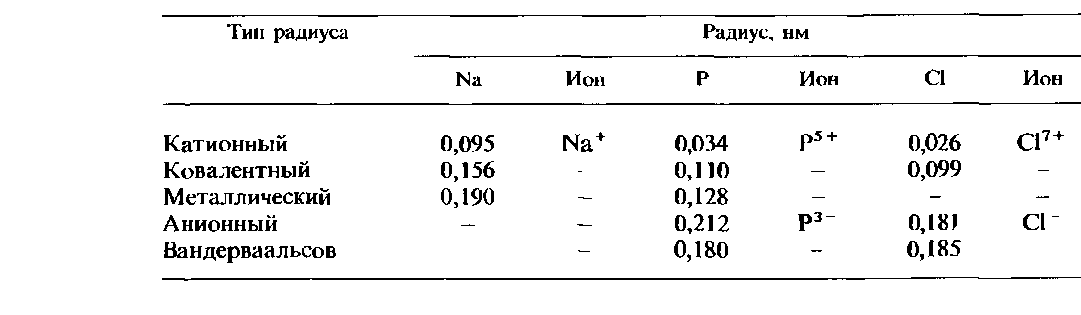
Таблица 2.8. Сопоставление атомных радиусов различных типов
Что удерживает ядра атомов?
Теперь, когда нам известно, что ядро атома крохотное, у нас появляется очевидный вопрос: а почему оно такое маленькое? Атомы состоят из крохотных частиц, но по размеру они гораздо больше этих частиц. Мы уже разбирались, почему так происходит. Но при этом ядра не сильно отличаются по размеру от протонов и нейтронов, из которых они состоят. Есть ли тому причина, или это совпадение?
Мы уже знаем, что атомы удерживают электрические силы. Какие же силы удерживают ядро атома?
И тут мы вступаем на новую территорию, сильно отличающуюся от того, что мы изучали ранее – поскольку становится очевидным, что здесь работает сила, которую мы ещё не обсуждали.
В атоме крохотное ядро и ещё меньшие по размеру электроны расположены далеко друг от друга по отношению к их размерам, и электрические силы, удерживающие их в атоме, просты. Но в молекулах расстояние между атомами сравнимо с размером атомов, поэтому внутренняя сложность атомов начинает играть роль. Разнообразие и сложные наборы частично компенсирующих друг друга электрических сил, и процессы, в которых электроны способны передвигаться между атомами, делают историю молекул гораздо богаче и сложнее, чем у атомов. Так же расстояние между протонами и нейтронами в ядре сравнимо с их размером – поэтому, как и с молекулами, силы, удерживающие атомные ядра, оказываются гораздо сложнее (в определённых смыслах) сил, удерживающих протоны или нейтроны.
После изучения структуры протонов и нейтронов, эта история станет (немного) проясняться. Базовые свойства ядерной физики вполне ясны, но эта тема остаётся чрезвычайно технической, и многие детали всё ещё исследуют. Я не смогу как следует описать её в этой статье, в частности потому, что я недостаточно хорошо разбираюсь в этой теме, чтобы удобно её упростить для вас.

Рис. 2: легчайшие из стабильных и почти стабильных ядер, вместе с нейтроном. Нейтрон и тритий показаны пунктиром, поскольку они в итоге распадаются. Голубым цветом указаны альтернативные названия.
Схема работы
Посмотрим, что можно узнать, исходя из простых рассуждений о работе этой силы. Одна из подсказок – все ядра, за исключением самого распространённого изотопа водорода (один протон) содержат нейтроны; то есть не бывает ядер с несколькими протонами и без нейтронов (рис. 2). Так что явно нейтроны играют важную роль в том, чтобы помогать протонам держаться вместе.
И наоборот, не бывает ядер, состоящих из одних нейтронов; в самых лёгких ядрах, например, в кислороде или кремнии, примерно столько же нейтронов, сколько протонов (рис. 2). В более крупных и массивных ядрах, например, золота и радия, чуть больше нейтронов, чем протонов (рис. 3). Из этого следуют две вещи:

Рис. 3
Размер ядра
Одна из главных целей этой статьи – объяснить, почему ядра атомов малы по сравнению с размером атома. Для этого начнём с простейшего ядра, содержащего протоны и нейтроны – со второго по распространённости изотопа водорода, состоящего из одного электрона (как и все изотопы водорода) и ядра, состоящего из протона и нейтрона. Этот изотоп часто называют дейтерием, а ядро дейтерия (см. рис. 2) иногда называют дейтроном. Как понять, что удерживает дейтрон? Мы можем наивно предположить, что эта система не отличается от атома водорода, также содержащего две частицы (протон и электрон) – см. рис. 4.
Как мы видели в предыдущей статье, то, что масса электронов мала по сравнению с протонами и нейтронами, гарантирует, что:
Но мы уже догадались, что остаточное сильное взаимодействие сильнее электромагнетизма на таком же расстоянии – поскольку иначе оно не могло бы предотвратить электромагнитное отталкивание протонов, которые разорвали бы ядро. Так что эта дополнительная сила будет стягивать протоны и нейтроны вместе ещё плотнее. Поэтому неудивительно, что дейтрон и другие ядра не просто в тысячу, но в десятки тысяч раз меньше атомов! Повторю, это всё потому, что:

Рис. 4
Малое расстояния действия этой силы
Вещество пустого пространства
«Наука учением своим о веществе вступает в чудную гармонию с Писанием. Она признаёт повсюду вещество, где есть пространство.» – стр. 335, «Слово о смерти», Святитель Игнатий (Брянчанинов), Москва, изд-во «Отчий дом», 2010
Гипотеза атомов вещества настолько укоренилась, что мы не мыслим уже себе простейших атомов неподобных модели атома водорода, а сложные случаи оставляем для будущего теоретического описания. Посмотрим внимательно на модель атома водорода. В ней рассматривается ядро, протон и электрон на некотором удалении от ядра. Квантовая механика ввела понятие плотности электронных состояний, и плотность электронных состояний не нулевая там, где есть вероятность электрону оказаться в какой-то момент времени. В атоме водорода плотность электронных состояний такова, что в положении ядра, протона она нулевая, т.е. вероятность появиться электрону в положении ядра мала, исчезающая при попытке её определить. Что бы значило практическое обнаружение совпадения положений электрона и протона? Ответ очень многое значит для современной науки о фундаментальных взаимодействиях.
Мы говорим, что между электроном и протоном в атоме водорода есть пространство. Чем оно заполнено? Каким «веществом»? Полковник Чехмейстренко, заведующий военной кафедрой физического факультета МГУ, говорил на лекциях, что «между электронной оболочкой и ядром в атомах находится воздух», и он был недалёк от истины, несмотря на анекдотическую парадоксальность утверждения.
Что такое воздух? Это легко понять, переводя разговор из области атомной физики в науку об атмосфере Земли. Без воздуха невозможно дыхание, а значит жизнь многих видов живого на Земле. Интересуясь составом воздуха, давно выяснили, что в него входят газы. Наиболее лёгкие и тонкие из газов в воздухе называют фундаментальным эфиром. Это есть вещество пустого пространства. Значит, между электроном и протоном в атоме водорода должен быть фундаментальный эфир, который обеспечивает контактное взаимодействие электрона и протона через некую упругость, силу которой можно по аналогии с упругой силой Гука считать линейно зависящей от расстояния между частицами. Потенциал такой силы квадратично зависит от расстояния. А какова же константа упругости, которую требуется поставить в формуле для зависимости силы от расстояния, чтобы получить фундаментальную упругую силу? Ответ на последний вопрос почти в точности совпадает с вопросом о структуре суперструны, этого нового объекта природы, через который новая физика может объяснить без противоречий все взаимодействия в физическом мире.
В квантовой механике упругий потенциал известен давно и даёт решение для уравнения Шредингера, называемого квантовый осциллятор. У квантового осциллятора спектр состояний эквидистантный, т.е. всего одна частота колебаний определяет весь спектр состояний. В теории суперструн упругий потенциал обобщённый. Чтобы понять отличие, вспомним явление сверхпластичности в упругих телах. Это явление приводит к тому, что, при превышении расстояния между упруго взаимодействующими частицами некоторого значения, упругость переходит в новый режим с соответствующей новой константой упругости. При этом потенциал обобщается до включения нескольких мод сверхпластичности, и получается, что спектр колебаний перестаёт быть эквидистантным. Множество возможностей учесть режимы пластичности приводит к спектру суперструн, что необычно расширяет круг явлений описываемых теорией суперструн. Мы намерены принять структурный подход в теории суперструн, чтобы выйти на физику сверх-вселенной, о которой современная наука ещё мало что говорит, но уже знает из исследований, начинавшихся Александром Линде и Ли Смолиным независимо в альтернативных подходах.
Атомный радиус, как он измеряется, как он изменяется в периодической таблице, примеры
атомный радиус это важный параметр для периодических свойств элементов таблицы Менделеева. Это напрямую связано с размером атомов, поскольку на большем радиусе они больше или громоздче. Кроме того, это связано с электронными характеристиками того же.
Пока атом имеет больше электронов, тем больше его размер и атомный радиус. Оба определяются электронами валентной оболочки, потому что на расстояниях за пределами их орбит вероятность обнаружения электрона приближается к нулю. В окрестности ядра происходит обратное: увеличивается вероятность нахождения электрона.
Верхнее изображение представляет собой упаковку ватных шариков. Обратите внимание, что каждый из них окружен шестью соседями, не считая другого возможного верхнего или нижнего ряда. Способ уплотнения ватных шариков будет определять их размеры и, следовательно, их радиусы; как это происходит с атомами.
Элементы в соответствии с их химической природой так или иначе взаимодействуют со своими собственными атомами. Следовательно, величина атомного радиуса варьируется в зависимости от типа присутствующей связи и твердой упаковки ее атомов..
Как измеряется атомный радиус?
На основном изображении можно легко измерить диаметр ватных шариков, а затем разделить его на два. Однако сфера атома не полностью определена. Почему? Потому что электроны циркулируют и диффундируют в определенных областях пространства: орбитали.
Поэтому атом можно рассматривать как сферу с неощутимыми краями, о которых невозможно точно сказать, в какой степени они заканчиваются. Например, на верхнем изображении центральная область около ядра выглядит более интенсивной, а ее края размыты.
Изображение представляет двухатомную молекулу E2 (как Cl2, H2, О2, и т.д.). Предполагая, что атомы являются сферическими телами, если расстояние было определено d что разделяет оба ядра в ковалентной связи, то было бы достаточно разделить его на две половины (d/ 2) получить атомный радиус; точнее, ковалентный радиус E для E2.
А если Е не образует с собой ковалентных связей, но это металлический элемент? то d это будет указано числом соседей, которые окружают Е в его металлической структуре; то есть по координационному числу (N.C) атома в упаковке (помните ватные шарики основного изображения).
Определение межъядерного расстояния
Определить d, это межъядерное расстояние для двух атомов в молекуле или упаковке, это требует методов физического анализа.
Одной из наиболее часто используемых является дифракция рентгеновских лучей, в которой пучок света облучается через кристалл, и изучается дифракционная картина, возникающая в результате взаимодействия электронов с электромагнитным излучением. В зависимости от упаковки могут быть получены различные дифракционные картины и, следовательно, другие значения d.
Если атомы «плотно» в кристаллической решетке, они будут представлять разные значения d по сравнению с тем, что они имели бы, если бы они были «удобными». Кроме того, эти межъядерные расстояния могут колебаться в значениях, поэтому атомный радиус фактически состоит из среднего значения таких измерений.
Как связаны атомный радиус и координационное число? В. Гольдшмидт установил взаимосвязь между ними, в которой для N.C. из 12 относительное значение равно 1; от 0,97 для упаковки, где атом имеет N.C, равный 8; 0,96 для N.C, равного 6; и 0,88 для N.C. из 4.
единицы
Из значений для N.C, равных 12, было построено много таблиц, сравнивающих атомные радиусы всех элементов периодической таблицы..
Поскольку не все элементы образуют такие компактные структуры (N.C меньше 12), соотношение В. Гольдшмидта используется для расчета их атомных радиусов и выражения для одной и той же упаковки. Таким образом, измерения атомных радиусов стандартизированы.
Как это меняется в периодической таблице?
На протяжении периода
Слева направо в тот же период, ядро добавляет протоны и электроны, но последние ограничены тем же уровнем энергии (главное квантовое число). Как следствие, ядро оказывает увеличивающийся эффективный заряд ядра на валентные электроны, который сжимает атомный радиус..
Таким образом, неметаллические элементы в тот же период имеют тенденцию иметь атомные (ковалентные) радиусы меньше, чем металлы (металлические радиусы).
По убыванию группой
При спуске по группе включаются новые уровни энергии, которые позволяют электронам иметь больше места. Таким образом, электронное облако преодолевает большие расстояния, его размытая периферия все больше отдаляется от ядра, и, следовательно, радиус атома расширяется.
Сокращение лантаноидов
Электроны внутреннего слоя помогают экранировать эффективный заряд ядра на валентных электронах. Когда орбитали, составляющие внутренние слои, имеют много «дырок» (узлов), как и в случае f-орбиталей, ядро сильно сжимает атомный радиус из-за плохого экранирующего эффекта орбиталей..
Этот факт подтверждается сокращением лантаноидов в период 6 периодической таблицы. От La до Hf происходит значительное сжатие атомного радиуса, создаваемого орбиталями f, которые «заполняются» при прохождении через блок f: у лантаноидов и актиноидов.
Аналогичный эффект можно наблюдать и с элементами блока p периода 4. На этот раз произведение слабого экранирующего эффекта орбиталей d, которые заполняются при пересечении периодов переходных металлов..
примеров
Для периода 2 периодической таблицы атомные радиусы ее элементов:
Обратите внимание, что металлический литий имеет наибольший атомный радиус (257 мкм), в то время как фтор, расположенный в крайней правой части периода, является наименьшим из них (64 мкм). Атомный радиус уменьшается слева направо за тот же период, и перечисленные значения показывают его.
Литий, образуя металлические связи, его радиус металлический; и фтор, поскольку он образует ковалентные связи (F-F), его радиус является ковалентным.
А если вы хотите выразить атомные радиостанции в единицах ангстрема? Просто разделите их на 100: (257/100) = 2,57Å. И так далее с остальными ценностями.
Что находится внутри атомного ядра?
Большая часть массы атома сосредоточена в его ядре. Ядро атома окружено чрезвычайно маленькими и легкими электронами, которые вращаются в атоме, но не нарушают значительного пустого пространства между ядром и границами атома. Чтобы получить четкое изображение ядра атома, нужно сначала знать, что происходит с электронами и остальной частью атома.
Электроны вокруг ядра атома
Электроны имеют свои специфические орбиты, а именно: S, P, D, F, а затем G. Каждая орбита представляет собой сферическую оболочку, и имена выводятся из спектра испускаемого света из этих оболочек, описывающих характер спектральных линий. Другой факт об электронах заключается в том, что они находятся везде, что позволяют квантовые законы.
Электроны вращаются вокруг плотного ядра атома в облаках отрицательного заряда.
В атоме углерода, например, шесть электронов. Два из них занимают сферическую оболочку в центре атома, а остальные четыре распределены в смеси сферических оболочек и трехлопастных оболочек. Таким образом, ядро окружено чем-то вроде облаков отрицательного заряда, а электроны находятся везде, где только могут быть, но не заполняют пустые пространства. Электроны помогают создавать молекулы.
Электронные связи между атомами
Если два атома углерода подходят достаточно близко, их ближайшие электроны взаимодействуют и образуют одинарную связь. Эта связь в химии называется сигма-связью. Затем облака изгибаются и соединяются, создавая «Пи-связь», которая выглядит как деревья, соединяющие верхние ветви над улицей.
Связи становятся все более и более сложными в различных ситуациях, и это выходит за рамки данной статьи. Тем не менее одна вещь остается постоянной во всех этих связях: электроны все еще рассеяны в относительно огромном облаке вокруг очень плотного ядра, и там все еще много пустого пространства. Электрические поля и электронные облака удерживают эту огромную пустоту вместе. Что же тогда находится внутри ядра атома?
Протоны и нейтроны
Внутри протонов и нейтронов
В 1950-х годах наука поняла, что протоны и нейтроны состоят из более мелких частиц. Несколько лет спустя, в 1964 году, американский физик Мюррей Гелл-Манн представил кварки. Он не знал, сколько типов кварков существует, но сегодня открыто по крайней мере шесть кварков: верхний (символ u α ), нижний (символ d α ), странный (символ s α ), очарованный (символ c α ), красивый (символ b α ) и истинный (символ t α ).
Если рассматривать протон как баскетбольный мяч, каждый кварк будет меньше песчинки. Следовательно, большая часть протона и нейтрона также является пустым пространством, в то время как кварки перемещаются со скоростью, близкой к скорости света.
Маленькие ядра удерживают частицы настолько малы, что наше самое мощное и самое точное оборудование не может их видеть. В то же время они обладают самой сильной силой, когда-либо существовавшей в пустых пространствах и сверхмалых частицах, называемых кварками.
Общие вопросы об атомном ядре
Вопрос: Что находится в ядре атома?
Ядро атома состоит из протонов и нейтронов. Протоны несут положительный заряд, равный электронам, вращающимся вокруг, а нейтроны не несут заряда, но весят столько же, сколько протоны.
Вопрос: Какова функция ядра атома?
Ядро атома создает силу, необходимую для того, чтобы держать атом вместе и в порядке. Это самая тяжелая часть атома и очень плотная. Размер ядра по отношению ко всему атому подобен мячу на футбольном поле.
Вопрос: Ядро атома нейтрально?
Ядро атома несет положительный электрический заряд. Однако атом нейтрален, поскольку количество электронов с отрицательным зарядом равно количеству протонов в ядре.