какое определение наиболее точно объясняет что такое супербактерии
Сколько людей убивают супербактерии, и как от них защититься
Что такое супербактерии?
«Супербактерии» – это микроорганизмы, которые смогли выработать устойчивость к антимикробным препаратам. В последнее два десятилетия они стали одним из главных поводов для беспокойства медицинского сообщества. Проблема антимикробной резистентности (АМР) становится глобальной. Микробы, как и все живые существа, эволюционируют, приобретают новые «способности» и адаптируются к меняющейся среде. Из-за этого эффективность существующих антибиотиков исчерпывается, а разработка новых занимает много времени и стоит очень дорого.
Как именно инфекции сопротивляются антибиотикам?
Способов противостоять лекарствам у микроорганизмов немало. Но одна из главных проблем – выработка металло-бета-лактамазы. Этот фермент способен расщеплять различные антимикробные припараты. Он защищает микроорганизмы сразу от нескольких классов антибиотиков, включая пенициллины, цефалоспорины и карбапенемы. Cамое главное, что ген, отвечающий за выработку этого фермента, может передаваться другим видам микроорганизмов за счет горизонтального переноса генов. Другим словами, микробы могут делиться этим «умением» друг с другом, даже если «не состоят в родстве».
Как появляются микроорганизмы с АМР?
Супербактерии появляются на свет в «борьбе за жизнь», сталкиваясь с агрессивными средами, особенно если человек сам дает им такую возможность. Главные причины появления бактерий с АМР это:
Насколько опасны такие инфекции?
Микроорганизмы с АМР вызывают трудноизлечимые заболевания и провоцируют опасные состояния, в том числе некротизирующие пневмонии, сепсис и тяжелые некрозы. Каждый год около 700 тысяч человек по всему миру умирают из-за болезней, вызванных бактериями с антимикробной резистентностью. Из них 22 тысячи человек – в странах Европы. А по прогнозам инфекционистов, к 2050 году эта цифра может увеличиться до 10 миллионов человек.
По данным ВОЗ, в числе самых распространенных резистентных бактерий значатся:
Эти инфекции хоть как-нибудь можно вылечить?
С большим трудом и не всегда. Распространенные антибиотики приходится заменять новыми и весьма недешевыми препаратами или, напротив, старыми, но небезопасными сильнодействующими средствами, у которых намного больше побочных эффектов. Например, старый и полузабытый в развитых странах антибиотик хлорамфеникол: его прием сопряжен с тяжелыми побочными реакциями, и он сам по себе может быть опасен для здоровья, но из-за распространения резистентных инфекций применение этого препарата снова рассматривается специалистами. Впрочем, есть сведения о бактериях устойчивых и к хлорамфениколу.
Как можно предотвратить появление микроорганизмов с АМР?
Решить эту проблему можно только системными мерами, принимаемыми на международном уровне. В Европе и США уже много лет существуют программы противодействия распространению резистентных инфекций, а Всемирная организация здравоохранения еще в 2001 году опубликовала глобальную стратегию сдерживания этих инфекций. На этой неделе и в России наконец-то был принят подобный документ: «Стратегия предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года».
А пока 2030 год не наступил, что я могу сделать чтобы защититься?
Главный способ защиты, кроме обычных правил гигиены, – не выращивать резистентные бактерии в своем организме: применять антибиотики только по назначению врача и всегда завершать предписанный курс, независимо от того, пропали симптомы заболевания или нет.
Прирожденные убийцы: почему бактерии выигрывают в борьбе с антибиотиками
МОСКВА, 7 мая — РИА Новости, Альфия Еникеева. Супербактерии, устойчивые к антибиотикам, — одна из главных проблем современной медицины. Возбудители гонореи, стафилококка, пневмококка мутировали, и теперь непонятно, как с ними бороться. Согласно прогнозам, особо стойкие инфекции угрожают миллионам жизней, поэтому перед наукой поставлена задача — разработать более мощные средства борьбы, а также альтернативу антибиотикам.
Обычная бактерия кишечной палочки Escherichia coli всего за 11 дней приспособилась к тысячекратной дозе антибиотиков. Видео, снятое в ходе эксперимента учеными Гарвардской медицинской школы, показывает, как постепенное увеличение концентрации препарата превращает ее в супермикроб, неуязвимый для любых лекарств.
Вырабатывать антибиотики и уметь им сопротивляться — естественная стратегия выживания в мире бактерий. Но в природе стойкие к антибиотикам штаммы оказывались в проигрыше, поскольку размножались медленнее «диких» бактерий.
Откуда берутся супербактерии
Антибиотики действуют на наименее устойчивые бактерии, а вот мутировавшие держатся до последнего. И если с ними не бороться, они передают ген устойчивости при размножении. Кроме того, бактерии обмениваются мутациями.
Три смертельно опасных мутанта
Из-за быстрой приспособляемости к антибиотикам супербактерии опаснее для человечества, чем климатические изменения или загрязнение окружающей среды. Уже сегодня, по данным ВОЗ, в мире от заболеваний, вызванных этими микробами, умирает примерно 800 тысяч человек в год. А к 2050-му, по прогнозам специалистов, суперинфекции ежегодно будут уносить до десяти миллионов жизней.
Три супербактерии признаны ВОЗ критически опасными для человека — они показали резистентность практически ко всем антибиотикам, даже к так называемым препаратам последнего резерва, колистину и бета-лактамным антибиотикам широкого спектра. Это акинетобактерия Баумана, приводящая к пневмонии и инфекциям крови, синегнойная палочка, вызывающая кожную сыпь, ушные инфекции у здоровых людей, серьезные кровяные инфекции, пневмонии у пациентов в больницах, а также энтеробактерии, населяющие кишечник человека, в частности сальмонелла и кишечная палочка.
Сильно опасными ВОЗ считает более распространенные золотистый стафилококк (Staphylococcus aureus), пневмококк (Klebsiella pneumoniae) и гонококк (Neisseria gonorrhoeae), вызывающий гонорею. Кстати, первый случай супергонореи, от которой не помогают антибиотики, недавно зафиксировали в Великобритании. Пациент, чье имя не раскрывают, заразился инфекцией после полового контакта с жительницей Юго-Восточной Азии.
Ученые также опасаются супербактерии туберкулеза, поскольку почти половина штаммов этого патогена устойчива к изониазиду и другим средствам противотуберкулезной терапии. Шестнадцать процентов штаммов не поддаются воздействию ни одного из имеющихся антибиотиков. Такие суперустойчивые туберкулезные палочки выявлены в Индии и Ираке.
Суперантибиотики против супербактерий
Для борьбы с супербактериями ученые создают новые антибиотики либо модифицируют существующие под генетические изменения в конкретных микроорганизмах. Именно этот путь выбрали исследователи МГУ, разработавшие принципиально новый гибридный антибиотик — митохондриально направленный антиоксидант, воздействующий на мембранный потенциал, который обеспечивает бактериальные клетки энергией.
Другой перспективный препарат создан на основе теиксобактина — антибиотика, открытого в 2015 году в образцах почвы. Совсем недавно ученые успешно применили его синтетическую форму для лечения бактериальной инфекции у лабораторных мышей. Предполагается, что это лекарство поможет в борьбе с метициллин-резистентным стафилококком и энтерококком, устойчивым к ванкомицину.
Помимо антибиотиков, ученые разрабатывают и совершенно новые классы препаратов. Так, исследователи из российско-американской лаборатории биомедицинской химии ИХБФМ СО РАН создали аналоги нуклеиновых кислот — фосфорилгуанидины, умеющие проникать в клетку и вступать во взаимодействие с ДНК и РНК, уничтожая бактерию. Ученые отмечают, что в будущем такие вещества можно будет создавать под каждый конкретный патоген на основе анализа его генома.
Еще один точечный метод — бактериофаги, то есть вирусы, поражающие бактериальные клетки. Совсем недавно команда ученых из ИБХ РАН, ИТЭБ РАН и ИБФМ имени Г. К. Скрябина РАН научила фермент бактериофага Т5 разрушать клеточные стенки бактерии кишечной палочки даже с утолщенной из-за мутаций мембраной. Кроме того, исследователи выяснили, что фермент эффективнее уничтожает бактерии, когда ему помогает агент (например, хлоргексидин в очень низких концентрациях).
Эксперты все же считают, что с супербактериями лучше бороться с помощью антибиотиков. Но необходимо ограничивать их свободную продажу в аптеках и применение в сельском хозяйстве — иначе даже новые высокоэффективные препараты не помогут.
Глобальная проблема XXI века: «супербактерии» против человечества
Глобальная проблема XXI века: «супербактерии» против человечества
Как известно, в 2014 году в Женеве Всемирная организация здравоохранения сделала доклад, содержащий полную картину влияния традиционных антимикробных препаратов на бактерии с учетом данных полученных из 114 стран.
Картина получилась неутешительная: традиционные лекарственные препараты, включая антибиотики, оказались бесполезны либо слабы в отношении различных переносчиков инфекции. Явление назвали «антимикробной резистентностью».
В 2017 году ВОЗ опубликовала список критической группы бактерий, представляющих собой повышенную опасность.
В их числе —Acinetobacter baumannii, синегнойная палочка (Pseudomonas aeruginosa), энтеробактерии (Enterobacteriaceae), энтерококки фэциум (Enterococcus faecium), золотистый стафилококк (Staphylococcus aureus), хеликобактер пилори (Helicobacter pilori), кампилобактеры (Campylobacter), сальмонелла (Salmonella), гонококк (Neisseria gonorrhoeae), пневмококк (Streptococcus pneumonia), гемофильная палочка (Haemophilus influenza, шигелла (Shigella).
В числе устойчивых микроорганизмов оказались также бактерии Klebsiella pneumonia, Escherichia coli, MRSA (метициллин устойчивые бактерии Staphylococcus aureus) и другие, вызывающие серьезные заболевания: сепсис, гонорею, инфекции мочевыводящих путей, пневмонию.
Тесты на устойчивость к антибиотикам. Бактерии высевают штрихами на чашках с белыми дисками, пропитанными антибиотиком. Чистые кольца, как на чашке слева, показывают, что бактерии не выросли — что свидетельствует об отсутствии устойчивости у этих бактерий. Бактерии на чашке справа полностью восприимчивы только к трем из семи протестированных антибиотиков / Dr Grahan Beards
Так, к примеру, по данным ученых ВОЗ, случаи бесполезного лечения гонореи цефалоспоринами третьего поколения, относящихся к группе антибиотиков повышенной активности и применяющихся в качестве «крайней меры», подтвердились в десяти странах.
Случаи зарегистрированы в Австралии, Австрии, Канаде, Норвегии, Словении, Швеции, Франции, Южной Африке, Японии и Соединенном Королевстве. Это притом что в мире этим заболеванием ежедневно инфицируется более одного миллиона человек.
Также, по оценкам ВОЗ, вероятность смерти людей инфицированных MRSA на 64% выше, если сравнивать с неустойчивой формой инфекции.
Кроме того, по данным доклада центра RANDEurope и KMPG, от устойчивых к антибиотикам инфекций в мире ежегодно умирает по меньшей мере 700 тысяч человек.
В США, по данным американского Центра по контролю и профилактике заболеваний, эта цифра ежегодно составляет 23 тысячи человек, в Евросоюзе показатель достигает 25 тысяч.
Зарождение «супербактерии»
Для того чтобы понять, почему микроорганизмы становятся устойчивыми к лекарствам, важно знать их природу. Бактерии представляют собой одну из первых форм жизни на Земле.
Ископаемые свидетельства датируются в ряде случаев началом периода архея — 3,5 миллиарда лет назад. Это обширная группа одноклеточных микроорганизмов.
И чтобы понять, как появляются «супербактерии», вспомним биологию, точнее, ее раздел, посвященный синтетической эволюции. Как известно, ее основополагающие принципы — естественный отбор, наследственность и изменчивость.
Согласно теории, новые признаки в строении организмов и их функциональных особенностях возникают в связи с изменчивостью, которая, в свою очередь, может быть определенной и неопределенной.
Первый тип изменчивости имеет место, когда условия окружающей среды оказывают одинаковое влияние на всех особей одного вида.
Примером такой изменчивости может послужить появление у зайцев белой шерсти, что ожидаемо в зимний период, поскольку это помогает быть более незаметными для хищников на снегу. Такой тип изменчивости затрагивает фенотипические особенности организма и не наследуется генетически.
Подобная изменчивость может проявляться вне зависимости от текущих условий окружающей среды и способна устойчиво передаваться потомству.
Вспомним и о наследовании приобретенных признаков, открытом еще французским биологом Жаном Батистом Ламарком, основной тезис которого заключается в том, что в ответ на изменения окружающей среды организмы способны меняться, приспосабливаться и передавать приобретенные изменения своему потомству.
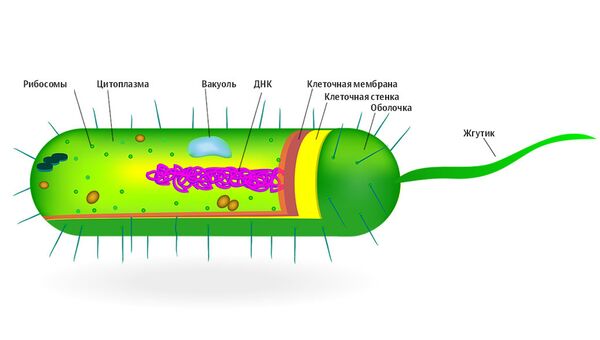
По форме бактерии можно разделить на палочковидные — бациллы, сферические –кокки — и спиралевидные — спириллы.
По своему строению бактерии делятся на прокариот (доядерные), ДНК (дезоксирибонуклеиноваякислота) которых находится в определенной зоне клетки бактерии, и эукариот (ядерные) — их ДНК располагается в окруженном оболочкой ядре клетки.
Но, несмотря на разнообразие форм и строения, все бактерии объединяет одно важное свойство — способность передавать из поколения в поколение информацию с помощью своего генетического материала (ДНК), в том числе об устойчивости к лекарственным средствам.
Причем передача информации и проявление новых признаков, включая резистентность, могут происходить достаточно быстро, учитывая скорость размножения бактерий.
Многие из них путем деления способны давать потомство в течение 30 минут, а за сутки всего одна клетка может образовать 72 новых поколения, каждое из которых получает определенную информацию об устойчивости к лекарственным препаратам, если, конечно, прародитель сталкивался с тем или иным антимикробным средством.
В результате такой передачи информации через некоторое время может появиться поколение «супербактерий», которые являются невосприимчивыми ни к одному известному антибиотику, как в случае с 70-летней американкой из штата Невада.
В 2017 году женщина скончалась из-за полной резистентности бактерии Klebsiella pneumoniae к 26 видам известных антибиотиков. Все они оказались полностью бесполезны в борьбе с инфекцией.
Наука и устойчивость
В настоящее время наиболее известными средствами для борьбы с бактериями являются антибиотики, появлению которых мировое сообщество обязано Александру Флемингу, обнаружившему в 1928 году в ходе исследования, что обыкновенная плесень Penicillium, которая произрастает на лежалом хлебе, вырабатывает вещество, убивающее бактерии семейства Staphylococcaceae.
Так появился всем известный «пенициллин».
Сегодня в мире существует несколько тысяч натуральных и даже синтетических антибиотиков, объединенных в 16 классов. Например, пенициллин, относится к бета-лактамным препаратам.
Но из всего множества созданных ранее антибиотиков в настоящее время используется не более пяти процентов. Это напрямую связано с тем, что бактерии со временем выработали устойчивость к основной массе таких препаратов.
Все это побудило ВОЗ после проведенных масштабных исследований с 2014 года рассматривать проблему антимикробной резистентности на глобальном уровне и рекомендовать мировому научному сообществу приступить к поиску путей ее решения.
У ученых есть много идей, как справиться с проблемой: изучение механизмов возникновения антимикробной резистентности и системный мониторинг ее распространения, совершенствование мер по ограничению распространения и циркуляции возбудителей с антимикробной резистентностью).
Среди них есть и такой метод борьбы — научиться выращивать устойчивые виды бактерий и исследовать химические соединения, с помощью которых резистентность будет преодолена.
Эту задачу, в частности, решают ученые Северо-Восточного университета в Бостоне (США). Им удалось найти ряд соединений, к одному из которых в лабораторных условиях ни одна из исследуемых бактерий не способна была выработать устойчивость.
И если речь идет, например, о создании принципиально нового вида антибиотиков, то необходимо понимать, что на их разработку, прохождение всех этапов исследований и внедрение в массовое производство, по данным экспертов, уходит в среднем 10 лет.
В этой связи ученые также ищут способы решения глобальной проблемы на базе альтернативных антибиотикам противомикробных средств.
Если говорить о нашей стране, то в 2017 году для этих целей была утверждена «Стратегия предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года».
Она предусматривает меры по ограничению распространения устойчивости микроорганизмов к противомикробным препаратам, химическим и биологическим средствам.
В частности, стратегия интегрирует в себя план действий по разработке и внедрению альтернативных методов, технологий, средств профилактики и лечения заболеваний, включая создание биологических лекарственных препаратов на основе бактериофагов.
Вирусы против «супербактерий»
Бактериофаги — это не новый биологический вид. Научное сообщество приступило к их изучению задолго до появления всем известных антибиотиков. Первые научные сообщения о бактериофагах появились еще в 1920-х годах.
В 1921 году Ричард Брайонг и Джозеф Мэйсин, последователи Феликса Д’Эрреля, французского микробиолога и первооткрывателя бактериофагов, сделали доклад об успешном лечении инфекций кожи стафилококковым бактериофагом, а в 1922 году Д’Эррель в своем фундаментальном труде изложил результаты начального этапа изучения бактериофагов. И только в 1929 году Александр Флеминг открыл пенициллин.
Кроме того, в романе американского писателя Синклера Льюиса «Эроусмит» про молодого микробиолога, вышедшего в 1925 году, также говорилось о новом методе лечения: изобретенная ученым сыворотка губительно действовала на бактерии и спасла множество жителей Карибских островов от эпидемии бубонной чумы. По сути, речь шла о фаготерапии.
Что же такое бактериофаги? Они представляют собой внеклеточную форму жизни. Иными словами, это вирусы, размеры которых составляют в среднем от 20 до 200 нанометров (1 нанометр равен одной миллиардной части метра).
Так же, как и бактерии, эти вирусы представляют собой еще одну наиболее распространенную форму жизни на нашей планете. Они присутствуют буквально везде: в океане, почве, глубоководных источниках, питьевой воде, пище.
Причем бактериофаги способны размножаться исключительно в клетке-хозяине. Они могут иметь кубическую, нитевидную или форму головастиков.
Любая фаговая частица состоит из головки, содержащей нуклеиновую кислоту (ДНК или РНК), заключенную в белковую оболочку — капсид, —и хвостового отростка, состоящего из внутреннего стержня и сократительного чехла. Передвигается бактериофаг с помощью ножек-фибрилл, скрепленных в центре базальной пластиной.
Все бактериофаги имеют особенность, которой и пользуются ученые в ходе создания альтернативных антибактериальных препаратов — каждому типу бактерий свойственны собственные вирусы-фаги.
При этом бактериофаги, как снайперы, избирательно поражают только бактериальные клетки, а не всю микрофлору организма, в отличие от антибиотиков.
Происходит этот процесс в несколько этапов. Сначала бактериофаг распознает бактериальную клетку и прикрепляется к ее оболочке. Затем вирус-бактериофаг производит инъекцию своей нуклеиновой кислоты (генома) внутрь бактерии.
Далее происходит биосинтез белковых и нуклеиновых компонентов новых фаговых частиц на основе введенного генома. Еще один этап — соединение компонентов и формирование новых бактериофагов внутри бактерии.
И, наконец, процесс лизиса — распад бактериальной клетки и выход зрелых фагов.
Иными словами, эти неклеточные формы жизни с генетической программой способны проникать практически в любую вредоносную бактериальную клетку, размножиться и разрушить ее, не причиняя вреда остальной микрофлоре организма.
Подобный «литический цикл» продолжается до тех пор, пока не будет уничтожена последняя бактерия.
При неблагоприятных внешних условиях и малом количестве вредоносных клеток бактериофаги развиваются по лизогенному циклу: введенный геном существует внутри клетки пассивно — не размножаясь.
В таком состоянии «зараженная» фаговым геномом бактерия может проходить циклы деления. И когда такая бактерия попадет в благоприятные для размножения вируса условия, вновь активизируется литический цикл развития бактериофагов.
Кроме того, в отличие от антибиотиков, бактериофаги способны приобретать новые признаки естественным образом для борьбы с резистентными мутациями бактериальных клеток.
Отечественные разработки
Если говорить об успехах отечественных ученых в создании альтернативных антимикробных препаратов на основе бактериофагов, то еще благодаря сотрудничеству Феликса Д’Эрреля и грузинского микробиолога Георгия Элиавы в 1920-х годах в СССР был создан первый и единственный в мире научно-исследовательский центр бактериофагологии.
Уже в 1930-х бактериофаги советского производства впервые были использованы в экстренных ситуациях. Например, в 1938 году в нескольких пограничных с СССР районах Афганистана для профилактики эпидемии холеры бактериофаги давали местному населению, добавляли в колодцы и водоемы.
В результате на советской территории не было зарегистрировано ни одного случая заболевания.
Во времена Великой Отечественной войны также применялась фаговая терапия. Особое внимание уделялось разработке и производству бактериофагов, подавляющих кишечные инфекции — холеру, брюшной тиф, дизентерию и сальмонеллез. Всего за годы войны для фронта было изготовлено более 200 тысяч литров бактериофагов.
В наши дни в России разработкой и производством альтернативных лекарственных средств на основе бактериофагов в рамках Стратегии по борьбе с антимикробной резистентностью занимаются ученые НПО «Микроген» холдинга «Нацимбио» (входит в госкорпорацию «Ростех»).
В настоящий момент предприятие приступило к созданию всероссийской базы штаммовой коллекции бактериофагов для выпуска новых лекарственных противомикробных препаратов на их основе.
На сегодняшний день НПО «Микроген» разработаны 19 разновидностей альтернативных лекарственных противомикробных препаратов на основе бактериофагов против дизентерии, брюшного тифа, сальмонеллеза, гнойно-септических и других заболеваний.
В перспективе — выпуск первого в мире лекарственного препарата, содержащего бактериофаги в капсулах для лечения и профилактики заболеваний, вызываемых бактериями рода стафилококков (лат. Staphylococcus), стрептококков (Streptococcus), протеи (Proteus — P. vulgaris, P. mirabilis), клебсиеллы (Klebsiella pneumoniae), синегнойной (Pseudomonas aeruginosa) и кишечной (Escherichia coli) палочек.
Кроме того, в 2018 году предприятие приступило ко второй фазе клинических исследований бактериофага «Дифаг», направленного на борьбу с бактериями рода Acinetobacter baumannii (ацинетобактер) и Pseudomonas aeruginosa (синегнойная палочка), которые наиболее часто вызывают инфекционные заболевания у пациентов хирургических стационаров, отделений реанимации и интенсивной терапии.
Результаты наработок зарубежных и российских ученых по поиску новых антимикробных средств, безусловно, вселяют уверенность в том, что глобальная задача антимикробной резистентности в скором времени может быть решена.
А пока каждый из нас остается участником развернувшейся в XXI веке невидимой глазом битвы между человечеством и «супербактериями».
Александр Райков, специалист технологического отдела АО НПО Микроген Госкорпорации «Ростех»


Warning: Use of undefined constant expert_review_likes - assumed 'expert_review_likes' (this will throw an Error in a future version of PHP) in /var/www/www-ars1963/data/www/ck62.ru/wp-content/themes/colormag/comments.php on line 93