какое обезболивающее можно дать кошке после стерилизации
Парацетамол: польза и вред
Указана минимально возможная цена на товар в городе.
Цены на товар в разных аптеках отличаются.
Указана минимально возможная цена на товар в городе.
Цены на товар в разных аптеках отличаются.
От чего помогает «Парацетамол»?
«Парацетамол» от головной боли: помогает или нет?
Через какое время действует «Парацетамол»?
«Парацетамол»: польза и вред для организма
«Парацетамол» ингибирует синтез простагландинов, воздействуя на болевые и терморегулирующие центры. Существуют предположения о способности вещества блокировать циклооксигеназу, преобладающую в центральной нервной системе, ввиду чего достигается комбинированный эффект.
Терапевтической пользы для организма «Парацетамол» не несет, хотя и способен нейтрализовать боль, лихорадку и другие признаки плохого самочувствия.
«Парацетамол» с большой осторожностью назначают людям, страдающим следующими заболеваниями:
Можно ли использовать «Парацетамол» как обезболивающее?
Что лучше – «Ибупрофен» или «Парацетамол»?
Сколько раз в день можно пить «Парацетамол»?
Максимальная разовая доза составляет 1 грамм препарата (обычно одна таблетка содержит 500 мг действующего вещества). Принимать по 1 грамму можно не более 4 раз в сутки. Детям от 3 месяцев до 1 года нельзя принимать более 120 мг «Парацетамола» в день.
Предельная дневная дозировка для детей от 1 до 5 лет составляет 250 мг, от 6 до 12 лет – 500 мг. Продолжительность лечения не должна превышать 3 дней. В случае с ректальным использованием суппозиториев срок может быть пролонгирован до 5-7 дней.
Чем опасна вакцинация от коронавируса
Что известно о COVID-19?
Это РНК-содержащий вирус животного происхождения, относящийся к группе коронавирусов. Согласно данным ВОЗ, он передается от заболевшего человека через мелкие капли, которые выделяются при чихании и кашле из носа и рта. С момента заражения до появления первых симптомов проходит от 1 до 14 дней (в среднем – 7). Носитель вируса еще не знает о своей болезни, но в плане заражения уже представляет опасность для окружающих. По информации коронавирусной эпидемиологии, COVID-19 в 2-3 раза заразнее гриппа, но в 2-3 раза менее заразен, чем корь.
При легком течении болезни ее симптомы сходны с ОРВИ и заканчиваются выздоровлением через 14 дней без каких-либо дальнейших последствий. В тяжелых случаях COVID продолжается до 8 недель. Даже при отсутствии выраженных признаков заболевания у переболевших формируется иммунитет. Но учитывая, пусть и нечастые случаи повторного заражения, сохраняется он не слишком долго. Гораздо большим эффектом обладает вакцина.
Как действует вакцина?
Сегодня в мире используется несколько иммунопрепаратов, разработанных специалистами разных стран и прошедших необходимые клинические испытания. Все они предназначены для формирования иммунитета к возбудителю. После их введения иммунная система:
У человека, прошедшего вакцинацию, формируется стойкий иммунитет к COVID.
Опасна ли вакцинация?
Каждый человек реагирует на иммунопрепарат индивидуально. Поэтому даже самая качественная вакцина может вызвать побочные эффекты. Их появление на непродолжительное время – единственная опасность.
Чем опасна вакцинация от коронавируса:
Эти неприятные симптомы исчезают в течение нескольких дней.
Тяжелые состояния после введения иммунопрепарата могут развиваться у людей, имеющих противопоказания. Нельзя проводить вакцинацию, если наблюдаются:
При этих патологиях прививка может спровоцировать обострение.
Также противопоказанием является возраст (младше 18 и старше 65 лет), беременность, недавно перенесенная тяжелая форма коронавирусной инфекции. У переболевших людей в первое время после выздоровления отмечается высокий уровень антител, а вакцина повысит его еще больше. Последствия могут проявиться бурной иммунной реакцией в форме цитокинового шторма.
Как уменьшить негативные проявления?
Снизить развитие побочных явлений поможет соблюдение всех рекомендаций врача. Чтобы уменьшить риск развития негативных симптомов после вакцинации, нужно:
При отсутствии противопоказаний и соблюдении всех требований, риск побочных эффектов сводится к минимуму.
После прививки от коронавируса врачи советуют соблюдать щадящий режим и выпивать не менее 1,5 литров жидкости в день. При повышении температуры рекомендуется принять жаропонижающее средство. Если слабость не проходит в течение нескольких дней, появились аллергические реакции, нужно немедленно обратиться к доктору.
Когда будет массовая вакцинация?
Массовая вакцинация в США, Канаде и европейских странах началась еще в декабре прошлого года. В это же время стартовала она и в России. Но на начальном этапе мероприятие проводилось только для определенной категории лиц – молодых людей и тех, кто по роду своей профессиональной деятельности не может ограничить число контактов. Сегодня привиться от ковида можно в любом регионе страны.
Лечение пяточной шпоры
Что же такое пяточные шпоры и откуда они берутся?
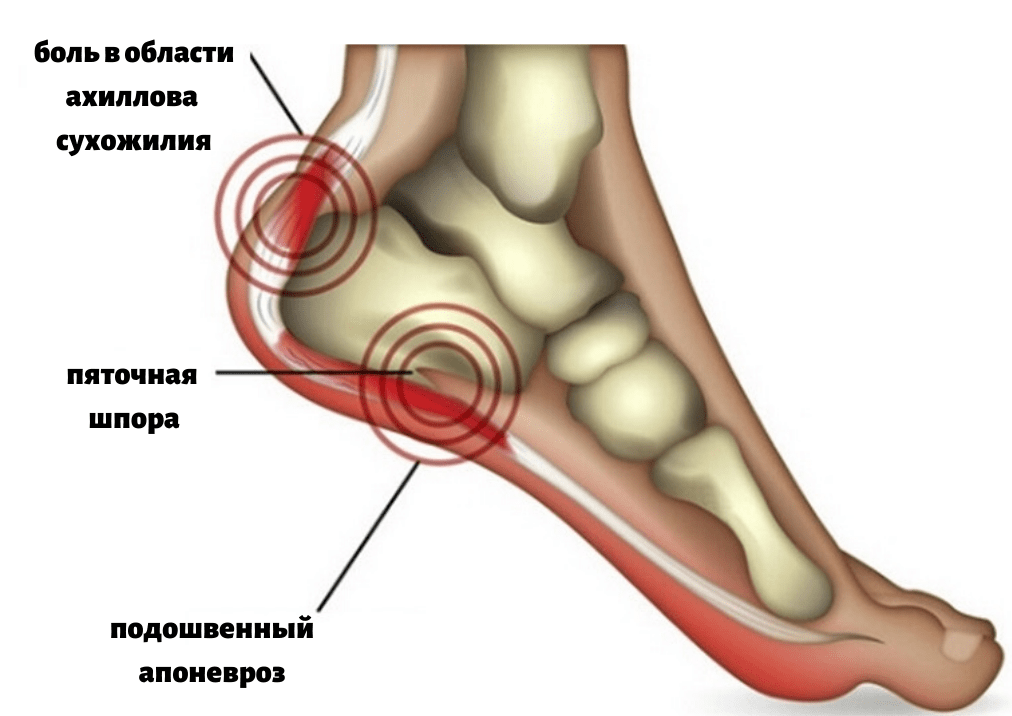
В результате различных процессов (избыточный вес, травма и др.) в данной области возникает хроническая травматизация сухожилия с образованием микронадрывов и постепенное развитие воспалительного процесса. Как компенсаторная реакция на травму и воспалительный процесс начинает образовываться костный вырост, он принимает форму шипа и, передавливая мягкие ткани подошвы стопы, вызывает характерные сильные боли в пяточной области. Самым значимым симптомом пяточной шпоры является сильная боль при ходьбе, особенно в самом начале ходьбы (так называемая, стартовая боль), при вставании со стула, с постели.
Основные причины образования пяточных шпор:
Проявления заболевания
Боли, возникающие при опоре на больную пятку, развиваются постепенно с ростом самой шпоры, характеризуются как жгучие или острые, с ощущением «гвоздя в пятке». Они могут локализоваться на внутренней поверхности больной пятки и переходить на всю стопу. При осмотре пяточной области нет никаких видимых изменений, редко отмечается отечность, болезненность определяется при надавливании на пятку. Интересно, что интенсивность боли не зависит от размера шпоры, что обусловлено, прежде всего, не наличием самой шпоры, а воспалительными изменениями в мягких тканях пятки. Диагноз пяточной шпоры подтверждается рентгенографией.
Основные принципы лечения пяточных шпор
1. Вначале необходимо выяснить причину развития воспалительного процесса в области подошвы и постараться максимально устранить ее. Т.е. выяснить, какой патологический процесс мог привести к избыточной травматизации фасции и возникновению воспаления. С этой же целью следует нормализовать вес, если он избыточный, дозировать физические нагрузки и ношение тяжестей, подобрать удобную, правильную обувь для занятий спортом и для повседневной носки. Снять и отложить в сторону неудобную обувь. На время экспресс-лечения следует ограничить нагрузку на ноги — сократить ходьбу и тем более бег или переноску тяжести насколько это возможно. Лучше носить удобные легкие кроссовки с хорошим супинатором.
2. Необходимо максимально возможное обеспечение физической разгрузки болезненной области, для чего рекомендуется подбор индивидуальных ортопедических стелек с выкладкой внутреннего и наружного продольного сводов, углублением и мягкой прокладкой под пяткой, а также временное ношение подпяточника с углублением или отверстием в центре. Как временную меру при лечении пяточной шпоры можно рекомендовать ношение обуви без задника;
3. Консервативное лечение направленно на ликвидацию воспалительного процесса и включает местное применение нестероидных противовоспалительных препаратов (гели и мази), обладающих противовоспалительным и рассасывающим эффектом. Но эти методы, как правило, приносят лишь только временный эффект, их обязательно нужно сочетать в комплексе с другими методами.
4. Наружное применение мазей при пяточной шпоре лучше сочетать с массажем стоп. Массаж при пяточной шпоре удобно делать самостоятельно.
5. В комплекс лечения пяточной шпоры включают теплые ванны с морской солью, содой. Ванночки необходимо делать перед применением мазей и массажа.
6. Определенные упражнения лечебной гимнастики с проведением массажа мышц стопы и голени — рекомендуются для улучшения кровоснабжения тканей стопы, с этой же целью можно проводить тепловые процедуры парафино- или озокеритотерапии.
7. В некоторых случаях (если развитие пяточной шпоры происходит на фоне артроза) в комплексной терапии рекомендуют прием хондропротекторов с анальгетическим и противовоспалительным эффектом, что останавливает прогрессивный воспалительный процесс, но эффект от внутреннего применения препаратов развивается только через 6 недель от начала лечения и сохраняется в течение 2–3 мес. после его отмены.
8. Методы медикаментозного лечения пяточной шпоры.
Официальная медицина на сегодняшний день разработала большое количество схем фармакологической терапии данного заболевания. Среди препаратов, применяемых для лечения пяточной шпоры: нестероидные противовоспалительные средства, гели, мази, кремы и пластыри для лечения пяточной шпоры местного применения, обладающие рассасывающим и противовоспалительным эффектом.
При малой эффективности консервативного лечения выполняются лекарственная блокада пяточной шпоры — обкалывание болезненного места шприцом с лекарственным веществом. Например, стойким эффектом обладает однократное местное введение дипроспана.
Препараты, применяемые с этой целью, оказывают выраженный местный противовоспалительный эффект, что быстро подавляет воспалительный процесс и снижает болевой синдром.
Данная процедура требует знаний и большого опыта, поэтому проводить ее может только квалифицированный специалист. Однако при частом использовании метода возможно разрушение связки или фасции.
9. К хирургическому лечению прибегают крайне редко, так как встречается много недостатков при данной методике. При проведении операции удаляют пяточную шпору. После чего конечность фиксируют гипсовой повязкой примерно на один месяц.
После снятия гипса назначают ортопедические стельки и проводят курсы восстановительного лечения. Помните, что в большинстве случаев пяточные шпоры вполне поддаются терапии и без операций.
10. Любой метод лечения необходимо сочетать с физиотерапевтическими воздействиями.
Ударно-волновая терапия пяточной шпоры
Является наиболее эффективным методом: терапия воздействует непосредственно на костные разрастания и способствует их уменьшению или даже рассасыванию. Ударно-волновая терапия — относительно новый метод лечения.
В нашей стране данная процедура начала практиковаться не очень давно, но первые результаты уже обнадеживают.
Имеющийся опыт позволяет утверждать, что при использовании данного метода лечения эффективность лечения пяточной шпоры очень высока. Метод основан на воздействии импульсов ударных волн определенной частоты. Эффект ударной волны разрыхляет отложения кальция в пяточной шпоре.
Это позволяет в дальнейшем вымывать разрыхленные отложения из организма с кровотоком. Пораженная связка избавляется таким образом от накопленных солей кальция.
Кроме того, при этом активизируются процессы регенерации тканей, уменьшаются отечность и воспалительные явления. С каждой проведенной процедурой болевой синдром становится все меньше и, как правило, значительно уменьшается или исчезает к концу лечения.
Пораженный участок во многом восстанавливает свою естественную структуру и возвращает себе способность переносить каждодневные нагрузки, не вызывая болезненных ощущений.
На начальных стадиях заболевания лечение требует небольшого количества процедур от 3 до 5 на курс, а при большой длительности процесса длительность лечения до 5-10 процедур на курс. Между сеансами обязателен перерыв 5-7 дней.
Продолжительность одного сеанса составляет 15-20 минут на одно поле. На кожу пятки наносят специальный гель, воздействие осуществляется с помощью излучателя.
Существуют противопоказаниями к лечению пяточной шпоры: нарушения свертываемости крови и тромбофлебит, злокачественные новообразования, беременность.
Нежелательно проведение процедур ударно-волновой терапии в течение месяца после введения в область пятки гормональных противовоспалительных препаратов.
Лучевая терапия (рентгенотерапия) пяточной шпоры
Использование рентгеновского излучения в лечении пяточной шпоры показывает весьма эффективные результаты. Метод заключается в том, что на область пятки направляются четко сфокусированные рентгеновские лучи, несущие пониженную дозу радиации.
Они вызывают блокирование нервных окончаний, и пациент перестает испытывать болевые ощущения.
Курс лечения чаще всего состоит из десяти сеансов, каждый из которых имеет продолжительность в 10 минут.
Рентгенотерапия в лечении пяточной шпоры обладает следующими преимуществами: полная безболезненность процедуры, высокая эффективность, минимум противопоказаний, воздействие излучения только на пяточную шпору, противоаллергическое и противовоспалительное действие, возможность амбулаторного лечения.
Противопоказанием к использованию данного метода является только беременность.
При применении рентгенотерапии сама шпора не исчезает, блокируются только болевые ощущения, исходящие от нее. Поэтому после проведения курса рентгенотерапии необходимо обязательной позаботиться о разгрузке стопы.
Лазерное лечение пяточной шпоры
В настоящее время низкоинтенсивная лазерная терапия — популярный и достаточно широко используемый метод лечения данного заболевания. Лазерная терапия воздействует на мягкие ткани, находящиеся вокруг шпоры.
Сфокусированное излучение вызывает увеличение кровообращения в области воспаления, что способствует уменьшению болей.
Среди пациентов бытует мнение о том, что лазерная терапия способна устранять саму пяточную шпору. Однако это является заблуждением. Проникая в ткани стопы, низкоинтенсивный лазерный луч на сам костный нарост не оказывает практически никакого действия.
Его эффект проявляется только на мягких тканях. А значит, после проведения курсов лазерной терапии также необходимо применять все методы, направленные на профилактику данного заболевания.
УВЧ-СВЧ-терапия
Этот метод заключается в применении переменного электромагнитного поля ультравысокой и сверхвысокой частоты. Влияние этих токов приводит к расширению капилляров в мягких тканях и к значительному усилению кровообращения. При этом уменьшается болевой синдром и воспаление.
Длительность одного сеанса составляет 10-15 минут. Для лечения пяточной шпоры требуется около 10-12 сеансов терапии.
Чаще врачи назначают пациентам переменное магнитное поле. Образуются слабые токи в крови и лимфе, которые влияют на метаболизм, а также на структуру воды и белков. Повышается сосудистая и кожная проницаемость, рассасываются отеки, уменьшается воспаление.
Данная методика позволяет достичь те же результаты, что и УВЧ-терапия.
Лечить шпоры на пятке можно и с помощью электрофореза или СМТ-ДДТ-фореза
Электрический ток повышает ионную активность в проводящих тканях, при этом увеличивается синтез многих биологически активных веществ. Лечебное действие обусловлено поступлением ионов лекарственных веществ (именно в ионной форме вещества наиболее активны), а также формированием кожного депо, из которого ионы постепенно поступают в ткани в последующие дни.
При электрофорезе используют специальные прокладки, пропитанные лекарством. Прокладки располагают между кожей пятки и пластинами электродов. Для лечения пяточной шпоры используют йодистый калий, гидрокортизон, новокаин и прочие препараты.
Эффективность таких методов физиолечения, как ультразвука и фонофореза (сочетанное применение ультразвука и лекарственного препарата) при пяточных шпорах составляет более 30%.
Основной эффект физиотерапии ультразвуком при лечении пяточной шпоры заключается в устранении воспалительного процесса, учитывая, что лучше всего ультразвук поглощается костной тканью.
При этом не следует бояться, что ультразвуковое лечение будет влиять на здоровую костную ткань пятки. Проведенные исследования низкочастотным ультразвуком показали, что разрушений костных тканей не вызывалось, но локальное применение ультразвуковых волн на область шпоры способствовало снижению содержания в ней кальция с замещением волокнистой соединительной тканью.
Также ультразвук оказывает рассасывающее и спазмолитическое действие, улучшая процессы локальной микроциркуляции.
Эффект от ультразвукового лечения усиливается сочетанным применением противовоспалительных мазевых препаратов. Озвучивание низкочастотным ультразвуком повышает проницаемость клеточных мембран, улучшает проницаемость и введение лекарственных веществ.
Наиболее часто применяют гидрокортизоновую мазь. Фонофорез способствует более глубокому проникновению лекарственного вещества в пораженную область, нежели применять мазь как самостоятельное средство лечения.
Метод фонофореза основан на свойстве ультразвука изменять проницаемость кожных покровов, в связи с чем лекарства, нанесенные на кожу, всасываются более активно.
Продолжительность самой процедуры — до 10 минут. На курс лечения может понадобится 5-10 процедур, с возможными повторными курсами.
Профилактика пяточной шпоры
Профилактические меры должны быть направлены, в первую очередь, на предупреждение преждевременного износа, старения и травм костно-суставного аппарата:
Послеоперационное обезболивание. Часть 4. Современные средства обеспечения послеоперационной анальгезии
Основными задачами применения анальгетических средств в послеоперационном периоде являются: устранение страдания, причиняемого болью, создание психологического комфорта и повышение качества жизни пациентов в послеоперационном периоде; ускорение послеоперационной функциональной реабилитации; снижение частоты послеоперационных осложнений; сокращение сроков госпитализации и стоимости лечения.
Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека и осуществляется в соответствии с принятыми национальными и международными стандартами. В нашей стране во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 1).
Таблица 1. Препараты, применение которых для послеоперационного обезболивания обосновано данными доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005).
Группа
Препараты
Дозы, путь введения
Неопиоидные анальгетики, НПВП
Диклофенак
Кетопрофен (Кетонал ®)
Кеторолак (Кеторол ®)
75 мг (150 мг суточная), в/м
50 мг (200 мг), в/м
30 мг (90 мг), в/м
Неопиоидные анальгетики, прочие
1 г (4 г), в/в инфузия в течение 15 минут
Опиоидные анальгетики, сильные
5-10 мг (50 мг), в/в, в/м
20 мг (160 мг), в/в, в/м
Опиоидные анальгетики, слабые
100 мг (400 мг), в/в, в/м
Лидокаин 2%
Бупивакаин (Маркаин®) 0, 25%, 0, 5%
Ропивакаин (Наропин®0, 2%, 0, 75%, 1%
(800 мг суточная) *
(400 мг суточная) *
(670 мг суточная) *
*инфильтрация краев раны, интраплевральное введение, продленная блокада периферических нервов и сплетений, продленная эпидуральная анальгезия.
Мировой опыт послеоперационного обезболивания позволяет выделить следующие основные современные тенденции в борьбе с ПБС:
— широкое применение неопиоидных анальгетиков – нестероидных противовоспалительных препаратов (НПВП) и парацетамола; в различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания составляет от 45 до 99%;
— ограничение использования опиоидных анальгетиков, особенно внутримышечного варианта их введения, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики;
— мультимодальный характер послеоперационного обезболивания, т. е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома.
Длительность проведения послеоперационного обезболивания является достаточно вариабельной величиной и зависит как от интенсивности болевой афферентации и, следовательно, от травматичности хирургического вмешателсьтва, так и от индивидуальной толерантности пациента к боли. Необходимость целенаправленного купирования ПБС возникает, как правило, в течение первых 4 суток послеоперационного периода (табл. 2).
Таблица 2. Потребность в обезболивании после различных по объему операций.
Хирургическое вмешательство
Продолжительность обезболивания, часы
Вмешательства на верхнем этаже брюшной полости и диафрагме
Вмешательства на нижнем этаже брюшной полости
Операции на тазобедренном суставе
Операции на конечностях
Лапароскопические операции среднего объема
Таблица 3. Методы и средства послеоперационного обезболивания.
1. Традиционное введение опиоидов: внутримышечные инъекции по требованию.
2. Опиоидные препараты агонисты/антагонисты:
а) парентеральное введение опиоидов: внутривенно болюсно, длительная внутривенная инфузия, контролируемая пациентом анальгезия.
б) непарентеральное введение опиоидов: щечное/подъязычное, пероральное, трансдермальное, назальное, ингаляционное, внутрисуставное
3. Неопиоидные анальгетики с системным введением:
а) нестероидные противоспалительные препараты
б) ацетаминофен (парацетамол)
4. Методы регионарной анестезии:
а) эпидуральное введение опиоидов;
б) нестероидные противовоспалительные препараты;
5. Нефармакологические методы:
6. Сочетанное использование представленных методов
Ниже приводятся основные используемые в современной хирургической клинике средства и методы обезболивания с позиций баланса их эффективности и безопасности.
Опиоидные анальгетики.
Данная группа лекарственных препаратов десятилетиями считалась средством выбора для купирования ПБС. Однако в настоящее время опиоидные анальгетики отнюдь не являются «золотым стандартом» в лечени пациентов с острой болью. Тем не менее, по оценкам целого ряда отечественных и зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%. Однако постепенное отчуждение от чрезмерной приверженности опиоидам в послеоперационном периоде связана не столько с их недостаточной эффективностью, сколько с целым рядом серьезных побочных эффектов, возникающих при их использовании (табл. 4).
С точки зрения фармакодинамики опиоидные анальгетики являются агонистами или антагонистами различных видов опиоидных рецепторов ЦНС (мю-, дельта-, каппа-). Препараты опиоидной группы активируют эндогенную антиноцицептивную систему (центральная анальгезия), однако не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гиперальгезию. Попытки увеличения эффективности обезболивания и снижения частоты побочных эффектов опиоидных анальгетиков основаны на варьировании способов их введения (в том числе и у одного пациента): внутривенный, внутримышечный, эпидуральный, трансдермальный, сублингвальный, ректальный. Наиболее распространенным, но при этом наиболее небезопасным и наименее эффективным способом введения опиоидов является внутримышечная инъекция. Данная методика наиболее часто приводит к неадекватному обезболиванию – более 60% пациентов отмечают неудовлетворительное качество послеоперационной анальгезии. Причины этого кроются в том, что всем пациентам вводятся фиксированные дозы через стандартные временные интервалы, без учета индивидуальной вариабельности фармакокинетики; часто инъекции опиоидов производятся с большими перерывами, то есть тогда, когда болевой синдром уже выражен и его купирование по определению становится малоэффективным. Именно при внутримышечном введении опиоидов наиболее часто развивается депрессия дыхания, связанная, возможно, с кумуляцией препарата.
Таблица 4. Опиоидные анальгетики при купировании послеоперационного болевого синдрома.
Препарат
Дозировка и пути введения
Относительная анальгетическая активность
Побочные эффекты
Возможны выраженные угнетение дыхания, тошнота, рвота, высокая степень привыкания и максимальный наркогенный потенциал
Угнетение дыхания, тошнота, рвота, высокая степень привыкания и наркогенный потенциал
Угнетение дыхания, тошнота, рвота, наличие привыкания и наркогенного потенциала
Необходимо отметить еще один важный аспект, ограничивающий применение опиоидных анальгетиков в отечественной клинической практике. Использование опиоидных анальгетиков для послеоперационного обезболивания в Российской Федерации строго регламентировано существующими приказами руководящих органов здравоозранения. Например, приказом № 257 Департамента здравоохранения г. Москвы от 2004 г. определяется, в частности, норматив потребления опиоидных препаратов в ампулах на 1 койку различных отделений хирургического профиля в год. Назначение опиоидного препарата как в хирургическом отделении, так и в отделении интенсивной терапии в большинстве ЛПУ сопровождается колоссальным количеством формальных сложностей, что нередко приводит к отказу медперсонала от использования ланных препаратов даже при необходимости назначения опиоидов. По тем же причинам самый современный метод применения опиоидов – контролируемая пациентом аналгезия, в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании – в России не получила широкого распространения.
Неопиоидные анальгетики.
Термином «неопиоидные анальгетики» обозначается группа различных по химическому строению, фармакодинамике и, соответственно, механизму обезболивания лекарственных препаратов, применяемых для купирования ПБС с парентеральным, реже пероральным путем введения. Препараты данной группы, используемые как в моноварианте, так и в качестве средства адъювантной терапии, обладают различными анальгетическим потенциалом и совокупностью побочных эффектов (табл. 5).
Таблица 5. Неопиоидные анальгетики для купирования послеоперационной боли.
Класс
Препараты
Особенности терапии
Побочные эффекты
Антагонисты NMDA-рецепторов
Применяется как адъювант при введении опиоидов.
Малые дозы кетамина характеризуются опиоидсберегающим эффектом, повышением качества обезболивания
При использовании в малых дозах – не выражены. Сохраняют побочные эффекты опиоидов.
Антиконвульсанты
Используется как адъювантный препарат в комплексной терапии острой послеоперационной боли. Снижает потребность как в опиоидных, так и внеопиоидных анальгетиках.
Головокружение, сонливость, периферические отеки.
Ингибиторы протеаз
Ингибирование синтеза медиаторов боли на этапе трансдукции, используются как средство адъювантной терапии ПБС
Нерушения в системе гемостаза (гипокоагуляция) – послеоперационные кровотечения.
Центральные α-адреномиметики
Воздействие на трансмиссию и модуляцию боли. Адъювант при опиоидной анальгезии.
Гипотензия, брадикардия, психические нарушения.
Бензодиазепины
Комбинированная терапия с применением феназепама и тизанидина снижает выраженность фантомных болей.
Сонливость, головокружение, психические расстройства
Из приведенных данных становится очевидным, что перечисленные в таблице неопиоидные анальгетики используются лишь как возможное дополнение к базисной терапии опиоидами, использование данных препаратов для купирования ПБС в моноварианте не практикуется.
Формально к группе неопиоидных анальгетиков относятся также нестероидные противовоспалительные препараты (НПВП) и ацетаминофен (парацетамол). Однако вследствие значительной востребованности в современной хирургической клинике данные препараты рассматриваются сейчас как отдельные подклассы средств для купирования ПБС.
Парацетамол.
Несмотря на то, что ацетаминофен (парацетамол) имеет более чем полувековую историю применения в качестве анальгетика и антипиретика, точный механизм действия этого препарата до сих пор не известен. Предполагается наличие центрального механизма действия парацетамола, включающего: подавление активности циклооксигеназы 2 типа в ЦНС, с чем связана профилактика развития вторичной гиперальгезии; подавление активности циклооксигеназы 3 типа, существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу; усиление активности нисходящих тормозных серотонинергических путей на этапе модуляции боли.
Потенциально опасным побочным свойством парацетамола является гепатотоксическое и нефротоксическое действие, которое может проявляться при превышении дозы 4 г/сут, особенно при наличии у пациента исходного нарушения функции печени и почек. Ограничениями к применению парацетамола являются: печеночно-клеточная недостаточность с лабораторными проявлениями (повышение уровня трансаминаз), почечная недостаточность, алкоголизм, алиментарная недостаточность, дегидратация.
Местные анестетики.
Важнейшей задачей мультимодальной анальгезии является прерывание афферентного потока ноцицептивных стимулов от периферических болевых рецепторов в органах и тканях к сегментарным структурам ЦНС (задним рогам спинного мозга). Эта задача может быть успешно решена при помощи различных методов регионарной и местной анальгезии. Важную роль в расширении применения методов региональной анальгезии сыграло появление современных местных анестетиков (бупивокаин, ропивокаин), а также детальная отработка методики регионарных блокад.
Эпидуральная анальгезия занимает ключевую позицию среди всех регионарных методов послеоперационного обезболивания. В ходе данной процедуры в эпидуральное пространство на уровне грудного или поясничного отделов позвоночника устанавливается катетер, через который болюсно или путем непрерывной инфузии вводятся местные анестетики. Эпидуральная анестезия является как средством обеспечения анальгезии в ходе операции (в том числе и в моноварианте), так и средством купирования ПБС. Многочисленными исследованиями была доказана принципиально более высокая эффективность продленной послеоперационной эпидуральной анальгезии по сравнению с системным введением опиоидных анальгетиков. Как указывалось выше сами опиоидные анальгетики также могут быть использованы для проведения эпидуральной анестезии. Известно, что эпидуральное введение местных анестетиков и опиоидов достоверно превышает анальгетический эффект использования данных препаратов в отдельности. Тем не менее само по себе эпидуральное введение опиоидов чревато возникновением серьезных побочных эффектов от угнетения дыхания до выраженного кожного зуда. На сегодняшний день принято считать, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений самой методики эпидуральной анестезии по сравнению с парентеральным назначением аналогичных препаратов.
Помимо собственно анальгетического эффекта позитивное влияние прослеоперационной продленной эпидуральной анальгезии заключается в прерывании нисходящих симпатических эфферентных импульсов, следствием чего являются улучшение висцерального кровотока (активизация репаративных процессов в зоне вмешательства), повышение активности парасимпатической нервной системы (разрешение пареза пищеварительной трубки).
С точки зрения доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005) преимущества продленной эпидуралной анальгезии включают: более высокое качество обезболивания в сравнении с парентеральным введением опиоидов; улучшение показателей газообмена и снижение частоты послеоперационных легочных осложнений по сравнению с опиоидной анальгезией; ускорение восстановления функции желудочно-кишечного тракта после абдоминальных операций и снижение частоты местных осложнений.
Тем не менее и у эпидуральной анестезии есть ряд существенных ограничений. Сама по себе эпидуральная анестезия является сложной инвазивной процедурой, потенциально опасной в плане развития как местных (инфекционный процесс, повреждение нервных корешков, сосудов паутинной оболочки, твердой мозговой оболочки), так и системных осложнений (депрессия дыхания, кардиотоксические эффекты, артериальная гипотензия). В этой связи проведение эпидуральной анестезии требует наличия специальных навыков у врача-анестезиолога и постоянного мониторинга состояния пациента в отделении интенсивной терапии, реже – в хирургическом отделении.
В последние годы все большую популярность получает методика длительной инфузии местных анестетиков в полость операционной раны. В ходе ряда исследований было показано, что длительная инфузия местных анестетиков в течение 24-48 часов через катетер, установленный в ране, способна повысить качество обезболивания и снизить потребность в опиоидных анальгетиках. Работами отечественных авторов показано, что пролонгированная местная анестезия операционной раны за счет резорбции местного анестетика и присутствия его в плазме в низких концентрациях способна оказывать системный противовоспалительный эффект. Как и в случае эпидуральной анальгезии эффект местных анестетиков при этом обусловлен блокадой не только ноцицептивных путей, но и симпатической иннервации. Говоря о применении пролонгированной местной анестезии операционной раны, следует заметить, что данная методика в настоящее время находится на стадии клинической апробации и ее широкое внедрение изначально ограничивают очевидный риск экзогенного инфицирования раны и реальная опасность системных токсических эффектов местных анестетиков (артериальная гипотензия, аритмии, угнетение дыхания) вследствие их резорбции тканями.
Мультимодальная периоперационная анальгезия.
Из приведенных выше характеристик и, что важнее, недостатков средств и методов купирования ПБС следует очевидное заключение о том, что в настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. Однако приблизиться к решению проблемы адекватности послеоперационного обезболивания вполне возможно, реализуя в клинике концепцию мультимодальной периоперационной анальгезии, предусматривающей одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимизации побочных эффектов до, во время и после хирургического вмешательства (см. рис. ).
Таблица 6. Варианты схем мультимодальной периоперационной анальгезии, ориентированных на травматичность хирургических вмешательств.