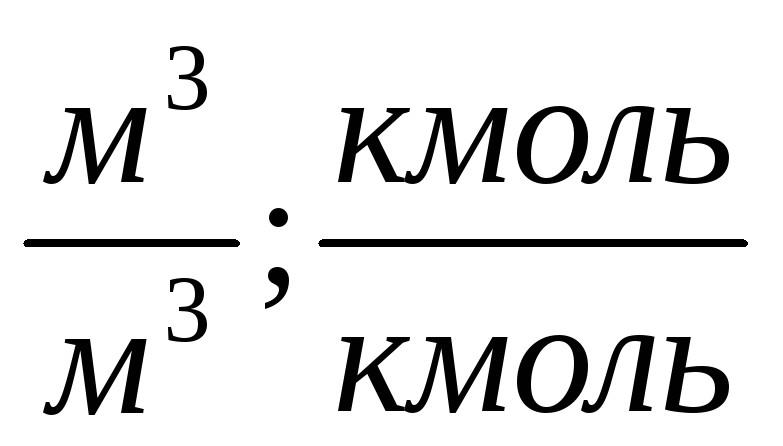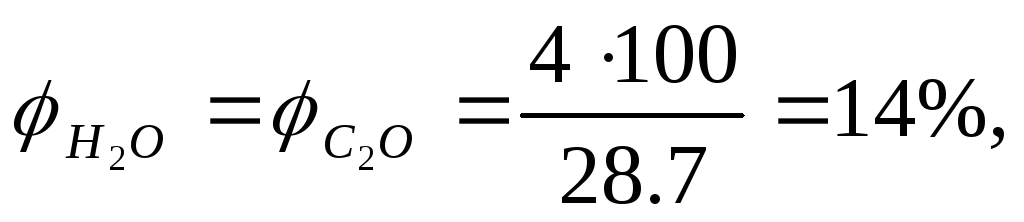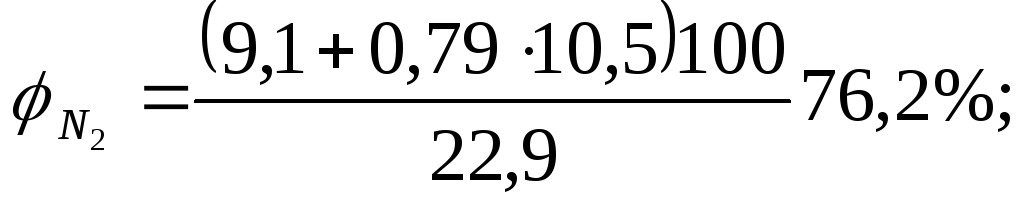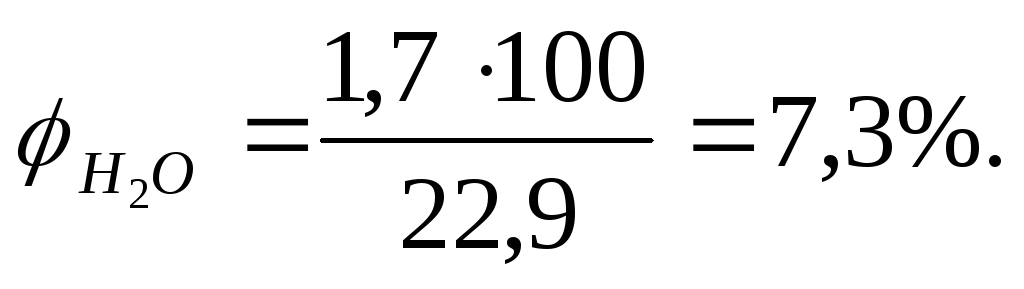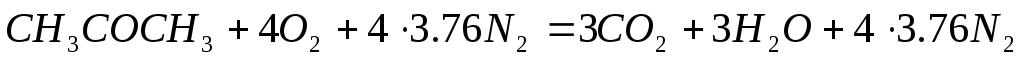какое количество продуктов горения выделится при сгорании 1 кг нитробензола
Определение объема газообразных продуктов сгорания химического топлива
Определение объема продуктов горения химического топлива
Задача 1.
Определить объем продуктов горения 1 кг обычного топлива.
Решение:
Реакция горения обычного топлива проходит по реакции:
Один моль ацетилена равен 26 г/моль.
Отсюда 1 кг ацетилена равен 38,46 молям (1000г/26г/моль = 38,46).
Из химической реакции горения вытекает, что при сгорании 1 моль ацетилена и 2 моль HNO3 выделяется 2 моль углекислого газа, 2 моль воды и 1 моль азота, при сгорании 38,46 моль ацетилена выделяется соответственно:
Для газообразных веществ 1 моль соответствует 22,4 л, отсюда следует:
V(продуктов реакции) = 22,4 . (76,92 + 76,92) = 3446 (л).
Ответ: V(продуктов реакции) = 3446 (л).
Удельный объем газообразных продуктов сгорания химического топлива
Задача 2.
Определить удельный объем газообразных продуктов сгорания химического топлива.
Решение:
n(C2H2) = 26 г/моль;
M(HNO3) = 63 г/моль.
Реакция горения химического топлива имеет вид:
Все продукты сгорания химического топлива газы, поэтому общее количество газов равно 5 моль
(2 моль СО2 + 2 Моль Н2О + 1 моль N2 = 5 моль). С учетом того, что 1 моль любого газообразного вещества занимает объем 22,4 л рассчитаем удельный объем газообразных продуктов, получим:
Ответ: Vудел. = 736,8 (л/кг).
Теория горения и взрыва
Расчет коэффициента горючести нитробензола С6Н5NО2 и сероуглерода CS2. Уравнение реакции горения пропилацетата в воздухе. Расчет объема воздуха и продуктов горения при сгорании горючего газа. Определение температуры вспышки толуола по формуле В. Блинова.
| Рубрика | Химия |
| Вид | контрольная работа |
| Язык | русский |
| Дата добавления | 08.04.2017 |
| Размер файла | 204,4 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
ФГБОУ ВО ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСИЙ УНИВЕРСИТЕТ (ПЕНЗГТУ)
ФАКУЛЬТЕТ БИОМЕДИЦИНСКИХ И ПИЩЕВЫХ
ТЕХНОЛОГИЙ И СИСТЕМ
КАФЕДРА «БИОТЕХНОЛОГИИ И ТЕХНОСФЕРНАЯ БЕЗОПАСНОСТЬ»
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА
ДИСЦИПЛИНА: «ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА»
Выполнила: студентка группы 14ЗТ1бп
Проверил: доцент кафедры БТБ
Задания на контрольную работу
Рассчитать коэффициент горючести нитробензола С6Н5NО2 и сероуглерода CS2.
Для расчета коэффициента горючести можно использовать сле- дующую формулу:
В молекуле сероуглерода содержится атомов:
углерода n(C) = 1; серы n(O)=2
Подставляем количество атомов в формулу:
реакция горение толуол газ
Составляем уравнение реакции горения пропилацетата в воздухе:
С5Н10О2 + 6,5 (О2 + 3,76 N2) = 5CО2 + 5Н2О + 6,53,76 N2
Объём воздуха, необходимый для сгорания 1 кг пропилацетата рассчитываем по формуле:
Где Мгв= 5•12+1•10+2•16=102 кг/кмоль
учитывая при этом, что масса одного киломоля пропилацетата составляет 102 кг/кмоль. Так как горение происходит при заданных условиях, для определения объема, который занимает 1 кмоль воспользуемся уравнением идеальных газов:
Действительный объём воздуха, необходимый для сгорания 1 кг пропилацетата рассчитывается с учётом коэффициента избытка воздуха :
Избыток воздуха составит:
Теоретический объём продуктов горения рассчитываем по формуле:
Действительный объём продуктов горения составит:
Объём воздуха практически необходимого для сгорания 10 кг пропилацетата составит соответственно 70,7 м3 (7,07 10), при этом выделится 7,87 м3 продуктов сгорания.
Рассчитываем процентный состав продуктов сгорания.В этом случае по уравнению реакции определяем объем СО2, Н2О и N2.
Объемная концентрацию каждого компонента смеси рассчитываем следующим образом:
Рассчитать объём воздуха и продуктов горения при сгорании горючего газа (табл. 3) объёма V при заданных условиях (табл. 3), если горение происходит при избытке воздуха б.
Сгорает индивидуальное горючее вещество, находящееся в газообразном состоянии.
Запишем уравнение реакции горения пропана в воздухе:
1CH4 + 2(О2 + 3,76N2) = CО2 + 2 Н2О + 3,76•2 N2
Из уравнения находим в = 2. Рассчитаем теоретические объёмы воздуха и продуктов горения индивидуального горючего вещества в газообразном состоянии в расчёте на 1 м3 горючего вещества в нормальных условиях:
Объем воздуха при Т=303 К
Рассчитываем действительный объем воздуха, расходованный на горение с коэффициентом избытка воздуха:
Объем продуктов горения при нормальных условиях
Объем продуктов горения при 303 K
= 12,42Ч303 = 13,78 м3/м3.
Находим действительный объем продуктов горения с учетом избытка воздуха
=13,78 + 10,46•(1,4-1)=17,96 м3/м3
Составим для всех горючих компонентов смеси уравнения реакций
2CО + 1(O2 + 3,76N2) = 2CO2 + 3,76N2
C2H4 + 3(O2 + 3,76N2) = 2CO2 + 2H2O + 3?3,76N2
C2Н2 + 2,5(O2 + 3,76N2) = 2CO2 + Н2О+2,5?3,76N2
Рассчитаем теоретический объём продуктов горения по формуле
Рассчитаем действительный объём продуктов горения с учётом избытка воздуха
Рассчитаем состав продуктов горения.
Учитывая, что горение протекает с избытком воздуха, то при расчёте количества молей продуктов горения учитывается избыточное число молей кислорода и азота ( и ):
Вычислить температуру горения керосина, процентного состава: С-80%, Н-13,7%, О-0,3%, W-6%, если горение протекает при коэффициенте избытка воздуха б=1,3 а доля потерь тепла излучением составляет 40%.
Решение. Рассчитаем низшую теплоту сгорания горючего вещества, используя формулу Д. И. Менделеева:
Рассчитаем объёмы продуктов горения при полном сгорании 1 кг горючего вещества сложного состава
Рассчитаем избыточный объём воздуха при полном сгорании 1 кг горючего Вещества:
Рассчитаем температуру горения и, т.к. в условии задачи ничего не сказано о начальной температуре горения, будем считать, что горение протекает при нормальных условиях:
Ответ: действительная температура горения вещества сложного состава составила 1075 К.
Рассчитать температуру вспышки толуола (0.т.) С6Н14 по формуле В.И. Блинова. Сравнить найденное значение с экспериментальным, взятым из справочника.
Решение. Формула Блинова имеет вид:
Уравнение реакции горения толуола в воздухе:
C6H5CH3 + 9(O2+3,76*N2) = 7CO2 + 4H2O+9*3,76N2
где n=9 температура вспышки в открытом тигле А = 45,3 (КЧПа.м2)/с;
Если коэффициент диффузии пара в воздух неизвестен, то его можно вычислить по эмпирической формуле (см2 /с):
Подставляем данные в формулу:
Найдем такую температуру, при которой произведение Т*Р=1775,5.
Воспользуемся зависимостью насыщенного пара от температуры жидкости.
Вычислить температуру самовоспламенения 2,4-диметил-3-этилпентанола
В молекуле 5 концевых групп: 4 метильных (-СН3) и одна гидроксильная (-ОН), т.е.
Мр = 5. Тогда число цепей:
Составим таблицу, в которую внесем цепи и их длину:
Категории и разделы
Техническая часть
Информация о нашем сайте
Вопросы по школьной программе
7 класс
Вопросы по учебной программе 7 класса
8 класс
Вопросы по школьной программе 8 класса
9 класс
Вопросы по школьной программе 9 класса
10 класс
Вопросы по школьной программе 10 класса
Старшая школа. 11-12 классы
Вопросы по школьной программе 11-12 классов
Курсы Beyond School
Подготовка к олимпиадам: Общий раздел
Сборная Казахстана
Все что связано с сборной РК
Успехи учеников
Все о достижениях учеников Пагодана
Учебно-тренировочные сборы
Олимпиады на Pagodane
Магазин Pagodane (1 077 переходов по ссылке)
Подготовка к олимпиадам: Младшая лига (7-9 классы)
Неорганическая химия
Органическая химия
Органическая химия на уровне 9 класса
Решение задач
Областные олимпиады
Обсуждение областных олимпиад за 9 класс
Республиканские олимпиады
Обсуждение республиканских олимпиад за 9 класс
Практическая часть
Обсуждение практических работ для 9 класса
Подготовка к олимпиадам: Старшая лига (10-12 классы)
Общая и неорганическая химия
Углубление в неорганику
Органическая химия
Изучение истинной органики
Физическая химия
Пересечение физики и химии
Аналитическая химия
Биохимия
Пересечение двух прекрасных наук
Решение задач
Областные олимпиады
Обсуждение областных олимпиад за 10-11 классы
Республиканские олимпиады
Обсуждение республиканских олимпиад за 10-11 классы
Международные олимпиады
Обсуждение международных олимпиад
Практическая часть
Обсуждение практических работ в 10-11 классах
Свободное время
Общение
Раздел, который видят только ученики
Котоламповые вечера
Расширяем горизонты познаний
Лучшие авторы
Никто не получал репутацию за неделю
Объявления
Сейчас в сети (Полный список)
Нет пользователей в сети в данный момент.
Легенда Групп
Дни рождения сегодня
Статистика форума
Статистика пользователей
Топ награжденных
Никто не был награжден за этот период
Архив Ученик месяца
На данный момент еще никто не был выбран учеником этого месяца
Читайте также
В этом разделе не ставится цель описать развитие всех органов человека. Будут рассмотрены лишь некоторые морфогенетические процессы, иллюстрирующие следующие общебиологические моменты: 1) значение межклеточных, тканевых и межорганных взаимодействий в морфогенезе; 2). [читать подробнее].
В языке Basic процедуры и функции объединяются под общим названием подпрограммы. Для создания процедуры в программе надо ввести в окне редактирования кода заголовок Sub ИМЯ_ПРОЦЕДУРЫ, появится пустой шаблон процедуры: Sub ИМЯ_ПРОЦЕДУРЫ End Sub В пространство между именем и. [читать подробнее].
1. Построим схему, содержащую 4 переключателя x, y, z и t, такую, чтобы она проводила ток тогда и только тогда, когда замкнут контакт переключателя t и какой-нибудь из остальных трёх контактов. Решение. В этом случае можно обойтись без построения таблицы истинности. Очевидно. [читать подробнее].
1. Больница (сведения о лечении больных в стационарном отделении). База данных должна состоять из четырех таблиц, образующих следующую схему: Отделение Больной Состояние Врач В таблицах должна содержаться следующая информация: название. [читать подробнее].
При разработке алгоритмов и программ с множествами необходимо учесть, что Паскаль не обеспечивает ввод или вывод множеств непосредственно с помощью операторов Read или Write. Формирование множества, элементы которого вводятся с клавиатуры, можно выполнить, используя. [читать подробнее].
Пример 1. Ввести в ЭВМ массив, содержащий не более 100 чисел вещественных чисел. Вывести числа, стоящие на четных местах в массиве. Рrogram Wtr; Const Nmax=100; Var X : Array[1..Nmax] Of Real; i, n : Integer; Begin Writeln(‘Введите количество чисел’); Readln(n); Writeln(‘Введите массив’); For i:= 1 To n Do Read (X[i]); For I:= 1 To n. [читать подробнее].
Для выполнения практического задания в курсовой работе необходимо использовать умения и навыки, полученные при решении задач с числами, записанными в различных системах счисления, при работе с программами Excel, MathCad, Pascal, КОМПАС-ГРАФИК. Рассмотрим несколько примеров. [читать подробнее].
1. Даны значения двух величин. Выбрать большее из них. Обозначим данные величины через А и В, результат – С. Приведем блок-схему алгоритма решения этой задачи. Рассмотрим два способа: (a) с использованием полного ветвления; (б) с использованием неполного ветвления. Если. [читать подробнее].
Неуймин – Неуйма («неукротимый, энергичный, деятельный человек»). Рассудов – Рассуд («рассудительный человек»). Ряхин – Ряха («аккуратная женщина»). Басов, Басков – Бас – краса, баской – красивый. Большаков – Большак («главная дорога», «старший сын»). Волохов –. [читать подробнее].
1.2. Расчёт объёма и состава продуктов горения
С целью упрощения расчёта все горючие вещества разделены на три типа: индивидуальные, сложные, смеси горючих газов (табл. 1.2.1).
Тип горючего вещества
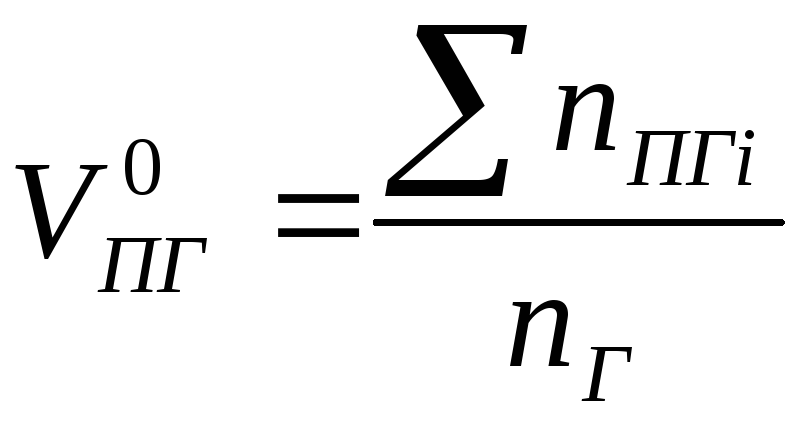

Вещество сложного состава





Здесь 






Практический (полный) объём продуктов горения состоит из теоретического объёма продуктов горения и избытка воздуха



Состав продуктов горения, т.е. содержание i-го компонента определяется по формуле

При горении в избытке воздуха в продуктах горения содержится кислород и азот
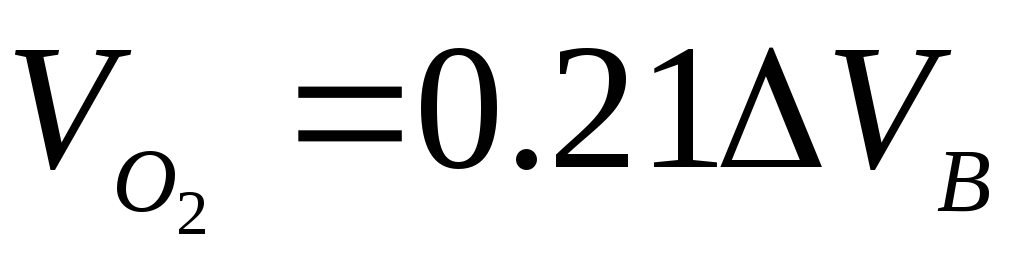


Примеры
Пример 1. Какое количество продуктов горения выделится при сгорании 1м 3 ацетилена в воздухе, если температура горения составила 1450 К.
Горючее-индивидуальное химическое соединение (формула 1.2.1). Запишем уравнение химической реакции горения
C2H2+


Объём продуктов горения при нормальных условиях

Объём продуктов горения при 1450 К

Пример 2. Определить объём продуктов горения при сгорании 1 кг фенола, если температура горения 1200 К, давление 95000 Па, коэффициент избытка воздуха 1,5.
Горючее-индивидуальное химическое соединение(формула 1.2.2). Запишем уравнение химической реакции горения
C6H5OH+


Молекулярная масса горючего 98.
Теоретический объём продуктов горения при нормальных условиях

Практический объём воздуха при нормальных условиях

Объём продуктов горения при заданных условиях

Пример 3. Определить объём продуктов горения при сгорании 1 кг органической массы состава: С-55%, О-13%, Н-5%, S-7%, N-3%, W 17%, если температура горения 1170 К, коэффициент избытка воздуха – 1.3.
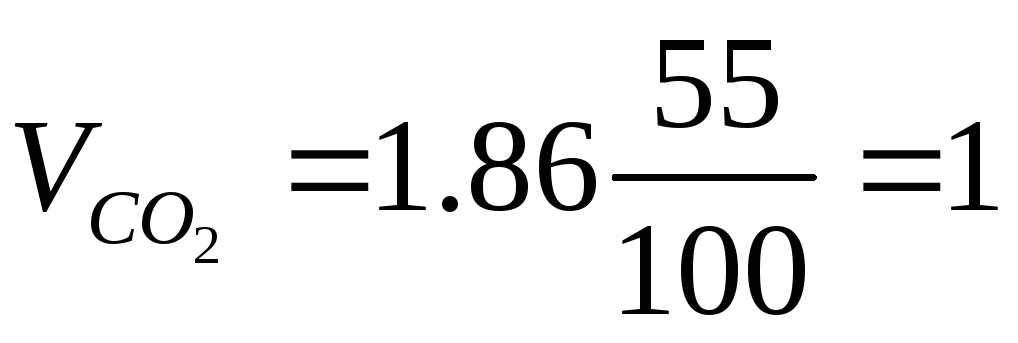

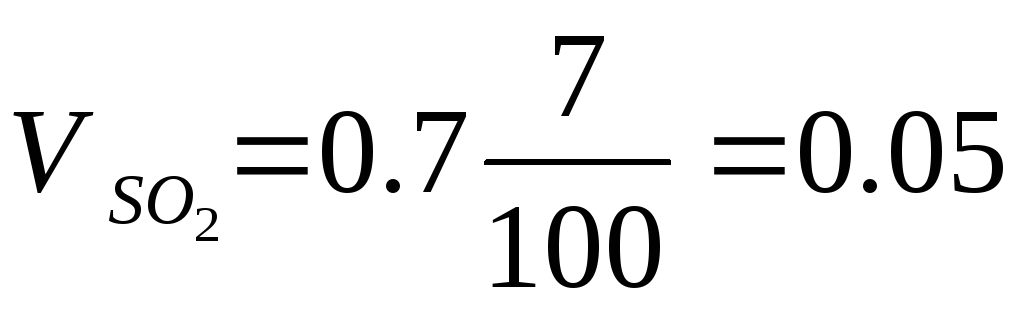

Полный теоретический объём продуктов горения при нормальных условиях
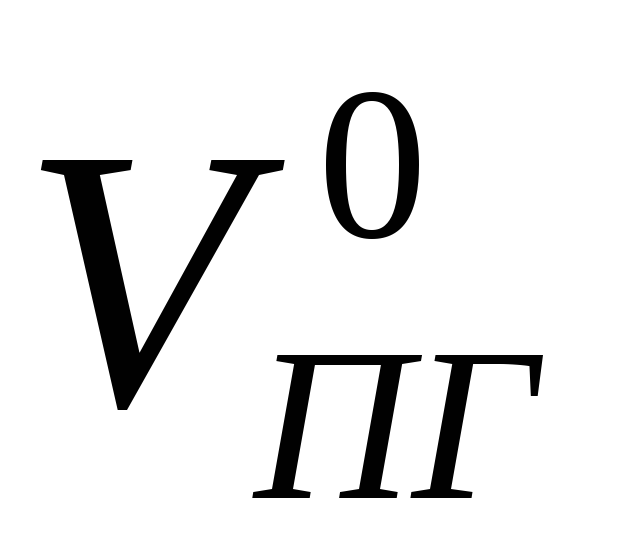
Практический объём продуктов горения при нормальных условиях

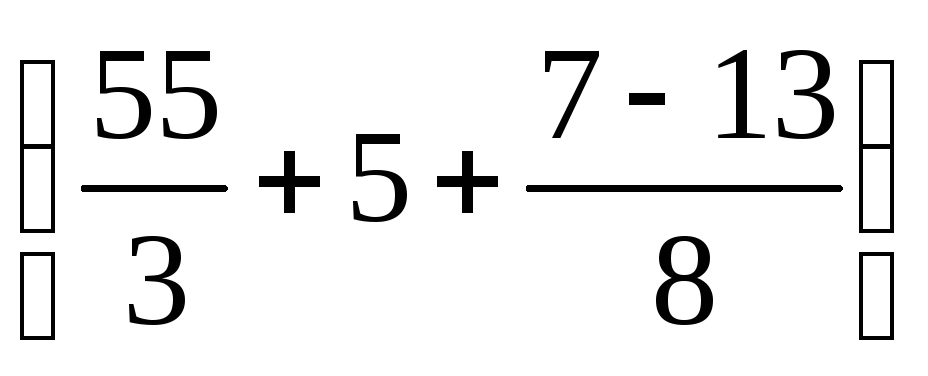
Практический объём продуктов горения при температуре горения

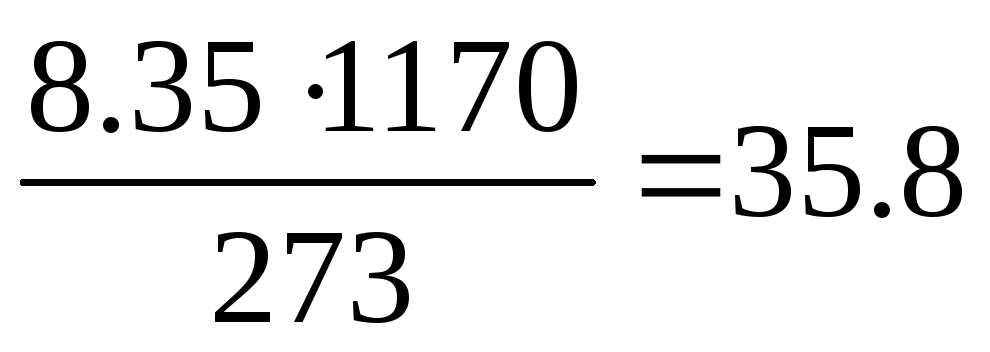
Пример 4. Рассчитать объём продуктов горения при сгорании 1м 3 газовой смеси, состоящей из С3Н6-70%, С3Н8-10%, СО2-5%, О2-15%, если температура горения 1300 К, коэффициент избытка воздуха – 2,8. Температура окружающей среды 293 К.
Объём продуктов горения определяется по формуле (1.2.8)


Так как газовая смесь содержит в составе кислород, он будет окислять часть горючих компонентов, следовательно, понизится расход воздуха (формула 1.1.5).
В этом случае теоретический объём азота удобнее определять по формуле (1.2.14)

Теоретический объём продуктов горения

Практический объём продуктов горения
Объём продуктов горения при температуре 1300 К
Пример 5. Определить состав продуктов горения метилэтилкетона.
При такой постановки задачи рационально определить непосредственно из уравнения горения объём продуктов в кмолях, выделившихся при сгорании 1 кмоля горючего





По формуле (1.2.11) находим состав продуктов горения
Пример 6. Определить объём и состав продуктов горения 1 кг минерального масла состава: С-85%, Н-15%, если температура горения 1450 К, коэффициент избытка воздуха – 1,9.
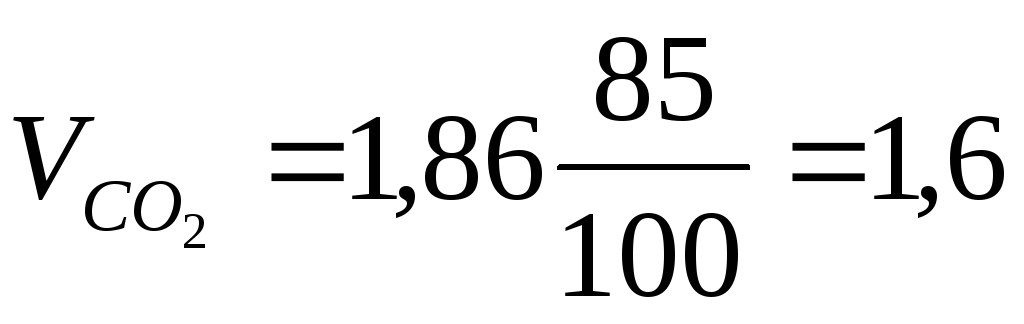


Теоретический объём продуктов горения при нормальных условиях
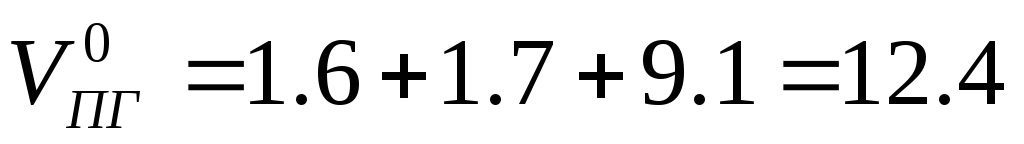
Практический объём продуктов горения при нормальных условиях формула (1.2.10)

Объём продуктов горения при температуре 1450 К
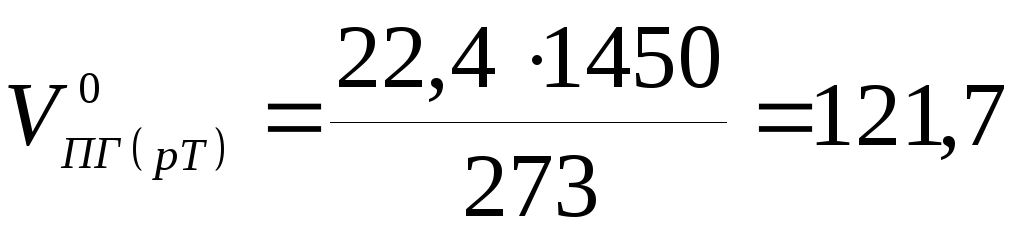
Очевидно, что состав продуктов горения не зависит от температуры горения, поэтому целесообразно определить его при нормальных условиях. По формулам (1.2.11;1.2.13)

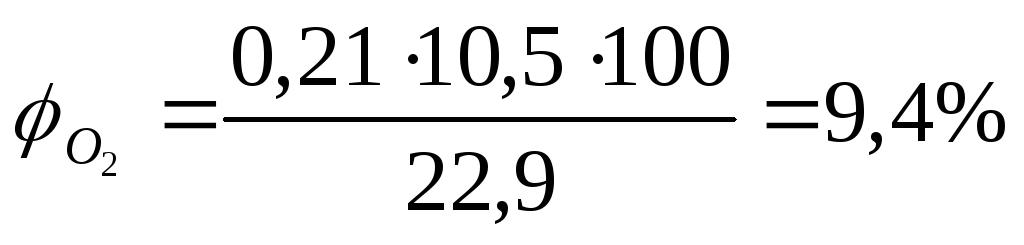
Запишем уравнение реакции горения ацетона в воздухе
Из уравнения следует, что при горении из 58 кг (молекулярная масса ацетона) выделяется 

Решение. Определим объём выделившейся двуокиси углерода
По формуле (1.2.6) для вещества сложного состава определим объём СО2, выделившейся при горении 1 кг горючего,

Определим количество сгоревшего вещества

Поскольку не учитывается разбавление продуктов горения, определяем объём выделившейся в результате горения двуокиси углерода, соответствующей 8% её содержания в атмосфере

Из выражения (1.2.3) определим, сколько должно сгореть горючего материала, чтобы выделился данный объём двуокиси углерода
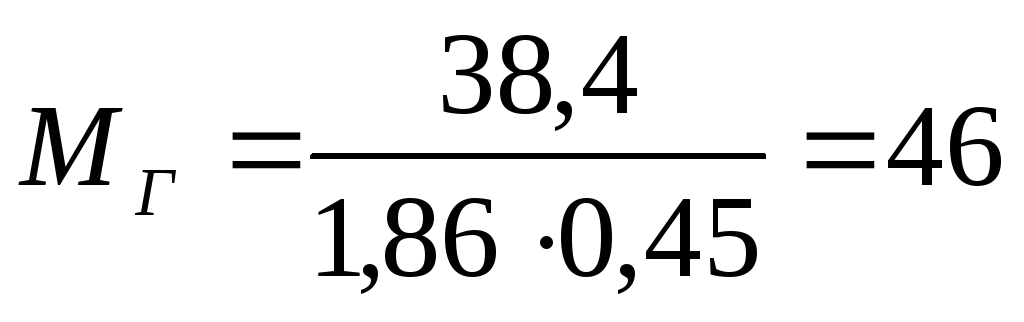
Время горения определим, исходя из соотношения
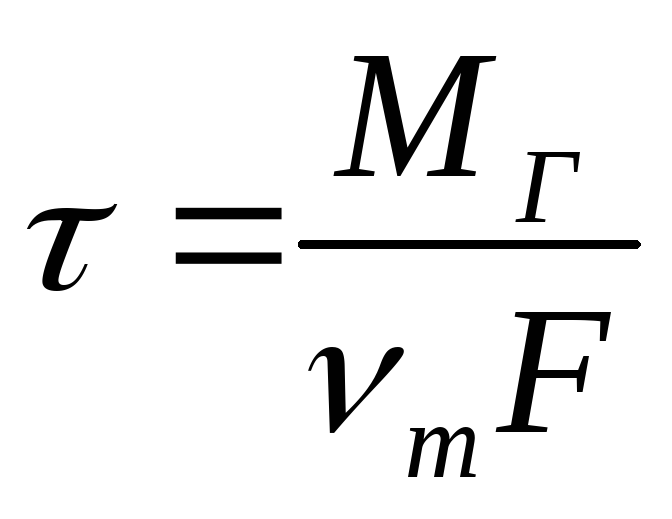
где 


Задание на самостоятельную работу