Фистула не шумит что делать
Фистула не шумит что делать
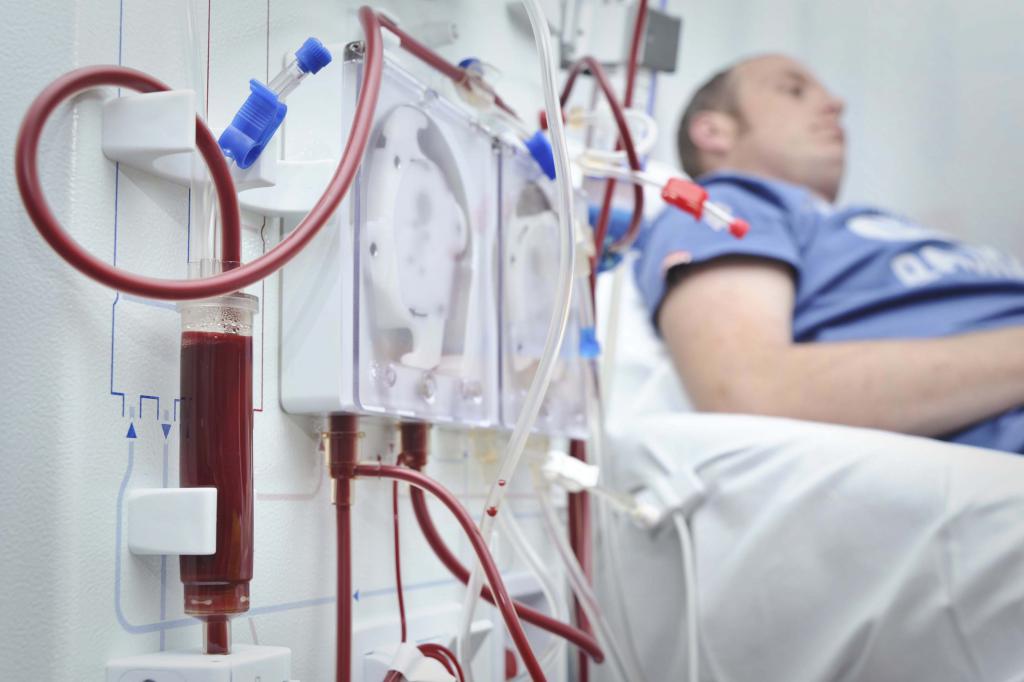
Если почка – второе сердце человека (так много функций выполняет этот орган), то для пациента на гемодиализе эту роль в какой-то степени выполняет фистула. Незнакомое для большинства людей слово означает «сосудистый доступ» — место, откуда берется значительное количество крови для очистки в аппарате «искусственная почка» и куда оно возвращается уже в очищенном от токсинов виде. Обычно это рука, предплечье, хотя при крайней необходимости могут быть и другие органы человека.
Так вот, нормальная работа организма подразумевает течение кровотока от сердца по артериям в капилляры, затем движение происходит по венам обратно. Артериовенозная фистула представляет собой искусственно созданное соустье артерии и вены, они «сшиваются» — в итоге кровь движется по сообщению между веной и артерией, минуя капиллярную сеть. Естественно, поток крови увеличивается, вена набухает – что дает возможность быстро перекачивать кровь посредством специальных игл.
— Можно ли обойтись без операции?
Операция по формированию фистулы считается несложной, если сосуды достаточно развиты и нет сопутствующих заболеваний, то она продлится минут 40. При этом пациент остается в полном сознании, операция проводится под местной анестезией.
Если же естественное формирование фистулы по каким-то причинам невозможно, то используются специальные сосудистые протезы – трубочки, заменяющие часть вены. Их можно пунктировать уже через сутки после операции. Фистулу, сформированную «естественным» путем, нужно беречь. Колоть в нее не рекомендуется по крайней мере месяц. Фистула должна «созреть», набухнуть кровью. Иначе искусственно созданное соустье артерии и вены может нарушиться, фистула «остановится».
— Готовьтесь к диализу заблаговременно
Учитывая значение фистулы для всей дальнейшей жизни диализного пациента, специалисты рекомендуют формировать фистулу заблаговременно, планово, за несколько месяцев до начала диализа. Это гарантирует многолетнюю работу фистулы и отсутствие дополнительных проблем на гемодиализе.
Правда, большая часть больных попадают на диализ слишком поздно — тогда, когда организм уже отравлен токсинами из-за плохо работающих почек и когда счет идет уже на недели, а то и дни. Поэтому им приходится срочно обеспечивать временный сосудистый доступ – через катетеры в центральных венах – подключичной или яремных, располагающихся на шее и уносящих кровь от шеи и головы.
— Почему она так шумит?
Новичка с только что сформированной фистулой узнать довольно легко – как правило, пациент то и дело ее «выслушивает». Для этого достаточно прижать прооперированную руку к уху. Этот пульсирующий, чуть свистящий звук трудно спутать с чем-то другим. Некоторым людям он напоминает шум работающих прессов или машин. Это перекачивается кровь по набухшим венам. Шум должен быть ритмичным и всегда одним и тем же. При любом изменении звука необходимо срочно показать лечащему врачу. А если вдруг шум пропал, срочно отправляйтесь в диализный центр – фистула могла остановиться, затромбироваться. Иногда тромбы удается убрать хирургическим путем или медикаментозно.
— Из истории создания фистулы
Не зря говорят, что все гениальное просто. Несмотря на кажущуюся простоту, идея создания артериовенозной фистулы не сразу пробилась среди других научных изобретений. В первые годы применения диализа ученым пришлось изрядно намучаться с этой проблемой. Поначалу в качестве сосудистого доступа использовали канюлю — трубку, которую хирургическим путем закрепляли, «приживляли» к сосудам пациента.
Началом эпохи хронического гемодиализа считается 1960 год, когда Белдингу Скрибнеру и Вейну Квинтону из американского города Чикаго удалось решить проблему долгосрочного сосудистого доступа. У них долговременный сосудистый доступ обеспечивался путем имплантации в лучевую артерию и подкожную вену двух тонкостенных тефлоновых трубок. Наружные концы шунта соединялись изогнутой тефлоновой трубкой, которая на время проведения гемодиализа удалялась, а к шунтам подключался гемодиализатор.
Фистула не шумит что делать
В целом в Москве около 3600 человек получает лечение программным гемодиализом. Наилучшей стратегией с точки зрения комфорта пациента и минимизации осложнений является осуществление гемодиализа через сформированную артерио-венозную фистулу (АВФ) в качестве постоянного сосудистого доступа.
Осложнение при длительно существующих АВФ
Срок функционирования артерио-венозных фистул ограничен многими факторами. В частности, венозная часть фистулы подвергается дегенерации и стенозированию, что существенно сокращает срок службы сосудистого доступа и затрудняет проведение гемодиализа. Довольно часто встречается сужение или окклюзия центральных вен вследствие длительно стоящих центральных венозных катетеров или многократных пункций центральных вен у этой категории пациентов. К сожалению количество возможных анастомозов ограниченно доступными сосудами. Таким образом, дисфункция артериальной или венозной части приводит к необходимости формировать новую фистулу, что не всегда возможно в условиях длительной заместительной почечной терапии. В тоже время окклюзия центральной вены приводит к потере возможности формирования сосудистого доступа на этой конечности.
Современные эндоваскулярные технологии позволяют осуществлять малотравматичную эффективную реконструкцию сосудистого доступа и центральных вен, что ведет к сохранению существующей фистулы и удлинению срока функционирования сосудистого доступа.
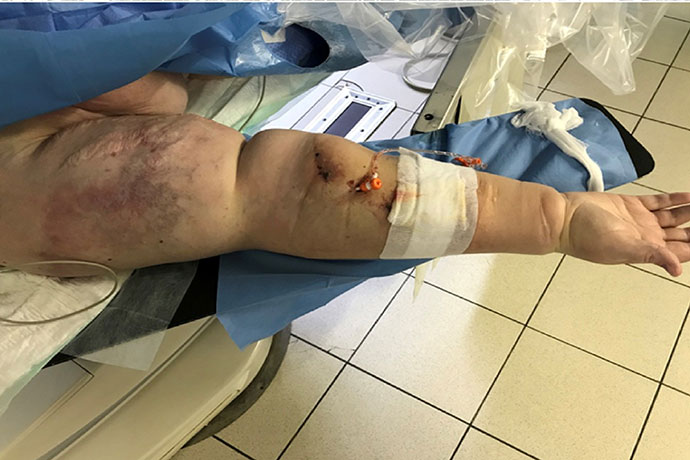
В нашу клинику поступила пациентка, находящаяся на заместительной почечной терапии в течении 2-х лет. В последние полгода отмечает массивный отек правой руки, на которой сформирована артерио-венозная фистула для проведения гемодиализа. К моменту госпитализации отек увеличился настолько, что существующий сосудистый доступ стал недоступен для пункции и проведения гемодиализа. Пациентка жаловалась на потерю подвижности правой руки вплоть до пальцев, боль и эстетический дискомфорт.
Раньше одним из методов борьбы с подобной проблемой было лигирование, то есть перевязка сформированного артерио-венозного анастомоза с потерей возможности формирования новой фистулы на этой конечности. Такой подход неоправдан в условиях ограниченного количества мест, подходящих для формирования сосудистого доступа, а потеря всей конечности становится катастрофой для пациентов, зависящих от гемодиализа.
Врачи-эндоваскулярные хирурги выполнили прямую фистулографию, на которой выявлена окклюзия правой подключичной вены, что и явилось причиной массивного отека. В течении 6,5 часов мы предпринимали попытки реканализации этой окклюзии, однако несмотря на применение различных методик пройти через окклюзию в истинный просвет верхней полой вены не удалось. Несколько раз проводник уходил в субинтимальное пространство, однако нащупать истинный ход правой подключичной вены не удалось ни антеградно ни ретроградным доступом. Спустя 6,5 часов от дальнейших попыток было решено отказаться. Однако, принимая во внимание субинтимальный канал, сформированный во время попыток реканализации вены, было принято решение взять пациентку на повторную реканализацию спустя две недели.
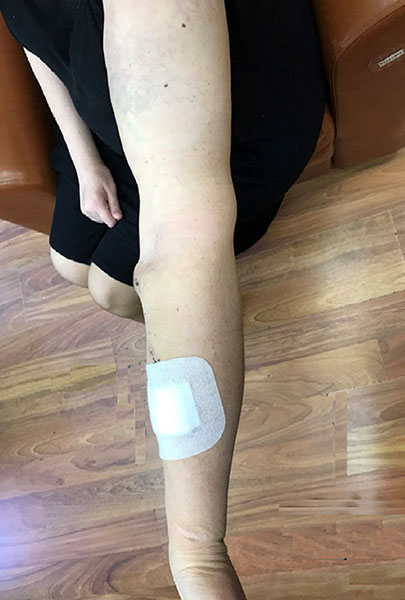
На повторной фистулографии мы убедились в том, что протяженность окклюзии сократилась, и предприняли попытку повторной реканализации правой подключичной вены. Коронарный проводник при поддержке микрокатетера удалось провести через зону окклюзии в верхнюю полую вену. Затем коронарным баллоном диаметром 2,5 мм и длиной 15 мм выполнена дилатация в зоне окклюзии и сформирован канал, по которому был проведен диагностический катетер и осуществлена смена проводника. Процедура закончилась успешной имплантацией саморасширяющегося стента в область окклюзии правой подключичной вены, и восстановлением магистрального кровотока. На следующие сутки пациентка отметила существенное уменьшение отека правой руки, возвращение подвижности в пальцах и локтевом суставе. А через несколько дней отек полностью исчез и рука приобрела нормальный размер. Таким образом эндоваскулярная реконструкция позволила сохранить сосудистый доступ на правой руке, сохранить правую руку для формирования повторных артерио-венозных анастомозов в случае необходимости. И что важно — позволила сохранить высокое качество жизни пациентке на заместительной почечной терапии.
Правая рука до реконструкции сосудистого доступа
Правая рука на 3-й день после реконструкции
Фистула не шумит что делать
Поскольку пункция АВ фистулы – это вмешательство в организм и, по сути, маленькая операция, следует придерживаться обычных предоперационных мер гигиены. За этим внимательно следят врачи и медицинские сестры. Диализные пациенты также должны уделять пристальное внимание гигиене сосудистого доступа, так как они особенно уязвимы в результате своего заболевания и сниженной сопротивляемости организма. Перед началом процедуры диализа руку с АВ фистулой следует вымыть с мылом и вытереть насухо одноразовыми салфетками. Медицинский персонал во время работы с любым сосудистым доступом использует медицинские перчатки, процедура проводится согласно строгим правилам инфекционного контроля.
Правила пункции фистулы
Пункцию фистулы не следует производить ближе трех сантиметров к анастомозу.
В фистульную вену вводится как минимум 6 фистульных игл в неделю, 25 в месяц, 300 в год. А диализом пациент может лечиться не одно десятилетие. Мест же для создания новых фистул не так много, да и любая операция небезболезненна и небезразлична. Поэтому фистулу необходимо беречь.
Уход за АВ фистулой
После создания АВ фистулы вас могут попросить выполнять некоторые упражнения для наилучшего развития и «созревания» фистулы. Процесс «созревания» фистулы занимает примерно от 3 до 8 недель. Этому процессу способствуют упражнения с кистевым эспандером. Для этого нужно взять эспандер в руку, на которой расположена фистула, и выполнять сжимания, предварительно пережав руку выше фистулы. Пережать руку можно другой рукой, жгутом или накаченной воздухом манжетой, которая используется для измерения артериального давления. Каков оптимальный способ разработки фистулы для вас, следует уточнить у своего лечащего врача. Для того чтобы избежать повреждения сосудистого доступа, никогда не совершайте никаких действий, способных нанести вред фистуле. Любые сомнения обсуждайте с вашим лечащим врачом, уточняйте то, что вам непонятно, и всегда советуйтесь, если не уверены в правильности своих действий.
Вам также необходимо научиться наблюдать за ощущениями, возникающими в результате функционирования АВ фистулы. Пульсация и ощущение шума являются признаками того, что в фистуле происходит процесс кровообращения. Некоторые пациенты используют стетоскоп, чтобы слышать так называемый сосудистый шум, другим достаточно просто положить руку на кожу над фистулой, чтобы почувствовать ее функционирование. Уход за раной в течение 2-х первых недель после формирования фистулы и регулярная смена повязок являются самым важным в процессе ухода за фистулой. Руку с фистулой обычно можно мыть через 24–48 часов (уточните у врача-хирурга). Для предотвращения возможных осложнений (например, инфекций) очень важно следить за тем, чтобы не повредить кожу над фистулой.
Как ухаживать за фистулой или протезом в домашних условиях?
Проверяйте состояние фистулы каждый день: она должна чувствоваться под кожей, и вы должны слышать шум крови. Медсестра или врач покажут вам, как правильно проверять состояние сосудистого доступа. Рука с фистулой всегда должна быть чистой, мойте ее каждый день. Ваша медсестра посоветует, каким типом мыла лучше пользоваться. Следите за ее состоянием, не появились ли признаки заражения: болезненность, отек или покраснение фистулы. Заражение также может проявляться через появление жара, лихорадки. Если вам показалось, что фистула потеряла рабочее состояние или появилась инфекция, немедленно обратитесь в диализный центр за консультацией. Не носите тесную одежду или наручные часы на руке с фистулой. Избегайте измерения артериального давления на руке с фистулой или забора из нее крови на анализы (за исключением ситуации на гемодиализной процедуре или одобрения сотрудниками центра). Не спите на руке с фистулой. Не носите на ней или в ней тяжелых вещей.
Тромбоз артерио-венозной фистулы: тромбэктомия или реконструкция?
Авторы
Калинин Р.Е., Сучков И.А., Егоров А.А., Климентова Э.А.
ФГБОУ ВО Рязанский государственный медицинский университет имени академика И.П. Павлова, Рязань
Аннотация
Программный гемодиализ, на сегодняшний день, является основным методом в лечении пациентов с терминальной хронической болезнью почек. Для проведения адекватного гемодиализа необходимо формирование постоянного сосудистого доступа (как правило, это артерио-венозная фистула). Одной из основных причин прекращения его функционирования является тромбоз.
Цель исследования: выявление причин тромбоза артерио-венозных фистул и выбор оптимального способа диагностики и хирургической коррекции.
Материалы и методы. В данное исследование включено 70 пациентов, с тромбозом нативных артерио-венозных фистул. Всем пациентам в качестве диагностики выполнялось ультразвуковое дуплексное сканирование, ангиография по показаниям. Проводилось гистологическое исследование стенозов фистульных вен и анастомозов. Все пациенты подвергались хирургическому лечению в объеме тромбэктомии, реконструкции артерио-венозные фистулы, либо формирования нового доступа.
Результаты. Все пациенты были разделены на три группы в зависимости от вероятной причины тромбоза и вида операции: тромбоз на неизмененных сосудах — 5 пациентов (7%); тромбоз, вследствие гиперплазии неоинтимы, в местах пункций фистульной вены — 25 пациентов (43%); тромбоз, вследствие гиперплазии неоинтимы артериовенозного анастомоза — 35 пациентов (50%).
Данные причины были выявлены с помощью ультразвукового дуплексного сканирования и периферической ангиографии. Всем больным проводилось оперативное лечение, направленное на восстановление постоянного сосудистого доступа. Участки тромбированных вен и анастомозов подвергались гистологическому исследованию, где наблюдалась гиперплазия неоинтимы, которая гемодинамически значимо суживала просвет сосуда и служила причиной тромбоза.
Заключение. В ходе проведенного исследования клинически и гистологически было подтверждено, что основной причиной тромбоза нативной артерио-венозной фистулы является гиперплазия неоинтимы анастомоза, либо фистульной вены, которая требует обязательного хирургического вмешательства.
Ключевые слова: постоянный сосудистый доступ, артерио-венозная фистула, гемодиализ, неоинтима, тромбоз.
Список литературы
1. Калинин Р.Е., Сучков И.А., Егоров А.А. Возможности рентгенэндоваскулярной и гибридной коррекции постоянного сосудистого доступа у диализных пациентов // Наука молодых (Eruditio Juvenium). — 2018. — Т.6. — №4 — С. 561–568. [Kalinin RE, Suchkov IA, Egorov AA. Possibilities of roentgen-endovascular and hybrid correction of permanent vascular access in dialysis-dependent patients. Science of the young (Eruditio Juvenium). 2018;6(4):561–568. (In Russ).] Doi: 10.23888/HMJ201864561-568.
2. Gottmann U, Sadick M, Kleinhuber K. Central vein stenosis in a dialysis patient: a case report. J Med Case Rep. 2012;6:189. Doi: 10.1186/1752-1947-6-189.
3. Leivaditis K, Panagoutsos S, Roumeliotis A, et al. Vascular access for hemodialysis: postoperative evaluation and function monitoring. Int Urol Nephrol. 2014;46(2):403–409. Doi: 10.1007/s11255-013-0564-2.
4. Oleśkowska-Florek W, Połubinska A, Baum E, et al. Hemodialysis-induced changes in the blood composition affect function of the endothelium. Hemodial Int. 2014;18(3):650–656. Doi: 10.1111/hdi.12148.
5. Arnold WP. Improvement in hemodialysis vascular access outcomes in a dedicated access center. Semin Dial. 2000;13(6):359–363. Doi: 10.1046/j.1525-139x.2000.00106.x.
6. Higuchi T, Okuda N, Aoki K. Intravascular ultrasound imaging before and after angioplasty for stenosis of arteriovenous fistula in hemodialysis is patients. Nephrol Dial Transplant. 2001;16(1):151–155. Doi: 10.1093/ndt/16.1.151.
7. Paun M, Beach K, Ahmad S, et al. New ultrasound approaches to dialysis access monitoring. Am J Kidney Dis. 2000;35(3):477–481. Doi: 10.1016/s0272-6386(00)70201-0.
8. Rodriguez JA, Armadans L, Ferer E, et al. The function of permanent vascular access. Nephrol Dial Transplant. 2000;15(3):402–408. Doi: 10.1093/ndt/15.3.402.
9. Roy-Chaudhury P, Kelly BS, Miller MA, et al. Venous neointimal hyperplasia in polytetrafluoroethylene dialysis grafts. Kidney Int. 2001;59(6):2325–2334. Doi: 10.1046/j.1523-1755.2001.00750.x.
10. Heikkinen M, Salenius JP, Auvmen O. Projected workload for a vascular service in 2020. Fur J Vase Endovasc Surg. 2000;19(4):351–355. Doi: 10.1053/ejvs.2000.1074.
11. Stehman-Breen CO, Sherrard DJ, Gillen D, Caps M. Determinants of type and timing of initial permanent hemodialysis vascular access. Kidney Int. 2000;57(2):639–645. Doi: 10.1046/j.1523-1755.2000.00885.x.
Фистула не шумит что делать
На сегодняшний день остается актуальной проблема сосудистого доступа для гемодиализа у пациентов, страдающих хронической болезнью почек, терминальной стадии. Из года в год этих пациентов становится больше. Это связано не только с улучшением возможности проведения процедуры программного гемодиализа (ГД), но и с расширением доступности его проведения для пациентов. В Республике Башкортостан в 2018 году насчитывался 31 центр амбулаторного гемодиализа, где 894 пациента получали ГД. Обеспеченность заместительной почечной терапией (ЗПТ) в Республике Башкортостан (РБ) составляет 315 пациентов на 1 000 000 населения (население в РБ 4051000). В 2018 г. в России 34716 пациентов находились в листе ожидания трансплантации почки, из них 94,8% получают заместительную почечную терапию методом программного гемодиализа. На данный момент необходимость в проведении ГД составляет в развитых странах в среднем 70-120 случаев на 100 000 человек в год. В Российской Федерации в 2018 г. – 32915 пациентов получали ГД, что примерно составляет 26 пациентов на 100 000 человек. В среднем по РФ 84,3% больных в качестве сосудистого доступа имели нативную артериовенозную фистулу (АФВ).
Качество жизни пациентов, находящихся на ЗПТ, зависит от множества факторов, но определяющими, помимо причин, влияющих на снижение самооценки пациентами их состояния, обусловленных собственно процедурами программного ГД, являются осложнения [1]. Выявление осложнений постоянного сосудистого доступа (ПСД) для гемодиализа является важной задачей поддержания его функционирования. В случае несвоевременной хирургической коррекции осложнений ПСД, может привести к его утрате.
Важным условием успешности лечения больных на гемодиализе является выбор оптимального ПСД и поддержание адекватно функционирующего доступа к кровотоку на протяжении всей жизни больного. Правильное использование, уход и современная хирургия позволяют сохранять ПСД длительное время, снижая число осложнений и способствуя повышению выживаемости данной категории больных [2]. При выявлении осложнения сосудистого доступа требуется госпитализация пациентов для возможного восстановления доступа, а это зачастую связано с тем, что пациенту приходится пропускать плановые циклы ГД или требуется установка временного катетера в центральные вены для его проведения. При подготовке дизайна использованы рекомендации для наблюдательных исследований STROBE [3; 4].
Цель исследования: изучить эпидемиологию развития осложнений постоянного сосудистого доступа для гемодиализа и определить возможные пути их предотвращения у пациентов с хронической болезнью почек, терминальной стадии на программном гемодиализе.
Материалы и методы исследования
Проведено поперечное (одномоментное) исследование (cross-sectionalstudies) обсервационного типа.
Критерии включения: пациенты, находящиеся на заместительной почечной терапии методом программного гемодиализа и имеющие сосудистый доступ на верхней конечности в виде нативной артериовенозной фистулы с развившимся осложнением (кровотечение, инфекция, синдром венозной гипертензии, синдром обкрадывания, локальные неврологические нарушения, тромбоз, стеноз, ложная или истинная аневризма постоянного сосудистого доступа для гемодиализа).
Критерии исключения: пациенты, имеющие сосудистый доступ для гемодиализа в виде синтетического протеза, у которых процедура гемодиализа проводится через туннельный перманентный катетер или не туннелированный центральный венозный катетер; возраст менее 18 лет.
Исследование проводилось на базе отделения кардиохирургии ГБУЗ «ГКБ № 21» г. Уфы, ФГБОУ ВО «Башкирский государственный медицинский университет», амбулаторного центра гемодиализа ООО «Агидель» Республики Башкортостан.
Основой для составления базы данных была систематизированная информация об оперативных вмешательствах, полученная из региональной информационно-аналитической медицинской системы (РИАМС) «ПроМед». Генеральная совокупность 894 пациента (в РБ на 2018 г. получают ЗПТ).
Методы регистрации исходов
При комплексном обследовании проводили сбор жалоб, анамнеза заболевания, анализ выполненных оперативных вмешательств по поводу сосудистого доступа для гемодиализа, определяли длительность функционирования ПСД (до первой повторной госпитализации), фиксировали основное заболевание, ставшее причиной ХБП терминальной стадии, какое осложнение развивалось при повторной госпитализации.
Размер выборки включал пациентов из генеральной совокупности с учетом обеспечения репрезентативности. Отбор пациентов был произведен из случаев повторной госпитализации за период с 2016 по 2020 г. в отделение кардиохирургии ГКБ № 21 г. Уфа.
Результаты исследования и их обсуждение
Объекты (участники) исследования
Всем 215 (100%) пациентам была ранее сформирована нативная артериовенозная фистула на предплечье.
Все пациенты в послеоперационном периоде на этапе госпитализации получали профилактическую дозировку Гепарина п/к (5000 ЕД 3 раза в сутки). После выписки, на амбулаторном этапе был рекомендован прием пероральных антикоагулянтов (ПОАК) в профилактической дозировке (Апиксабан – 2,5 мг 2 раза в сутки, Ривароксобан – 10 мг 1 раз в сутки) с целью предупреждения раннего тромбоза АВФ в течение 1 месяца или до начала использования доступа для гемодиализа. В случае невозможности приема ПОАК рекомендован прием антиагрегантов в дозировке 75 мг в сутки однократно.
Основными причинами хронической почечной недостаточности терминальной стадии являлись сахарный диабет (28,4%), хронический гломерулонефрит (21,9%), пиелонефрит (15,3%) и поликистозная болезнь почек (12,6%) (табл. 1).
Распределение пациентов по основному заболеванию, которое стало причиной ХБП терминальной стадии
Число пациентов (n=215)
Поликистозная болезнь почек
Геморрагическая лихорадка с почечным синдромом
Основные результаты исследования
Основные причины осложнений, явившиеся основанием для повторной госпитализации, и клинические проявления представлены в таблице 2.
Частота выявления осложнений ПСД и их клинические проявления
Болезненное уплотнение в области тромбоза, отсутствие «сосудистой трели» доступа
Определения слабой «сосудистой трели», низкая скорость кровотока по ПСД
Диффузное увеличение ПСД в местах постоянных пункций, возможны признаки кровотечения, изъязвления, инфекции
Бледная/синяя кисть, боли при проведении гемодиализа, изъязвления, некроз
Местные признаки инфекции
Основной причиной повторной госпитализации пациентов явилось развитие тромбоза ПСД, выявлен в 87,4% случаев (у 188 пациентов).
Всем пациентам проведена операция по восстановлению ПСД, структура оперативных вмешательств представлена в таблице 3.
Структура оперативных вмешательств при осложнении ПСД
Формирование АВФ в нижней трети предплечья
Формирование АВФ в средней трети предплечья
Формирование АВФ в верхней трети предплечья
Другое оперативное вмешательство
В результате проведенного сравнительного анализа выявлено, что в случае развития осложнения, со стороны постоянного сосудистого доступа, при проведении оперативного вмешательства, отмечалась постепенная проксимализация уровня формирования АВФ с нижней трети (35,4%) к верхней трети (6,5%). При осложнении ПСД среди повторных оперативных вмешательств имелся относительно высокий уровень проведения тромбэктомий (15,3%) и реконструкций ПСД (15,8%).
Для определения зависимости осложнения от основного заболевания, ставшего причиной ХБП терминальной стадии, взят тромбоз ПСД (87,4%) как основное осложнение гемодиализного доступа.
Распространенность тромбоза среди осложнений у пациентов при повторной госпитализации составила 87,4% (95% CI: 82,3-91,2%).
Оценка возможной связи возникновения тромбоза в зависимости от основного заболевания представлена в таблице 4.
Частота развития тромбоза при определенном основном заболевании
Поликистозная болезнь почек
Геморрагическая лихорадка с почечным синдромом
В литературе приводятся данные о частоте тромбозов АВФ, о т 4 до 16% ежегодно [5; 6]. Тромбоз – самое частое осложнение, нарушающее работу сосудистого доступа, возникающее как в раннем, так и отдаленном периоде. Ретроспективное исследование А. Korn с соавт. у 291 пациента с АВФ с 5 (1,7%) случаями тромбоза в раннем и позднем послеоперационном периоде выявило как достоверный фактор риска развития тромбоза предшествующую операцию и интраоперационные осложнения [7]. Проспективное когортное исследование D.G. McGrogan включало 86 пациентов. Одна операция по формированию фистулы была выполнена 62 пациентам, из них 24 пациента после первой операции в раннем послеоперационном периоде нуждались в повторной операции. Значимым фактором риска был малый диаметр отводящей вены. Ретроспективное исследование Y. Kinoshita (n = 91) 8 больных с сопутствующим онкологическим заболеванием и 83 пациентов контрольной группы выявило высокий риск тромбоза АВФ у онкологических больных (50% против 10,8%) в течение 30 дней после операции. Р. Ravani и соавт. выявлены неинфекционные осложнения сосудистого доступа, представленные в основном тромбозом (n = 1 772; 85%), тогда как инфекционные осложнения у 8,9 (54,2%) пациентов состояли из инфекций местного доступа (n = 331; 61%) и сепсиса или бактериемии (n = 211; 39%) [8].
Заключение
Частой причиной ранней дисфункции сосудистого доступа для гемодиализа является ее тромбоз. Вне зависимости от техники формирования анастомоза используемых сосудов, анатомической зоны, использования протезов, вариантов контроля за состоянием работы фистулы, процент тромбозов остается на уровне 30% в течение первого года (от 1,7% до 56,1% при наличии факторов риска), по данным различных авторов. Считаем, что приоритет за формированием нативных артериовенозных фистул на не доминантном предплечье пациента.
Важным остается обучение среднего медицинского персонала раннему выявлению проблем сосудистого доступа. Использование классических методов пункции сосудистого доступа по типу: модель «веревочной лестницы» и метод чередующих участков [11]. Контроль за методом пункции остается за врачом амбулаторного центра гемодиализа [12].
Наш опыт показывает применение пероральных антикоагулянтов у пациентов на заместительной почечной терапии для профилактики развития венозных тромбоэмболических осложнений как безопасный и эффективный метод. Применение пероральных антикоагулянтов у пациентов после проведения реконструктивных операций на сосудистый доступ возможно, эффективно (отсутствие раннего тромбоза сосудистого доступа) [13]. Но обязателен контроль риска кровотечения и обязательно соотношение риска и пользы при применении.
Проведение тромбэктомии из сосудистого доступа и возможная реконструкция в раннем периоде развития осложнения (1-2 сутки) показывает положительные результаты [14]. Предоставляет возможность пациентам продолжать гемодиализ через сосудистый доступ, в течение суток после восстановления, без необходимости установки катетера в центральные вены. С целью ранней профилактики тромбоза постоянного сосудистого доступа возможно применение пероральных антикоагулянтов в профилактических дозировках [15], но необходимо вести контроль риска кровотечения и убедиться в безопасности применения для конкретного пациента.
На сегодняшний день остаются не решенными до конца вопросы о способах ранней профилактики осложнений сосудистого доступа для гемодиализа как на этапе первичного формирования артериовенозной фистулы, так и при ее использовании уже в амбулаторных центрах при проведении процедуры программного гемодиализа.