Фиброз мжп что это
Фиброз сердца и печени: составляющие одного уравнения
ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава РФ, Клиника пропедевтики внутренних болезней им. В.Х. Василенко, 119881 Москва, ул. Погодинская, д.1, стр.1
Фиброз миокарда играет ключевую роль в патогенезе сердечно-сосудистых заболеваний. При хронической перегрузке давлением в сердце происходит активация синтеза коллагена, что приводит к его избыточному накоплению, фиброзу и гипертрофии миокарда. Повреждению миокарда часто сопутствует поражение печени. Эти два процесса тесно взаимосвязаны. Одним из связующих звеньев этой цепи служит активация ренин-ангиотензин-альдостероновой системы (РААС). Существует внушительная доказательная база в отношении препаратов, блокирующих РААС, и тем самым разрывающих порочный замкнутый круг сердечно-сосудистого континуума. Процессы фиброгенеза неспецифичны и перспектива применения средств, влияющих на активность РААС, может быть полезной для предотвращения фиброза не только в сердце и печени, но и в других органах.
Фиброзом называют уплотнение соединительной ткани в различных органах, которое сопровождается появлением рубцовых изменений. Эти рубцовые изменения возникают, как правило, на месте хронического воспаления: атрофии или дистрофии. В контексте фиброза основными «действующими лицами» являются компоненты внеклеточного матрикса — гликопротеины, протеогликаны и гиалуроновая кислота.
В пораженных тканях наблюдается чрезмерное накопление фибробластов и белков внеклеточного матрикса, включая коллаген, который служит основной структурной единицей фиброза. Коллаген — превалирующий гликопротеин внеклеточного матрикса. Это вещество представляет собой фибриллярный белок, который составляет основу соединительной ткани организма и обеспечивает ее прочность и эластичность. Пучки коллагена имеют форму тройной спирали, которые сшиваются вместе и образуют очень прочные коллагеновые фибриллы. Их прочность сравнима с прочностью стали [1].
Однако фиброз — не просто преобладание синтеза коллагена над его распадом. Это еще и процесс «структурирования» коллагена. Только структурированный коллаген имеет значение в развитии фиброза. Существуют 2 основных типа фиброза: реактивный и репаративный. Чаще всего мы встречаемся с реактивным типом, который наиболее характерен для большинства больных артериальной гипертонией (АГ), страдающих абдоминальным ожирением, с длительно текущей и плохо леченной АГ.
В качестве отсроченных последствий инфаркта миокарда можно рассматривать формирование на месте некроза рубца. Этот процесс является ярким примером репаративного фиброза. Атрофия и дистрофия ткани лежат в его основе. В этом случае пласты здоровых кардиомиоцитов чередуются с участками соединительной ткани [2].
Прогрессирование фиброза зависит, с одной стороны, от времени, а с другой — от микровоспалительной реакции, которая возникает в результате встречи с различными факторами (облучение, травма, инфекционно-аллергические факторы и др.). Выраженность микровоспалительной реакции определяет степень фиброза [3].
Конечно, в качестве одной из основополагающих причин фиброза нельзя не упомянуть значительную роль генетических структур, ответственных за синтез регуляторных белков. Эти белки участвуют в процессе фиброгенеза и могут приводить к ускорению или замедлению соответствующего процесса.
Главным механизмом в развитии фиброза служит активация ренин-ангиотензин-альдостероновой системы (РААС). Эта система контролирует тонус сосудов и гомеостаз натрия и воды. Основной действующий компонент РААС — ангиотензин-II (АТII), который представляет собой октапептид (состоит из 8 аминокислот). АТII образуется путем отщепления от неактивного предшественника ангиотензина-I (АТI) двух последних (C-концевых) аминокислот под воздействием ангиотензинпревращающего фермента (АПФ). АТII обладает высокой функциональной активностью, в первую очередь, в отношении сердечно-сосудистой системы, почек и надпочечников. Этот белок играет основную роль в развитии фиброза. Согласно данным экспериментальных и клинических исследований, ATII рассматривается как медиатор воспаления, который непосредственно активирует ремоделирование сердца. Кроме того, ATII отрицательно влияет на функцию эндотелия и стимулирует секрецию цитокинов и хемокинов. Но одним из наиболее отрицательных эффектов ATII в контексте фиброза служит его влияние на синтез коллагена. При этом ATII наравне с альдостероном снижает деградацию коллагена, что приводит к его выраженной аккумуляции.
Итак, конечным результатом действия РААС является увеличение объема циркулирующей крови и повышение системного артериального давления (АД). Общие представления о РААС остались неизменными, однако появилась масса новых сведений. Обнаружено, что РААС не является исключительно циркуляторной системой, и в тканях различных органах, в частности, сердце, печени, поджелудочной железе, существует ее автономный аналог. В этих органах самостоятельно синтезируются отдельные фрагменты ангиотензина, которые участвуют в регуляции роста, апоптоза клеток, процессах воспаления и фиброгенеза.
Механизмы развития фиброза разных органов во многом схожи, но, учитывая особую интимную общность патогенетических реакций, приводящих к развитию фиброза сердца и печени, следует связать во.
Профилактика развития фиброза миокарда
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Уважаемые коллеги, я предоставляю слово Оксане Михайловне Драпкиной с сообщением, которое, на мой взгляд, посвящено мечтам современных кардиологов, о профилактике развития фиброза
Оксана Михайловна Драпкина, профессор, доктор медицинских наук:
– Спасибо. На первом слайде мы видим, что название лекции заканчивается вопросом: «Профилактика фиброза миокарда. С чего начать?». Действительно, Сергей Руджерович правильно подметил, что, наверное, это в большей степени мечта, но если бы не было мечты, то, наверное, не было бы самолетов, телевизоров, и так далее, и мы бы здесь не сидели, не общались с вами, уважаемые коллеги.
Начну я, как ни странно с 1867-го года и призываю вас пройти со мной «назад в будущее». Боткин Сергей Петрович. Я не случайно отношу нашу аудиторию в военно-медицинскую академию, где Сергей Петрович в 1867-м году читал лекцию. Обычно он читал лекции таким образом, что приходили пациенты, он их демонстрировал и обсуждал вместе со своими слушателями основные аспекты сначала диагноза, а потом и лечения. Вот молодая женщина пришла с жалобами на боль в груди, в левом боку, сердцебиение, одышку и опухоль шеи, которая мешает ей глотать; часто потеет как днем, так и ночью; моча отделяется в весьма обильном количестве и часто. Цитирую Сергея Петровича: «Трясение в ногах и руках, в особенности, когда чем-нибудь взволнуется». В общем, нам уже в принципе понятно, в каком органе, наверное, искать патологию.
Боль в груди. Она бывает разная. Я остановлюсь именно на той боли, которая больше увлекла в то время Сергея Петровича. Эта молодая девица, как он говорит, «место боли указывает под левой грудью, где они обыкновенно начинаются, распространяясь нередко по всему левому боку. Сила и продолжительность бывают различны. И вызываются они чаще всего какой-нибудь неприятностью или беспокойством».
Вы видите схематично анамнез заболевания. Начинается все в 1861-м году. Я это высчитывала, поскольку Боткин дал нам детальные инструкции, как все было. И мы видим, что все началось, как в то время часто и бывало, с горячки, поноса и бреда – это был, по-видимому, тиф. Затем стали нарастать боль под левой грудью. В 1866-м году ее родители стали отмечать опухоль шеи, и в конце появился нерегулярный ритм, это тоже по некоторым аспектам будет ясно.
Осмотр. «Больная хорошего телосложения, но бледна. И в лице ее с первого взгляда вы не замечаете никакой особенности. кроме разве того, что выражение ее лица несколько беспокойное, как будто она чем-то испугана. И уже после вы начинаете замечать, что глаза ее несколько выпуклы. Затем резко бросается в глаза увеличенный объем шеи в силу развития щитовидной железы. »
Перкуссия и пальпация. Начинается сама пропедевтика. Надо сказать, что Сергей Петрович, начиная перкутировать, перкутирует все: легкие, сердце, печень, селезенку и так далее. Остановлюсь только на ненормальностях, которые выявил Сергей Петрович. И эти ненормальности кроются, в основном, во втором межреберьи слева от грудины. Здесь стрелкой показано, что он встречается с резким притуплением тона по парастернальной левой линии в области второго ребра и выше.
Аускультация. В этой же области, второе межреберье слева от грудины «. выслушивая дыхание, нахожу, что оно везде сохраняет характер везикулярного, но на левой стороне послабее, что в особенности резко выражено в области тупого тона по левой парастернальной линии». Уважаемые коллеги, коротко резюмируем. Значит, во втором межреберьи слева от грудины есть притупление перкуторного звука, ослабление везикулярного дыхания и небольшие, как он говорил, субкрепитирующие хрипы.
Обратите внимание, что аускультирует он и щитовидную железу. И сразу хочу сказать, что те симптомы гипертиреоза, которые мы теперь знаем, как симптом Рингеля, как симптом Мебиуса, как симптом Жоффруа – все это описывает Боткин в этой лекции, не называя это своим именем. Кстати, этот получил потом название симптома Бутмана, когда резкий артериальный шум мы можем слышать при аускультации щитовидной железы.
Диагноз. Диагноз не вызывает сомнения. Он говорит, что вы видите субъекта с сильно развитым зобом, некоторой степенью выпуклости глаз, которая, к тому же на ваших глазах меняется в своей величине, частым и неравномерным пульсом, ундуляцией шейных вен, частым и прерывистым дыханием. И уже только по одному этому вы можете предполагать, что имеете дело с базедовой или гревсовой болезнью.
Но возникает вопрос: в каком отделе сердца искать причину расстройства легочного кровообращения? Помним, что пациентка задыхается, и, в основном, это привело ее к врачу. Что же нашел Боткин своим не очень тонким пальцем? Так вот там было безвоздушное состояние легочной ткани, то есть ателектаз. То есть с помощью рук и с помощью ушей Боткин в 1867-м году нашел сдавление легочной ткани левым предсердием. И он говорит, что именно там надо искать причину одышки. Более того, рассказывает, что «увеличение и правого желудочка, которое встречается чаще, чем левого у пациентов, как он говорит с гипертиреозом, все-таки есть явление непостоянное, а объем левого предсердия увеличивается, повторяю, обязательно. И вы усматриваете на нем, кроме того, колебания в размере (то есть один день так, другой день по-другому) совпадающие с ухудшением и улучшением субъективного состояния больных, которое идет, таким образом, рядом с этим увеличением или уменьшением размеров тупого звука».
Что же это было? Забытая болезнь? Я не говорю сейчас о гипертиреозе. Я сейчас хочу переключить внимание на предсердие. В этих же своих клинических лекциях он говорит, что «достаточно уже одной слабости предсердия, чтобы в нем происходил застой крови, а также в венах, в него впадающих, которые таким образом расширяются, клапаны их становятся недостаточными, и даются условия для появления этой ундуляции, которую мы наблюдаем в различных формах ослабленной деятельности сердца и недостаточно быстрого опорожнения предсердий».
В этом году, я уже упомянула, мы отмечаем 180 лет со дня рождения Сергея Петровича Боткина. И когда читаешь Боткина, понимаешь, насколько он современен, насколько, с одной стороны, мы далеко ушли, а с другой стороны, и не очень далеко ушли в диагнозе некоторых заболеваний.
Итак, предсердная болезнь, забыта ли она? Нет, и многие ученые занимаются этой проблемой. Есть разные определения, одно из них представлено на слайде и принадлежит академику Ивашкину: Предсердная болезнь представляет собой первичную или вторичную патологию предсердий, которая манифестирует атриомегалией, различными нарушениями ритма и проводимости, симптомами недостаточности кровообращения.
И такие же факторы риска наличия атриомегалии. Мы их тоже можем подразделить на корригируемые и не корригируемые. Нас, конечно, интересуют корригируемые, и сегодня в большей степени я буду говорить об артериальной гипертензии. Вообще мы только что видели, что артериальная гипертензия и хроническая сердечная недостаточность – это практически основная причина фибрилляции предсердий, нарушений ритма сердца. И меня всегда мучил вопрос: ведь артериальная гипертензия – это состояние, когда гипертрофируется левый желудочек. Почему же возникают наджелудочковые нарушения ритма чаще, чем желудочковые? Я до сих пор не могу понять почему, но в этой схеме, наверное, есть определенные ответы. Потому что предсердия – это слабое звено. И когда идет повышение давления в предсердиях по градиенту давления, так как левый желудочек толстый или гипертрофированный, тоже внутри себя увеличивает давление, то долго гипертрофироваться предсердие не может, оно дилятируется – и, пожалуйста, фибрилляция предсердий. Поэтому фиброз в предсердиях, атриомегалия – и отсюда нарушение проведения электрического импульса, когда уже фибрилляция уже порождает фибрилляцию. Вот, собственно говоря, мне кажется, то, что характеризует данного пациента.
И поэтому мы говорим снова о фиброзе. Мы, с другой как будто стороны, с клинической подходим к фиброзу. И есть опять же много определений, но мне, например, нравятся простые определения, над которыми не надо долго думать и их хорошо и легко можно запомнить: это преобладание синтеза коллагена над его распадом. Речь, конечно, идет о структурном коллагене, о том коллагене, который образует потом трехспиральную структуру, очень прочную. И понятно, что когда он уже образовался, его повернуть вспять или увеличить деградацию очень сложно.
Различные типы фиброза. Вот два портрета пациента. Красным – кардиомиоцит, серым – фиброз. Понятно, что предметом нашего интереса, конечно, служит верхняя картинка, там, где есть реактивный фиброз – это как раз тот самый гипертоник, которого как будто бы правильно лечили. Он не умер от инфаркта или инсульта, он не произошел. Но что у него произошло? У него произошла гипертрофия левого желудочка, которую мы рассматриваем как практически неотъемлемую черту артериальной гипертензии. Но, в принципе, наверное, надо вмешиваться чуть раньше – тогда, когда даже этого реактивного фиброза еще пока не появилось.
Таким образом, я хочу постулировать, что, на мой взгляд, фиброз – это одно из самых ранних проявлений предсердной болезни. И поэтому возникает вопрос: как оценить, как предотвратить, вообще возможно ли это, и когда начать лечение и какое?
Обратите внимание, уважаемые коллеги, на этой картинке мы видим тоже кардиомиоцит, такой вездесущий цитокин – трансформирующий фактор роста б-типа – именно он повинен в том, что запускаются процессы фиброза, образуется коллаген и другие белки межклеточного матрикса.
Давайте посмотрим, чем активируется этот цитокин – ангиотензин-II, хорошо нам известный, а с другой стороны, механическое растяжение. То есть любая большая камера, желудочек или предсердие, сама по себе будет приводить к тому, что TGF-бета активность его будет увеличиваться. Он будет приводить к тому, что кардиомиоциты сменяются, как бы генотипически превращаются в фибробласты, и образуется коллаген, а затем и образуется фиброз.
Этот момент нас крайне интересует, и я коротко хочу показать хронику, факты и комментарии по поводу атриомегалии. В первой работе была поставлена цель обосновать клинические последствия дилатации предсердий при заболеваниях сердечно-сосудистой и бронхо-легочной систем. Первое, мы поняли, что при размере левого предсердия более 4,7см, у правого предсердия – более 4,8см, 100% появляются и персистируют клинические симптомы хронической сердечной недостаточности: одышка, цианоз, мелкопузырчатые хрипы в легких. То есть наличие мелкопузырчатых хрипов в легких совершенно четко коррелирует с размером левого предсердия.
Вот, на мой взгляд, очень интересные, странные на первый взгляд кривые. Но что они характеризуют? Зеленая кривая изображает тот процент пациентов с атриомегалией, у которых первый тон сохранен. И мы видим, что чем больше размер левого предсердия, тем меньше пациентов с сохраненным первым тоном. Мы всегда знаем, что первый тон – это характеристика левого желудочка, это систолический тон. И в то же время, чем больше размер левого предсердия, тем больше пациентов с ослабленным первым тоном. То есть это ли не проявление сердечной недостаточности?
Первый шаг. Таким образом, первым шагом был поиск, и мы нашли, что «критическими» размерами изолированной дилатации левого предсердия, после которой обязательно присоединится дилатация правого предсердия, служат величины 4,2Х4,4Х4,7 см.
Второй шаг. Нужно ли оценивать сократительную функцию предсердий, и вообще зачем она нужна? Казалось, это всего лишь 25%, а иногда и 15% в наполнении левого желудочка. И в принципе, это тоже определенная характеристика диастолической сердечной недостаточности. Обратите внимание, уважаемые коллеги, очень сильно напоминает эта кривая кривую закона Франка-Старлинга: чем больше максимальный объем левого предсердия, тем до определенного момента возрастает и объем активного опорожнения. Но, как я уже сказала, «слабое звено» 4-хкамерного органа: быстро истощается, и уже с большим увеличением левого предсердия объем активности снижается.
Мы хорошо знаем оценку фракции фиброза в межжелудочковой перегородке. На правой картинке показано, как мы ее обводим и с помощью специальных методов вычисляем. Так же можно определять размеры фракций фиброза, чуть более, наверное, этот процесс будет трудоемкий, в межпредсердной перегородке.
Зубец Р. Если посмотреть на Р, то, конечно, нам дается уникальная возможность оценить скорость проведения электрического импульса по предсердиям. Это традиционные р- mitrale, р-pulmonale, но и не только PQ как интервал, но и сегмент PQ, конечно, и соотношение дают нам очень много информации о том, что происходит с предсердием. Кроме того, очень легко в помощь практическому врачу можно рассчитать объем левого предсердия по данной формуле: Индекс конечно-систолического объема левого предсердия (мл) = 8,0 + 0,2* (длительность зубца Р в мс).
И совершенно потрясающую информацию в плане предуготованности предсердий к суправентрикулярным нарушениям ритма дает индекс функции левого предсердия, который высчитывается как отношение фракции опорожнения на интеграл линейной скорости выносящего тракта левого желудочка к индексу объема левого предсердия.
В этой же работе оценивалась скорость проведения электрического импульса по предсердиям. И тоже этот интервал, более 165мс, который измерен с помощью эхокардиографического исследования, плюс ЭКГ-датчики, говорит, что вот этот пациент представляет риск в плане возникновения фибрилляции предсердий.
Вот наши данные. Рябым серым – это объем левого предсердия, а просто серым – это фракция выброса левого предсердия. Контроль – пациенты с пароксизмальной формой фибрилляции предсердий (первые два столбика). Оказалось, что чем больше объем левого предсердия, тем неминуемо будет уменьшаться фракция выброса левого предсердия. Зачем это делать? Только ли это теория? На мой взгляд, нет. И сегодня оценка сократительной функции левого предсердия дает нам ключ к диагностике предсердной болезни сердца, выявление пациентов не просто с атриомегалией, а со сниженной сократительной функцией. И, на мой взгляд, это, конечно, поиск новых антиаритмиков (а у нас практически всего два антиаритмика, и все с различными побочными эффектами), и поиск того, что не только, наверное, мы можем пользоваться и должны пользоваться нашими обычными антиаритмиками.
Шаг третий. Клинико-морфофункциональная характеристика атриомегалии у больных с хронической сердечной недостаточностью и нарушением тиреоидного статуса. Обратите внимание, пациенты с ХСН вместе с гипертиреозом с гипотиреозом и контрольная группа: у всех пациентов изменен размер левого предсердия. Давайте вспомним Боткина еще раз, он говорил: «Всегда я вижу изменение в размере левого предсердия, которое совпадает с ухудшением и улучшением субъективных состояний». Гипотеза проверена – так оно и есть. А с правым предсердием таких различий в данной работе мы не получили.
Шаг четвертый. Биологические маркеры СН. И наконец еще раз про фиброз. У пациентов с диастолической сердечной недостаточностью, которые соответствовали всем критериям, мы посмотрели галектин-3, растворимый бета-галактозид связывающий белок. Он представляет собой семейство лектинов. Оказалось, что у пациентов с сохраненной фракцией выброса уровень выброса галектина-3 100% выше, чем у пациентов со сниженной фракцией выброса, что тоже с определенной дозой допущения говорит о том, что фиброз у таких пациентов будет выражен в большей степени.
Таким образом, мы можем постулировать, что фиброз – это морфологическая основа тахиаритмий. Здесь есть масса литературных результатов, вот взятая из журнала иллюстрация, срез легочной вены около ее устья. Собственно говоря, как раз там обычно проводят различные манипуляции, для того чтобы перевести праксизмальную форму фибрилляции предсердий в синусовый ритм.
И опять «повинен» ангиотензин-II. Значит, помимо обычных антиаритмиков, к этой терапии должны быть добавлены агенты, которые будут снижать активность ренин-ангиотензин-альдостероновой системы.
Если мы посмотрим на все гормоны, и как они влияют на синтез коллагена, деградацию коллагена и аккумуляцию коллагена, самым плохим персонажем здесь будет ангиотензин-II. Он повышает синтез, он снижает деградацию, и аккумуляция коллагена намного больше. Вторым по «плохости» выступает альдостерон.
Это пример пациента после перенесенного инфаркта миокарда. Обратите внимание, его сердце, через четыре недели после инфаркта миокарда: желто-красным – это центры связывания ангиотензинпревращающего фермента. Здесь не только мы видим в зоне инфаркта миокарда, как бы сбоку, но и EF – это значит эндокардиальный фиброз. PF – это перикардиальный фиброз. Много фиброза – есть на что подействовать, и то же самое с плотностью АТ-рецепторов, например, спустя четыре недели.
Еще раз восклицаю: нужен новый подход! И надо подумать о создании средств, которые селективно воздействуют на предсердия. Есть ли такие средства? Вот их список, пока такой. Я буду каждую интернет-сессию, на каждом из этих лекарств останавливаться.
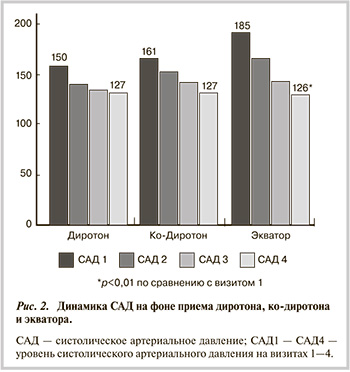
Сегодня черед ингибиторов АПФ. И действительно, и Ольга Николаевна это показывала, ингибиторы АПФ и в эксперименте, и уже не только в эксперименте, продемонстрировали влияние на фиброз. Мы видим, например, за шесть месяцев всего Лизиноприл – 9%. За год Периндоприл – это 22%. И Лозартан тоже показал свою возможность – за год 36%.
Я с большим удовольствием хочу представить не только многочисленные зарубежные данные, но и нашу работу, многоуважаемого профессора Татарского из Санкт-Петербурга. Он посмотрел, при пароксизмальной форме фибрилляции предсердий добавление к стандартной терапии Лизиноприла приводило к уменьшению частоты пароксизмов, длительности эпизодов аритмии, более легкой переносимости и трансформации в бессимптомную форму.
В нашей практике чаще всего Лизиноприлом мы пользуемся как раз Диротоном. Диротон – это не оригинальный препарат, это тоже дженерик, но тем не менее его потенциал, вообще ингибиторов АПФ, в плане фиброза пока еще не раскрыт.
«Предсердный крест». Молекулярные и клеточные механизмы.
Будем заниматься этим «предсердным крестом». Мы только к нему приблизились, а сколько еще всего, что написано мелкими буквами. Я думаю, что это все будет крайне увлекательно и, наверное, сложно. Призываю работать вместе с нами.
Дефект межжелудочковой перегородки
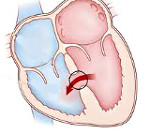
Дефект межжелудочковой перегородки – врожденная внутрисердечная аномалия, характеризующаяся наличием сообщения между правым и левым желудочками. Дефект межжелудочковой перегородки проявляется одышкой, отставанием в физическом развитии, быстрой утомляемостью, учащенным сердцебиением, наличием «сердечного горба». Инструментальная диагностика дефекта межжелудочковой перегородки включает проведение ЭКГ, ЭхоКГ, рентгенографии органов грудной клетки, вентрикулографии, аортографии, катетеризации камер сердца, МРТ. При дефектах межжелудочковой перегородки проводят радикальные (закрытие дефекта) и паллиативные (сужение легочной артерии) вмешательства.
МКБ-10
Общие сведения
Дефект межжелудочковой перегородки (ДМЖП) – отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки – наиболее часто встречающийся врожденный порок сердца (9–25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Причины дефекта межжелудочковой перегородки
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже), средний – равен примерно 1/2 диаметра аортального отверстия, большой – равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
Симптомы дефекта межжелудочковой перегородки
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.