Фибриновый сгусток что это такое
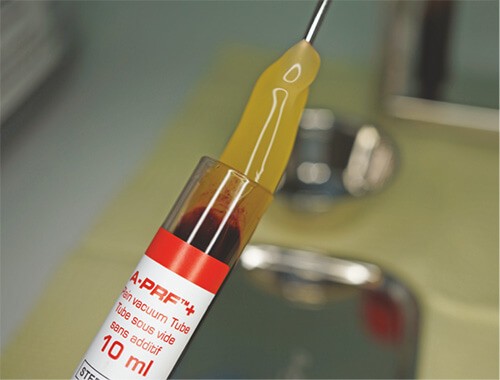
Фибриновый сгусток APRF
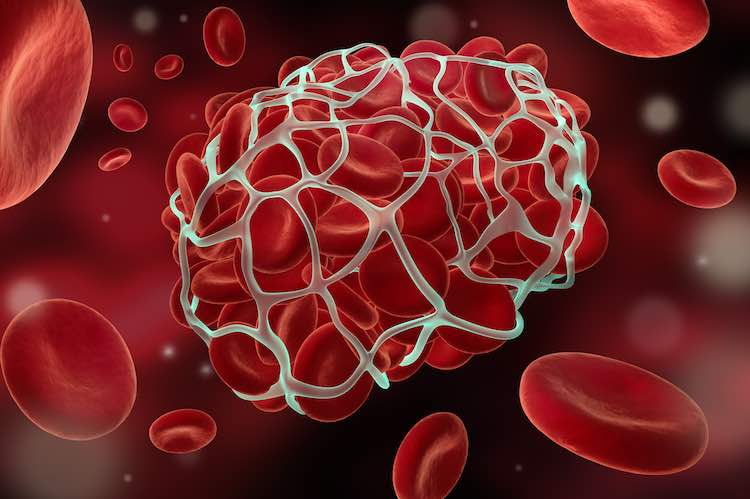
При заживлении тканей после хирургического вмешательства достаточно простой – в рану сразу после травмирующего действия устремляются тромбоциты. Они способствуют образованию кровяных сгустков, закрывая места разрывов и останавливая кровотечение. Одним из элементов, принимающих активное участие в процессе, является фибрин. Это природный волокнистый белок, образующий сетку, в ячейках которой застревают тромбоциты. То есть действие заключается в формировании природной тончайшей мембраны, ускоряющей заживление. Под воздействием фибрина также ускоряется рост новых тканей.
Такой принцип действия лежит в основе применения фибриновых сгустков в стоматологии. Препарат получают из крови Пациента, затем материал помещается в рану, способствуя заживлению и исключая воспалительные процессы.
Технология получения
Технология изготовления препарата доступная, состоит из следующих шагов:
Сфера применения
Обогащенный фибрин официально признан в качестве препарата с эффективным действием при заживлении и регенерации после оперативного вмешательства. Одной из областей, где препарат используется наиболее активно, является стоматология. Мембраны показывают отличные результаты при имплантации, лечении мягких тканей, восстановлении кости.
Назначение, основные свойства
Фибрин I-PRF в жидком виде получается сразу после проведения центрифунгирования, но до момента коагуляции. Если планируется применение именно в такой форме, работать надо быстро, так как через две-три минуты происходит коагуляция. Средство используется различными способами, включая прямые инъекции с десну при терапии пародонтита. Такие действия не только способствуют быстрому заживлению и устранению воспаления, но и помогают в обновлении тканей.
Фибриновые мембраны активно используются в хирургии, при челюстно-лицевой пластики. Для этого применяются коагулированные препараты, помогая в быстрой регенерации. Технология востребована в имплантации. Использование такого покрытия обеспечивает безопасную и быструю интеграцию искусственного корня с окружающими костными тканями.
Свойства препаратов в жидкой и коагулированной форме различаются. Врач должен это учитывать, как и назначение сгустка, особенности работы, состояние тканей и другие факторы.
Преимущества и недостатки
Использование фибриновых мембран в стоматологии практикуется хирургами практически всех стран мира. Отличные результаты подтверждаются многими клиническими исследованиями и заключениями самих врачей. К преимуществам такой технологии относятся:
Противопоказаний или минусов у технологии применения мембран практически нет. Происходит это причине изготовления препарата на основе крови Пациента, то есть риски отторжения или развития воспалительных процессов практически отсутствуют. Побочных эффектов применения также практически нет.
Фибриноген в крови: норма

В клинической практике врачей иногда встречаются такие ситуации: у человека наблюдаются частые кровотечения, или же, наоборот, в его организме избыточно формируются тромбы, что приводит к тромбозам крупных вен.
За отлаженную деятельность системы свертывания крови отвечает множество элементов крупной цепи системы коагуляции. Фибриноген — один из элементов этой цепи: без этого белка невозможна корректная работа гомеостатического звена. Нередко врачи назначают определение уровня фибриногена в крови, чтобы определиться с состоянием системы коагуляции человека.
Фибриноген — что это?
Фибриноген — это белок свертывающей системы крови, который обновляется печенью регулярно, в течение 3—5 дней. В момент, когда активируется система свертывания крови в плазме, тромбин (другой важный элемент системы свертывания крови) активирует превращение фибриногена в фибрин, что крайне важно для формирования тромба. Фибриноген — это белок—мономер, а фибрин — полимер, то есть, белковая цепь, которая является основой формирования тромба.
Норма фибриногена в крови человека составляет 2—4 мг/л. Если значение снижается, то человеку запрещены оперативные вмешательства — существует высокий риск кровотечения. Если же фибриноген повышен, то есть высокая вероятность тромбоза сосудов у пациентов, особенно формирования тромбов в глубоких венах нижних конечностей. Тромбоз глубоких вен — это высокий риск смертельного осложнения — тромбоэмболии легочной артерии.
Уровень белка обязательно проверяют перед хирургическими вмешательствами, перед плановыми родами, при патологиях гепатобилиарной системы. Особенно важно определить концентрацию фибриногена у пациентов, имеющих заболевания системы сердца и сосудов; страдающих от повышенного тромбообразования, или, наоборот, кровоточивости.
Что значит фибриноген для организма человека? Белок выполняет ряд важнейших функций:
Если при определении нормы фибриногена в организме человека было обнаружено, что белок повышен, то, скорее всего, организм находится в активной стадии борьбы с воспалительным процессом. Нередко при этом повышается и показатель скорости оседания эритроцитов, а также специальный диагностический маркер воспаления и некроза тканей. Если фибриноген повышен у беременной женщины, то это считается вариантом нормы: в период гестации немного меняется функционирование многих систем организма женщины, в частности, системы свертывания крови.
У пожилых пациентов повышение фибриногена опасно: доктор должен насторожиться из—за повышения рисков развития заболевания сердца и сосудов.
Когда назначается исследование?
Определение фибриногена в крови врачи назначают в таких клинических ситуациях:
Фибриноген норма у женщин особенно важна для определения во время беременности. Беременная женщина должна сдавать анализ на фибриноген один раз в триместр для того, чтобы доктор мог вовремя предупредить развитие осложнений.
Для чего используется исследование?
Доктора применяют диагностику для:
Норму фибриногена в крови врачи также определяют на разных этапах лечения пациента для оценки состояния организма человека, интенсивности восстановительных процессов.
Исследование активно используется на предоперационном этапе, а также при подозрении на наличие у пациента воспалительных заболеваний. Интересно, что фибриноген известен, как один из факторов крови, используемых в «ревматических пробах». Давно доказано, что отклонение значительное отклонение от нормы фибриногена наблюдается при ревматических, аутоиммунных процессах, а также при повреждениях тканей.
Методика определения
Как правило, фибриноген в крови определяют при заборе у пациента венозной крови на биохимическое исследование или коагулограмму.
Определение уровня фибриногена в крови — довольно сложная процедура. Существует множество методик для оценки количества этого белка в сыворотке крови. Наиболее часто в лаборатории определяют время свертывания цитратной плазмы, используя избыток тромбина. Для оценки концентрации фибриногена используют специальную калибровочную кривую.
Норма фибриногена
Норма фибриногена, принятая за основу, была обнаружена с помощью клинических исследований различных групп людей.
Таблица 1. Норма фибриногена у разных групп пациентов
| Группа пациентов | Норма фибриногена, г/л |
| Взрослые мужчины и женщины | 2—4 |
| Беременные женщины (наибольшее значение для 3 триместра) | 6—7 |
| Новорожденные дети | 1,25—3 |
Регуляция концентрации фибриногена в крови зависит от множества различных факторов. На уровень белка влияет половая принадлежность, возраст, общее состояние организма и деятельность человека.
Нормой фибриногена в целом, по популяции, принято считать усредненное значение: исследователи провели диагностику здоровых пациентов из каждой указанной категории, а затем определили среднюю величину фибриногена для здорового человека.
Расшифровка анализа на фибриноген
Интерпретацию анализа проводит лечащий врач, который назначил пациенту диагностику (терапевт, кардиолог, гематолог, хирург или другой специалист).
Фибриноген — это белок, повышение которого говорит о протекании у человека острой фазы воспалительного процесса. Если фибиноген повышен у пациента (выше 4 г/л), то доктор может заподозрить повреждение тканей внутри организма или наличие активного воспаления. При этом, причину повышения фибриногена еще предстоит определить: белок является лишь маркером воспаления. Нередко повышение уровня фибриногена значительно увеличивает риск возникновения осложнений сердечно—сосудистых заболеваний, если они имеются у пациента.
Иногда фибриноген в крови понижен (ниже 2 г/л), что может стать следствием переливания крови человеку. Кроме того, некоторые лекарственные средства могут снижать уровень фибриногена в крови — к примеру, стероидные анаболические препараты, урокиназа, стрептокиназа.
Иногда у человека после анализа на фибриноген обнаруживают дисфибриногемию. Это наследственное нарушение, при котором происходят мутации на генном уровне: нарушается выработка фибриногена в печени. Зачастую патология приводит к активному формированию венозных тромбов, редко — к кровотечениям. В зависимости от клинической картины доктор предложит пациенту варианты терапии дисфибриногемии.
Наконец, проводились исследования, в ходе которых было доказано, что активный прием лекарственных средств, содержащих некоторые жирные кислоты (омега—3, омега—6), оказывает отрицательное влияние на уровень фибриногена. Белок может снижаться на фоне приема этих препаратов.
О конкретных причинах повышения или снижения уровня фибриногена сможет сказать пациенту исключительно лечащий врач. После сбора жалоб, данных анамнеза, осмотра пациента и выполнения дополнительных методов диагностики у врача на руках будет полная картина о состоянии здоровья человека.
Затем доктор предложит схему лечения, тактику терапии, и будет наблюдать пациента в динамике.
Фибриноген при беременности
Акушеры—гинекологи должны внимательно контролировать норму фибриногена у женщин в период беременности. В первом триместре показатель должен составлять 2,98 г/л. Возможно некоторое снижение нормы фибриногена в крови в первом триместре, что связано с токсикозом.
Во втором триместре наблюдается повышение уровня фибриногена, как правило, до 3,1 г/л. В третьем триместре концентрация белка значительно повышена и составляет 4,95—6 г/л.
Своевременный контроль нормы фибриногена у женщин в период беременности позволяет предотвратить следующие патологические состояния матери или ребенка:
Беременная женщина, как правило, сдает коагулограмму (анализ на полный спектр ферментов свертывающей системы крови) несколько раз в течение всего срока гестации.
Анализ на уровень фибриногена, выполненный на начальных этапах беременности, говорит о первичных уровнях фибриногена в организме матери. Диагностика в течение беременности показывает протекание гестации, а анализ непосредственно перед родами укажет на риски тромбоза и покажет готовность организма матери к процессу родов.
Фибриноген понижен
Снижение концентрации фибриногена в крови приводит к тому, что значительно снижается способность крови к свертыванию. Это значит, что любая незначительная травма может привести к длительному кровотечению. Доктора выделяют как врожденные, так и приобретенные причины снижения количества фибриногена.
К главным причинам снижения уровня фибриногена относятся:
Иногда у пациентов снижается уровень фибриногена из—за активного употребления рыбьего жира. Вероятно, это связано с большим содержанием в этом продукте жирных кислот — омега—3 и омега—6. Сниженный уровень белка наблюдается иногда и у вегетарианцев. Важно помнить, что снижение концентрации фибриногена менее чем 0,5—1 г/л существенно повышает риск кровотечения из внутренних органов.
При сниженном фибриногене врачу необходимо определить причины отклонения показателя от нормы. Для того, чтобы не терять время, доктор может назначать препараты, которые искусственным путем способствуют образованию кровяных сгустков: аминокапроновая кислота, дицинон, викасол. Одновременно лечащий врач рекомендует пациенту скорректировать рацион, добавить в ежедневные приемы пищи продукты, богатые белком (яйца, мясо, бобовые).
Фибриноген повышен
Если фибриноген повышен, то можно говорить о том, что систему гомеостаза пациента активировал какой—то фактор: по этой причине возникла необходимость в избыточном образовании тромбов. Зачастую это происходит на фоне протекания у человека активного воспалительного процесса.
Фибриноген в крови повышается из—за следующих состояний:
Следует помнить, что физиологическое повышение фибриногена наблюдается у женщин во время беременности. Максимальная концентрация белка при этом могут достигать 7 г/л. Нередко фибриноген повышен у пациентов с повышенным индексом массы тела.
Для коррекции состояния врач определяет причину отклонения от нормы фибриногена показателя пациента, а затем назначает необходимую схему лечения.
Нередко для коррекции уровня фибриногена используют антиагреганты и антикоагулянты, тромболитики и фибринолитики. Эти группы препаратов назначает исключительно лечащий врач, потому что их прием должен происходить под контролем специалиста.
Как в случае и со снижением фибриногена, доктор рекомендует пациенту пересмотреть рацион: добавить больше морепродуктов, рыбы, красных ягод, какао и горького черного шоколада.
Подготовка к анализу
Оценка уровня фибриногена проводится при сдаче пациентом классического биохимического анализа крови или крови на коагулограмму. В этом случае в лаборатории у человека набирают венозную кровь. Для получения корректного результата перед исследованием необходимо строго соблюдать несколько правил.
За 10—12 часов до забора крови запрещено употреблять пищу, то есть, на исследование необходимо прийти натощак. За 2—3 суток до диагностики следует отказаться от жирной и жареной еды, алкоголя. Если вы активно занимаетесь физическими нагрузками, то до исследования необходимо снизить их количество. Курить разрешено лишь за 40 минут до забора крови.
Перед назначением исследования необходимо обсудить с лечащим врачом препараты, которые вы принимаете регулярно. Возможно, придется на некоторое время приостановить прием лекарственных средств для получения корректного результата.
Фибриноген у детей
В детском возрасте (до 18 лет) норма фибриногена в крови слегка отличается от «взрослых» показателей. Вне зависимости от пола, у детей нормой фибриногена считается значение 1,25—4 г/л. Исключением из этой группы становятся новорожденные дети, у которых значение фибриногена колеблется в пределах 1,25—3 г/л.
Показатель фибриногена у детей отличается от «взрослых» значений потому, что в детском возрасте система гомеостаза еще формируется, как и многие другие системы организма. С течением времени норма фибриногена у ребенка приближается к «взрослым» цифрам.
Как видно, ответ на вопрос о значении фибриногена для организма человека далеко не однозначен, как ожидалось. Уровень фибриногена в крови человека зависит от множества факторов, а повышение или снижение его концентрации нередко становится важнейшим маркером воспалительного процесса. Лабораторный симптом повышения или снижения белка — яркий маркер, который позволит врачу заподозрить некоторые патологии у пациента. Доктора активно используют анализ на фибриноген для оценки системы гомеостаза пациентов, назначения схемы лечения и контроля динамики терапии пациентов.
Как работает свертывание крови?
Формирование тромба в кровотоке. Кровеносный сосуд заполнен клетками крови значительно плотнее, чем показано на этом рисунке, так что ситуация там напоминает давку при входе на эскалатор в метро. Маленькие и относительно немногочисленные белые клетки — тромбоциты: справа можно видеть, как они активируются, меняют форму и прикрепляются к стенке сосуда, формируя агрегат — тромб.
Автор
Редакторы
Свертывание крови — крайне сложный и во многом еще загадочный биохимический процесс, который запускается при повреждении кровеносной системы и ведет к превращению плазмы крови в студенистый сгусток, затыкающий рану и останавливающий кровотечение. Нарушения этой системы крайне опасны и могут привести к кровотечению, тромбозу или другим патологиям, которые совместно отвечают за львиную долю смертности и инвалидности в современном мире. Здесь мы рассмотрим устройство этой системы и расскажем о самых современных достижениях в ее изучении.
Каждый, кто хоть раз в жизни получал царапину или рану, приобретал тем самым замечательную возможность наблюдать превращение крови из жидкости в вязкую нетекучую массу, приводящее к остановке кровотечения. Этот процесс называется свертыванием крови и управляется сложной системой биохимических реакций.
Иметь какую-нибудь систему остановки кровотечения — абсолютно необходимо для любого многоклеточного организма, имеющего жидкую внутреннюю среду. Свертывание крови является жизненно необходимым и для нас: мутации в генах основных белков свертывания, как правило, летальны. Увы, среди множества систем нашего организма, нарушения в работе которых представляют опасность для здоровья, свертывание крови также занимает абсолютное первое место как главная непосредственная причина смерти: люди болеют разными болезнями, но умирают почти всегда от нарушений свертывания крови. Рак, сепсис, травма, атеросклероз, инфаркт, инсульт — для широчайшего круга заболеваний непосредственной причиной смерти является неспособность системы свертывания поддерживать баланс между жидким и твердым состояниями крови в организме.
Если причина известна, почему же с ней нельзя бороться? Разумеется, бороться можно и нужно: ученые постоянно создают новые методы диагностики и терапии нарушений свертывания. Но проблема в том, что система свертывания очень сложна. А наука о регуляции сложных систем учит, что управлять такими системами нужно особым образом. Их реакция на внешнее воздействие нелинейна и непредсказуема, и для того, чтобы добиться нужного результата, нужно знать, куда приложить усилие. Простейшая аналогия: чтобы запустить в воздух бумажный самолетик, его достаточно бросить в нужную сторону; в то же время для взлета авиалайнера потребуется нажать в кабине пилота на правильные кнопки в нужное время и в нужной последовательности. А если попытаться авиалайнер запустить броском, как бумажный самолетик, то это закончится плохо. Так и с системой свертывания: чтобы успешно лечить, нужно знать «управляющие точки».
Вплоть до самого последнего времени свертывание крови успешно сопротивлялось попыткам исследователей понять его работу, и лишь в последние годы тут произошел качественный скачок. В данной статье мы расскажем об этой замечательной системе: как она устроена, почему ее так сложно изучать, и — самое главное — поведаем о последних открытиях в понимании того, как она работает.
Как устроено свертывание крови
Остановка кровотечения основана на той же идее, что используют домохозяйки для приготовления холодца — превращении жидкости в гель (коллоидную систему, где формируется сеть молекул, способная удержать в своих ячейках тысячекратно превосходящую ее по весу жидкость за счет водородных связей с молекулами воды). Кстати, та же идея используется в одноразовых детских подгузниках, в которые помещается разбухающий при смачивании материал. С физической точки зрения, там нужно решать ту же самую задачу, что и в свертывании — борьбу с протечками при минимальном приложении усилий.
Свертывание крови является центральным звеном гемостаза (остановки кровотечения). Вторым звеном гемостаза являются особые клетки — тромбоциты, — способные прикрепляться друг к другу и к месту повреждения, чтобы создать останавливающую кровь пробку.
Общее представление о биохимии свертывания можно получить из рисунка 1, внизу которого показана реакция превращения растворимого белка фибриногена в фибрин, который затем полимеризуется в сетку. Эта реакция представляет собой единственную часть каскада, имеющую непосредственный физический смысл и решающую четкую физическую задачу. Роль остальных реакций — исключительно регуляторная: обеспечить превращение фибриногена в фибрин только в нужном месте и в нужное время.
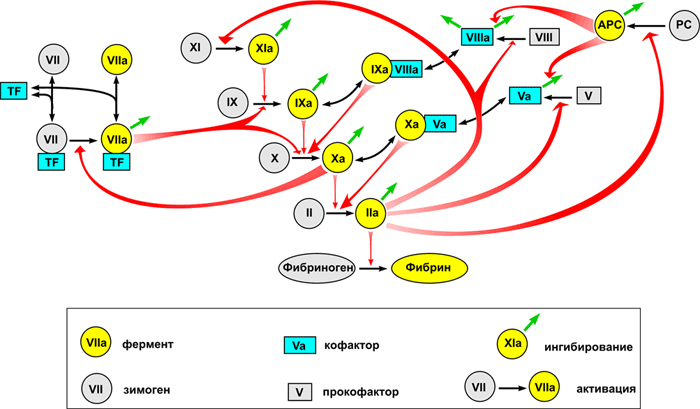
Рисунок 1. Основные реакции свертывания крови. Система свертывания представляет собой каскад — последовательность реакций, где продукт каждой реакции выступает катализатором следующей. Главный «вход» в этот каскад находится в его средней части, на уровне факторов IX и X: белок тканевый фактор (обозначен на схеме как TF) связывает фактор VIIa, и получившийся ферментативный комплекс активирует факторы IX и X. Результатом работы каскада является белок фибрин, способный полимеризоваться и образовывать сгусток (гель). Подавляющее большинство реакций активации — это реакции протеолиза, т.е. частичного расщепления белка, увеличивающего его активность. Почти каждый фактор свертывания обязательно тем или иным образом ингибируется: обратная связь необходима для стабильной работы системы.
Обозначения: Реакции превращения факторов свертывания в активные формы показаны односторонними тонкими черными стрелками. При этом фигурные красные стрелки показывают, под действием каких именно ферментов происходит активация. Реакции потери активности в результате ингибирования показаны тонкими зелеными стрелками (для простоты стрелки изображены как просто «уход», т.е. не показано, с какими именно ингибиторами происходит связывание). Обратимые реакции формирования комплексов показаны двусторонними тонкими черными стрелками. Белки свертывания обозначены либо названиями, либо римскими цифрами, либо аббревиатурами (TF — тканевый фактор, PC — протеин С, APC — активированный протеин С). Чтобы избежать перегруженности, на схеме не показаны: связывание тромбина с тромбомодулином, активация и секреция тромбоцитов, контактная активация свертывания.
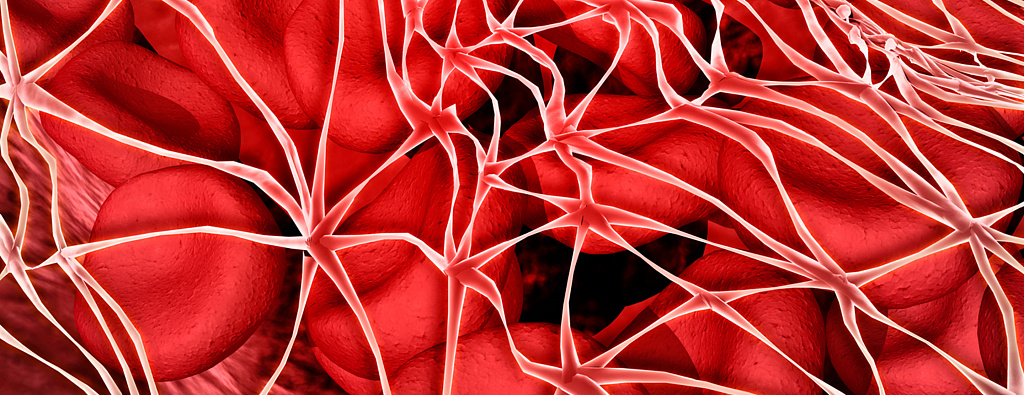
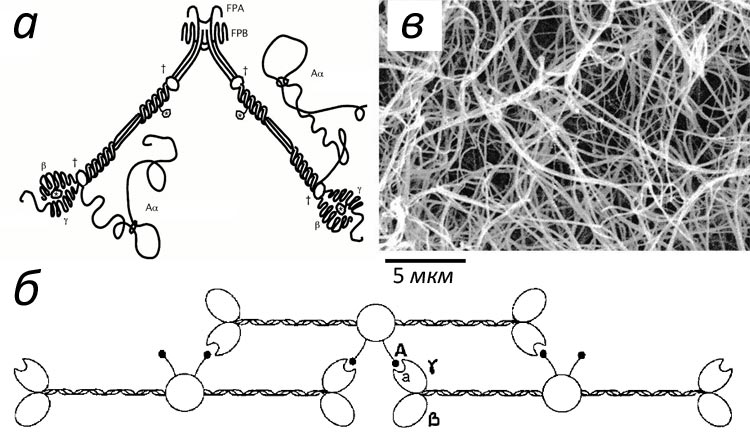
Фибриноген напоминает стержень длиной 50 нм и толщиной 5 нм (рис. 2а). Активация позволяет его молекулам склеиваться в фибриновую нить (рис 2б), а затем в волокно, способное ветвиться и образовывать трехмерную сеть (рис. 2в).
Рисунок 2. Фибриновый гель. а — Схематическое устройство молекулы фибриногена. Основа ее составлена из трех пар зеркально расположенных полипептидных цепей α, β, γ. В центре молекулы можно видеть области связывания, которые становятся доступными при отрезании тромбином фибринопептидов А и Б (FPA и FPB на рисунке). б — Механизм сборки фибринового волокна: молекулы крепятся друг к другу «внахлест» по принципу головка-к-серединке, образуя двухцепочечное волокно. в — Электронная микрофотография геля: фибриновые волокна могут склеиваться и расщепляться, образуя сложную трехмерную структуру.
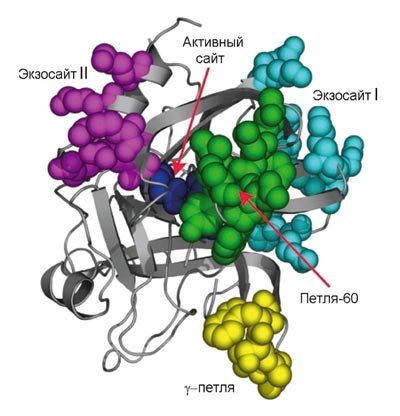
Рисунок 3. Трехмерная структура молекулы тромбина. На схеме показаны активный сайт и части молекулы, ответственные за связывание тромбина с субстратами и кофакторами. (Активный сайт — часть молекулы, непосредственно распознающее место расщепления и осуществляющее ферментативный катализ.) Выступающие части молекулы (экзосайты) позволяют осуществлять «переключение» молекулы тромбина, делая его мультифункциональным белком, способным работать в разных режимах. Например, связывание тромбомодулина с экзосайтом I физически перекрывает доступ к тромбину прокоагулянтным субстратам (фибриноген, фактор V) и аллостерически стимулирует активность по отношению к протеину C.
Активатор фибриногена тромбин (рис. 3) принадлежит к семейству сериновых протеиназ — ферментов, способных осуществлять расщепление пептидных связей в белках. Он является родственником пищеварительных ферментов трипсина и химотрипсина. Протеиназы синтезируются в неактивной форме, называемой зимогеном. Чтобы их активировать, необходимо расщепить пептидную связь, удерживающую часть белка, которая закрывает активный сайт. Так, тромбин синтезируется в виде протромбина, который может быть активирован. Как видно из рис. 1 (где протромбин обозначен как фактор II), это катализируется фактором Xa.
Вообще, белки свертывания называют факторами и нумеруют римскими цифрами в порядке официального открытия. Индекс «а» означает активную форму, а его отсутствие — неактивный предшественник. Для давно открытых белков, таких как фибрин и тромбин, используют и собственные имена. Некоторые номера (III, IV, VI) по историческим причинам не используются.
Активатором свертывания служит белок, называемый тканевым фактором, присутствующий в мембранах клеток всех тканей, за исключением эндотелия и крови. Таким образом, кровь остается жидкой только благодаря тому, что в норме она защищена тонкой защитной оболочкой эндотелия. При любом нарушении целостности сосуда тканевой фактор связывает из плазмы фактор VIIa, а их комплекс — называемый внешней теназой (tenase, или Xase, от слова ten — десять, т.е. номер активируемого фактора) — активирует фактор X.
Тромбин также активирует факторы V, VIII, XI, что ведет к ускорению его собственного производства: фактор XIa активирует фактор IX, а факторы VIIIa и Va связывают факторы IXa и Xa, соответственно, увеличивая их активность на порядки (комплекс факторов IXa и VIIIa называется внутренней теназой). Дефицит этих белков ведет к тяжелым нарушениям: так, отсутствие факторов VIII, IX или XI вызывает тяжелейшую болезнь гемофилию (знаменитую «царскую болезнь», которой болел царевич Алексей Романов); а дефицит факторов X, VII, V или протромбина несовместим с жизнью.
Такое устройство системы называется положительной обратной связью: тромбин активирует белки, которые ускоряют его собственное производство. И здесь возникает интересный вопрос, а зачем они нужны? Почему нельзя сразу сделать реакцию быстрой, почему природа делает ее исходно медленной, а потом придумывает способ ее дополнительного ускорения? Зачем в системе свертывания дублирование? Например, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа); это выглядит совершенно бессмысленным.
В крови также присутствуют ингибиторы протеиназ свертывания. Основными являются антитромбин III и ингибитор пути тканевого фактора. Кроме этого, тромбин способен активировать сериновую протеиназу протеин С, которая расщепляет факторы свертывания Va и VIIIa, заставляя их полностью терять свою активность.
Протеин С — предшественник сериновой протеиназы, очень похожей на факторы IX, X, VII и протромбин. Он активируется тромбином, как и фактор XI. Однако при активации получившаяся сериновая протеиназа использует свою ферментативную активность не для того, чтобы активировать другие белки, а для того, чтобы их инактивировать. Активированный протеин С производит несколько протеолитических расщеплений в факторах свертывания Va и VIIIa, заставляя их полностью терять свою кофакторную активность. Таким образом, тромбин — продукт каскада свертывания — ингибирует свое собственное производство: это называется отрицательной обратной связью. И опять у нас регуляторный вопрос: зачем тромбин одновременно ускоряет и замедляет собственную активацию?
Эволюционные истоки свертывания
Формирование защитных систем крови началось у многоклеточных свыше миллиарда лет назад — собственно, как раз в связи с появлением крови. Сама система свертывания является результатом преодоления другой исторической вехи — возникновения позвоночных около пятисот миллионов лет назад. Скорее всего, эта система возникла из иммунитета. Появление очередной системы иммунных реакций, которая боролась с бактериями путем обволакивания их фибриновым гелем, привело к случайному побочному результату: кровотечение стало прекращаться быстрее. Это позволило увеличивать давление и силу потоков в кровеносной системе, а улучшение сосудистой системы, то есть улучшение транспорта всех веществ, открыло новые горизонты развития. Кто знает, не было ли появление свертывания тем преимуществом, которое позволило позвоночным занять свое нынешнее место в биосфере Земли?
У ряда членистогих (таких, как рак-мечехвост) свертывание также существует, но оно возникло независимо и осталось на иммунологических ролях. Насекомые, как и прочие беспозвоночные, обычно обходятся более слабой разновидностью системы остановки кровотечения, основанной на агрегации тромбоцитов (точнее, амебоцитов — дальних родственников тромбоцитов). Этот механизм вполне функционален, но накладывает принципиальные ограничения на эффективность сосудистой системы, — так же, как трахейная форма дыхания ограничивает максимально возможный размер насекомого.
К сожалению, существа с промежуточными формами системы свертывания почти все вымерли. Единственным исключением являются бесчелюстные рыбы: геномный анализ системы свертывания у миноги показал, что она содержит гораздо меньше компонентов (то есть, устроена заметно проще) [6]. Начиная же с челюстных рыб и до млекопитающих системы свертывания очень похожи. Системы клеточного гемостаза также работают по схожим принципам, несмотря на то, что мелкие, безъядерные тромбоциты характерны только для млекопитающих. У остальных позвоночных тромбоциты — крупные клетки, имеющие ядро.
Подводя итог, система свертывания изучена очень хорошо. В ней уже пятнадцать лет не открывали новых белков или реакций, что для современной биохимии составляет вечность. Конечно, нельзя совсем исключить вероятность такого открытия, но пока что не существует ни одного явления, которое мы не могли бы объяснить при помощи имеющихся сведений. Скорее наоборот, система выглядит гораздо сложнее, чем нужно: мы напомним, что из всего этого (довольно громоздкого!) каскада собственно желированием занимается только одна реакция, а все остальные нужны для какой-то непонятной регуляции.
Именно поэтому сейчас исследователи-коагулологи, работающие в самых разных областях — от клинической гемостазиологии до математической биофизики, — активно переходят от вопроса «Как устроено свертывание?» к вопросам «Почему свертывание устроено именно так?», «Как оно работает?» и, наконец, «Как нам нужно воздействовать на свертывание, чтобы добиться желаемого эффекта?». Первое, что необходимо сделать для ответа — научиться исследовать свертывание целиком, а не только отдельные реакции.
Как исследовать свертывание?
Для изучения свертывания создаются различные модели — экспериментальные и математические. Что именно они позволяют получить?
С одной стороны, кажется, что самым лучшим приближением для изучения объекта является сам объект. В данном случае — человек или животное. Это позволяет учитывать все факторы, включая ток крови по сосудам, взаимодействия со стенками сосудов и многое другое. Однако в этом случае сложность задачи превосходит разумные границы. Модели свертывания позволяют упростить объект исследования, не упуская его существенных особенностей.
Попытаемся составить представление о том, каким требованиям должны отвечать эти модели, чтобы корректно отражать процесс свертывания in vivo.
В экспериментальной модели должны присутствовать те же биохимические реакции, что и в организме. Должны присутствовать не только белки системы свертывания, но и прочие участники процесса свертывания — клетки крови, эндотелия и субэндотелия. Система должна учитывать пространственную неоднородность свертывания in vivo: активацию от поврежденного участка эндотелия, распространение активных факторов, присутствие тока крови.
Рассмотрение моделей свертывания естественно начать с методов исследования свертывания in vivo. Основа практически всех используемых подходов такого рода заключается в нанесении подопытному животному контролируемого повреждения с тем, чтобы вызвать гемостатическую или тромботическую реакцию. Данная реакция исследуется различными методами:
Рисунок 4. Формирование тромба in vivo в модели тромбоза, индуцированного лазером. Эта картинка воспроизведена из исторической работы, где ученые впервые смогли пронаблюдать развитие тромба «вживую». Для этого в кровь мыши впрыснули концентрат флуоресцентно меченных антител к белкам свертывания и тромбоцитам, и, поместив животное под объектив конфокального микроскопа (позволяющего осуществлять трехмерное сканирование), выбрали доступную для оптического наблюдения артериолу под кожей и повредили эндотелий лазером. Антитела начали присоединяться к растущему тромбу, сделав возможным его наблюдение.
Классическая постановка эксперимента по свертыванию in vitro заключается в том, что плазма крови (или цельная кровь) смешивается в некоторой емкости с активатором, после чего производится наблюдение за процессом свертывания. По методу наблюдения экспериментальные методики можно разделить на следующие типы:
Второй подход дает несравненно больше информации. Теоретически, зная концентрации всех факторов в произвольный момент времени, можно получить полную информацию о системе. На практике исследование даже двух белков одновременно дорого и связано с большими техническими трудностями.
Наконец, свертывание в организме протекает неоднородно. Формирование сгустка запускается на поврежденной стенке, распространяется с участием активированных тромбоцитов в объеме плазмы, останавливается с помощью эндотелия сосудов. Адекватно изучить эти процессы с помощью классических методов невозможно. Вторым важным фактором является наличие потока крови в сосудах.
Осознание этих проблем привело к появлению, начиная с 1970-х годов, разнообразных проточных экспериментальных систем in vitro. Несколько больше времени потребовалось на осознание пространственных аспектов проблемы. Только в 1990-е годы стали появляться методы, учитывающие пространственную неоднородность и диффузию факторов свертывания, и только в последнее десятилетие они стали активно использоваться в научных лабораториях (рис. 5).
Рисунок 5. Пространственный рост фибринового сгустка в норме и патологии. Свертывание в тонком слое плазмы крови активировалось иммобилизованным на стенке тканевым фактором. На фотографиях активатор расположен слева. Серая расширяющаяся полоса — растущий фибриновый сгусток.
Наряду с экспериментальными подходами для исследований гемостаза и тромбоза также используются математические модели (этот метод исследований часто называется in silico [8]). Математическое моделирование в биологии позволяет устанавливать глубокие и сложные взаимосвязи между биологической теорией и опытом. Проведение эксперимента имеет определенные границы и сопряжено с рядом трудностей. Кроме того, некоторые теоретически возможные эксперименты неосуществимы или запредельно дороги вследствие ограничений экспериментальной техники. Моделирование упрощает проведение экспериментов, так как можно заранее подобрать необходимые условия для экспериментов in vitro и in vivo, при которых интересующий эффект будет наблюдаем.
Регуляция системы свертывания
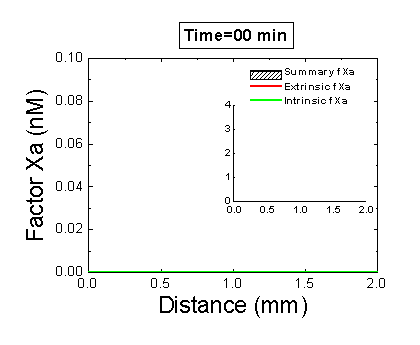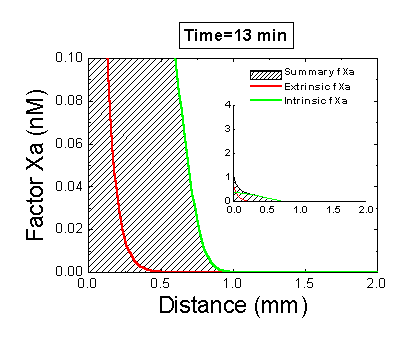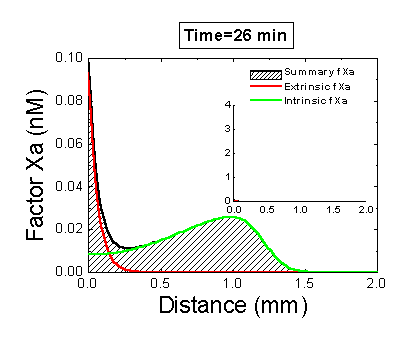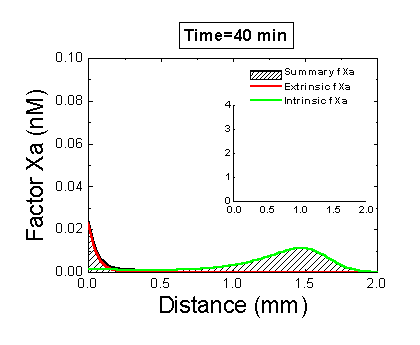
Рисунок 6. Вклад внешней и внутренней теназы в формирование фибринового сгустка в пространстве. Мы использовали математическую модель, чтобы исследовать, как далеко может простираться влияние активатора свертывания (тканевого фактора) в пространстве. Для этого мы посчитали распределение фактора Xa (который определяет распределение тромбина, который определяет распределение фибрина). На анимации показаны распределения фактора Xa, произведенного внешней теназой (комплексом VIIa–TF) или внутренней теназой (комплексом IXa–VIIIa), а также общее количество фактора Xa (заштрихованная область). (Вставка показывает то же самое на более крупной шкале концентраций.) Можно видеть, что произведенный на активаторе фактор Xa не может проникнуть далеко от активатора из-за высокой скорости ингибирования в плазме. Напротив, комплекс IXa–VIIIa работает вдали от активатора (т.к. фактор IXa медленнее ингибируется и потому имеет большее расстояние эффективной диффузии от активатора), и обеспечивает распространение фактора Xa в пространстве.
Сделаем следующий логический шаг и попробуем ответить на вопрос — а как описанная выше система работает?
Каскадное устройство системы свертывания
Запуск свертывания и роль положительных обратных связей
Как упоминалось в первой части статьи, многие реакции свертывания медленны. Так, факторы IXa и Xa сами по себе являются очень плохими ферментами и для эффективного функционирования нуждаются в кофакторах (факторах VIIIa и Va, соответственно). Эти кофакторы активируются тромбином: такое устройство, когда фермент активирует собственное производство, называется петлей положительной обратной связи.
Как было показано нами экспериментально и теоретически, положительная обратная связь активации фактора V тромбином формирует порог по активации — свойство системы не реагировать на малую активацию, но быстро срабатывать при появлении большой. Подобное умение переключаться представляется весьма ценным для свертывания: это позволяет предотвратить «ложное срабатывание» системы.
Роль внутреннего пути в пространственной динамике свертывания
Одной из интригующих загадок, преследовавших биохимиков на протяжении многих лет после открытия основных белков свертывания, была роль фактора XII в гемостазе. Его дефицит обнаруживался в простейших тестах свертывания, увеличивая время, необходимое для образования сгустка, однако, в отличие от дефицита фактора XI, не сопровождался нарушениями свертывания.
Один из наиболее правдоподобных вариантов разгадки роли внутреннего пути был предложен нами с помощью пространственно неоднородных экспериментальных систем. Было обнаружено, что положительные обратные связи имеют большое значение именно для распространения свертывания. Эффективная активация фактора X внешней теназой на активаторе не поможет сформировать сгусток вдали от активатора, так как фактор Xa быстро ингибируется в плазме и не может далеко отойти от активатора. Зато фактор IXa, который ингибируется на порядок медленнее, вполне на это способен (и ему помогает фактор VIIIa, который активируется тромбином). А там, куда сложно дойти и ему, начинает работать фактор XI, также активируемый тромбином. Таким образом, наличие петель положительных обратных связей помогает создать трехмерную структуру сгустка.
Путь протеина С как возможный механизм локализации тромбообразования
Активация протеина С тромбином сама по себе медленна, но резко ускоряется при связывании тромбина с трансмембранным белком тромбомодулином, синтезируемым клетками эндотелия. Активированный протеин С способен разрушать факторы Va и VIIIa, на порядки замедляя работу системы свертывания. Ключом к пониманию роли данной реакции стали пространственно-неоднородные экспериментальные подходы. Наши эксперименты позволили предположить, что она останавливает пространственный рост тромба, ограничивая его размер.
Подведение итогов
В последние годы сложность системы свертывания постепенно становится менее загадочной. Открытие всех существенных компонентов системы, разработка математических моделей и использование новых экспериментальных подходов позволили приоткрыть завесу тайны. Структура каскада свертывания расшифровывается, и сейчас, как мы видели выше, практически для каждой существенной части системы выявлена или предложена роль, которую она играет в регуляции всего процесса.
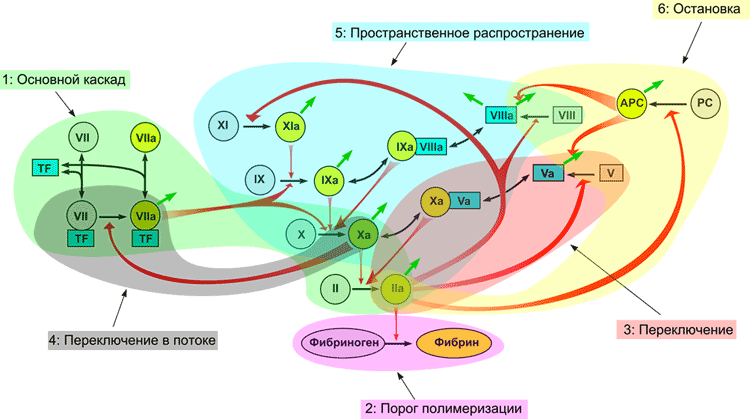
На рисунке 7 представлена наиболее современная попытка пересмотреть структуру системы свертывания. Это та же схема, что и на рис. 1, где разноцветным затенением выделены части системы, отвечающие за разные задачи, как обсуждалось выше. Не все в этой схеме является надежно установленным. Например, наше теоретическое предсказание, что активация фактора VII фактором Xa позволяет свертыванию пороговым образом отвечать на скорость потока, остается пока еще непроверенным в эксперименте.
Рисунок 7. Модульная структура системы свертывания: роль отдельных реакций свертывания в функционировании системы.
Вполне возможно, что эта картина еще не вполне полна. Тем не менее, прогресс в этой области в последние годы вселяет надежду, что в обозримом будущем оставшиеся неразгаданные участки на схеме свертывания обретут осмысленную физиологическую функцию. И тогда можно будет говорить о рождении новой концепции свертывания крови, пришедшей на смену старинной каскадной модели, которая верно служила медицине на протяжении многих десятилетий.
Статья написана при участии А.Н. Баландиной и Ф.И. Атауллаханова и была в первоначальном варианте опубликована в «Природе» [10].