Фибриллярные белки нерастворимы в воде потому что
Фибриллярные белки



Как уже говорилось выше, структура биополимеров теснейшим образом связана с их биологической функцией. Для того чтобы выполнять структурную функцию (волосяной покров, укрепление стенок клетки, цитоскелет клетки и т.п.), белок должен обладать вытянутой нитевидной структурой и не растворяться в воде. Такие белки называются фибриллярными.
Особенности конформации фибриллярных белков:
1) Существование вытянутой нитевидной структуры белка возможно только при условии высокой степени структурированности его молекулы, т.е. формировании вторичной структуры (α-спиральной или β-складчатой) практически на всём протяжении полипептидной цепи (более 80%).
2) Кроме того, в первичной структуре должны преобладать неполярные и незаряженные аминокислоты. Высокая степень структурированности фибриллярных белков не позволяет им сворачиваться в компактные структуры (глобулы). Поэтому гидрофобные радикалы аминокислотных остатков развёрнуты в стороны воды, что обеспечивает нерастворимость фибриллярных белков в воде.
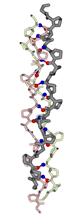
α-Структурные фибриллярные белки, сложены из длинных перевитых спиралей (суперсперализация) (Рис. 2.2):
Рис. 2.2. Структура фибриллярных белков: явление суперспирализации
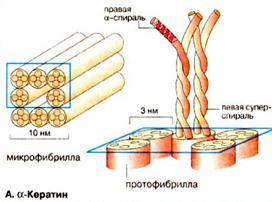
В α-кератине (рис. 2.3) такие спирали охватывают всю белковую цепь, — да и большая часть миозиновой цепи образует фибриллу такого типа. Такие структуры содержатся также в шелке — но не обычном шелке тутового шелкопряда, а шелке пчел и муравьев.
Рис. 2.3. Перевитые правые α-спирали. В комплексе они лежат параллельно друг другу и слегка закручены одна вокруг другой так, что каждая из них образует левую суперспираль.
Рис. 2.4. Структура молекулы коллагена
в) каждая полипептидная цепь имеет конформацию плотной (3 аминокислотных остатка на виток) левозакрученной спирали (спирализация 1-го порядка);
г) в молекуле коллагена эти три спирали перевиты друг с другом, в результате чего образуется тройная суперспираль коллагена (спирализация 2-го порядка), которая принципиально отличается от α‑спирали. Это очень слабо закрученная (один оборот на 10 000 нм) правая спираль;
д) между спиралями 1-го порядка за счёт пептидных групп образуются водородные связи.
Такое строение обеспечивает прочность коллагеновых волокон.
Фибриллярные белки
К фибриллярным белкам относят:
Примечания
См. также
Полезное
Смотреть что такое «Фибриллярные белки» в других словарях:
ФИБРИЛЛЯРНЫЕ БЕЛКИ — белки, полипептидные цепи к рых, располагаясь упорядоченно относительно одной оси, образуют длинные волокна (фибриллы) или слои. Устойчивы к действию протео литич. ферментов. К Ф. б. относятся осн. структурные белки соединит, ткани животных… … Биологический энциклопедический словарь
ФИБРИЛЛЯРНЫЕ БЕЛКИ — образованы полипептидными цепями, которые расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слой. Нерастворимы в воде и растворах солей. Основные структурные элементы соединительной ткани (коллаген и… … Большой Энциклопедический словарь
фибриллярные белки — – белки, имеющие волокнистое строение и высокую механическую прочность, не растворимые в воде … Краткий словарь биохимических терминов
фибриллярные белки — образованы полипептидными цепями, которые расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слой. Нерастворимы в воде и растворах солей. Основные структурные элементы соединительной ткани… … Энциклопедический словарь
ФИБРИЛЛЯРНЫЕ БЕЛКИ — образованы полипептидными цепями, к рые расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слой. Нерастворимы в воде и р рах солей. Осн. структурные элементы соединит. ткани (коллаген и др.). Ср.… … Естествознание. Энциклопедический словарь
БЕЛКИ (органические соединения) — БЕЛКИ, высокомолекулярные органические соединения, биополимеры, построенные из 20 видов L a аминокислотных остатков, соединенных в определенной последовательности в длинные цепи. Молекулярная масса белков варьируется от 5 тыс. до 1 млн. Название… … Энциклопедический словарь
Белки — I Белки (протеины) органические соединения, структурной основой которых служит полипептидная цепь, состоящая из аминокислотных остатков, соединенных пептидными связями ( СО NH2 ) в определенной последовательности. Белки являются главными… … Медицинская энциклопедия
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
белки — 1. БЕЛКИ, ов; мн. (ед. белок, лка; м.). 1. Выпуклые непрозрачные оболочки глаз белого цвета. Б. у неё голубоватые. 2. Разг. сниж. О глазах. Вращать белками. ◁ Белочный, ая, ое. Б ые оболочки глаз. 2. БЕЛКИ, ов; мн. (ед. белок, лка; м.). Сложные… … Энциклопедический словарь
БЕЛКИ — природные высокомолекулярные органические соединения, построенные из остатков 20 аминокислот, которые соединены пептидными связями в длинные цепи. Молекулярная масса от нескольких тысяч до нескольких миллионов. В зависимости от формы белковой… … Большой Энциклопедический словарь
Строение и свойства белков
Цель урока: сформировать понятие о белке, его структуре, физических и химических свойствах.
I. Организационный момент
II. Актуализация знаний
(Ученикам заранее предлагается повторить тему «Аминокислоты».)
Два ученика работают у доски.
Задание 1. Напишите формулы 2-аминопропановой кислоты (аланина) и 3-метил-2-аминобутановой кислоты (валина). Какие еще названия для этих кислот вы можете предложить?
Задание 2. Напишите формулу 2-аминоэтановой кислоты. Какие еще названия этой кислоты вам известны? Составьте дипептид из двух остатков этой кислоты. Укажите место пептидной связи.
– Какие две функциональные группы входят в состав аминокислот?
– Что представляют собой аминокислоты с точки зрения кислотно-основных свойств? За счет каких функциональных групп реализуются эти свойства?
– Дайте понятие пептидной связи.
– Могут ли аминокислоты образовывать водородные связи? За счет каких групп атомов?
– Какие вещества называются полимерами? Приведите примеры известных вам полимеров.
III. Постановка познавательной задачи
Учащиеся, работавшие у доски, отчитываются о выполненном задании.
На доске изображен дипептид, состоящий из двух остатков глицина, и приведены формулы двух аминокислот: аланина и валина.
Может ли образоваться дипептид из разных по составу аминокислот? (Слайд 1.) Для того чтобы ответить на этот вопрос, обратите внимание на место пептидной связи в дипептиде.
Ответ. В образовании пептидной связи принимают участие аминогруппа одной аминокислоты и карбоксильная группа другой аминокислоты; боковые радикалы аминокислот не участвуют в образовании дипептида.
Возможно ли дальнейшее присоединение аминокислот к этому веществу? Ответ обоснуйте.
Ответ. Присоединение возможно, т.к. у молекулы дипептида имеются свободные карбоксильная группа (С-конец) и аминогруппа (N-конец). Цепь может расти с обеих сторон (слайд 2).
Сколько вариантов соединения вы можете предложить?
Ответ. Два. Когда аминокислота глицин стоит на первом месте и когда аминокислота глицин стоит на втором месте (слайд 3).
В клетках и тканях организмов обнаружено свыше 170 различных аминокислот, и из них 20 
Ответ. Белки – это линейные биологические полимеры, состоящие из
-аминокислот.
Запишите это определение в своих рабочих листках.
Перед вами две полипептидные цепочки. Какой из пептидов может входить в состав белка и почему? (Слайд 4.)
Ответ. Первый, потому что он образован
-аминокислотами.
За счет каких связей образуется первичная структура белка?
Ответ. Первичная структура образуется за счет пептидных связей.
Запишите это в таблицу в рабочем листке.
Но белок гораздо более сложная макромолекула, чем линейная полипептидная цепочка. Помимо первичной структуры белка необходимо рассматривать вторичную, третичную, а в некоторых случаях и четвертичную структуры. В образовании вторичной структуры белка огромную роль играют водородные связи. Водородные связи образуются электроотрицательными атомами (кислородом, азотом и др.), с одним из которых связан атом водорода, причем все три атома находятся на одной прямой.
Существуют два типа вторичной структуры (

Третичная структура белка – это способ расположения 

Некоторые белки образуют четвертичную структуру, осуществляемую также за счет водородных связей, гидрофильно-гидрофобных взаимодействий и электростатических сил притяжения. Некоторые белки, имеющие четвертичную структуру, состоят из иона металла и белковой части, образованной несколькими белковыми цепями (разными или одинаковыми по первичной структуре) (слайд 7). Запишите в рабочие листки.
Белки осуществляют свои функции правильно только при наличии соответствующей третичной (и четвертичной, если таковая имеется) структур.
Физические свойства белков
Белки – высокомолекулярные соединения, т.е. это вещества с высокой молекулярной массой. Молекулярная масса белков составляет от 5 тыс. до миллионов а.е.м. (инсулин – 6500 Да; белок вируса гриппа – 32 млн Да).
Растворимость белков в воде зависит от их функций. Молекулы фибриллярных белков вытянуты в длину, нитеобразны и склонны группироваться одна возле другой с образованием волокон. Это основной строительный материал для тканей сухожилий, мускульных и покровных. Такие белки в воде нерастворимы.
Прочность белковых молекул просто поразительна! Человеческий волос прочнее меди и может соперничать со специальными видами стали. Пучок волос площадью 1 см 2 выдерживает вес в 5 т, а на женской косе из 200 тыс. волосинок можно поднять груженый КамАЗ весом 20 т.
Глобулярные белки свернуты в клубочки. В организме они выполняют ряд биологических функций, требующих их подвижности. Поэтому глобулярные белки растворимы в воде либо в растворах солей, кислот или оснований. Из-за большого размера молекул образуются растворы, называемые коллоидными. (Демонстрация растворения альбумина в воде.)
Химические свойства белков
Белки участвуют в не совсем обычных химических реакциях, т.к. они являются полимерными молекулами. Посмотрите в свои рабочие карточки и ответьте на следующие вопросы.
Какая связь является более прочной: пептидная или водородная?
Ответ. Пептидная, т.к. эта связь относится к ковалентной химической связи.
Какие структуры белков будут разрушаться быстрее и легче?
Ответ. Четвертичная (если таковая имеется), третичная и вторичная. Первичная структура будет сохраняться дольше других, т.к. она образована более прочными связями.
Денатурация – это разрушение белка до первичной структуры, т.е. пептидные связи сохраняются (слайд 8).
Демонстрация опыта. В 5 небольших пробирок налить по 4 мл раствора альбумина. Первую пробирку нагреть в течение 6–10 с (до помутнения). Во вторую пробирку добавить 2 мл 3М HCl. В третью – 2 мл 3М NaOH. В четвертую – 5 капель 0,1 М AgNO3. В пятую – 5 капель 0,1 М NaNO3.
После проведения опыта учащиеся заполняют пробелы в определении понятия «денатурация» на рабочих листках.
Будут ли белки после денатурации проявлять свои специфические свойства?
Ответ. Большинство белков при денатурации утрачивают активность, т.к. белки проявляют свои специфические свойства только при наличии третичной и четвертичной структур.
Как вы полагаете, можно ли разрушить первичную структуру белка?
Ответ. Можно. Это происходит в организме при переваривании белковой пищи.
Одно из самых важных свойств белков – способность к гидролизу. При гидролизе белка происходит разрушение первичной структуры.
Какие вещества образуются при полном гидролизе белка?
Ответ.
-аминокислоты.
Демонстрация опыта (заложенного перед уроком). В две пробирки наливают по 2 мл раствора куриного белка, в одну из них добавляют 1 мл насыщенного раствора фестала (таблетку предварительно освобождают от гладкой оболочки). Фестал – это ферментный препарат, облегчающий пищеварение, куда входят липаза (расщепляет жиры), амилаза (расщепляет углеводы), протеаза (расщепляет белки). Обе пробирки помещают в водяную баню при температуре 37–40 °С. В течение 30 мин продолжается процесс «переваривания» белка. По окончании нагревания в обе пробирки добавляют по 2 мл насыщенного раствора сульфата аммония или любого другого реагента, вызывающего денатурацию белка. В первой пробирке (контроль) образуется обильный белый осадок – белок денатурирует. Во второй пробирке (опыт) таких явлений не наблюдается – произошел гидролиз белка, а аминокислоты и пептиды с небольшой молекулярной массой не свертываются.
На основе результатов опыта заполните пропуски в определении понятия «гидролиз» на рабочих листках.
Какое значение для нашего организма имеет гидролиз белков и где он происходит?
Ответ. Получение аминокислот для нужд организма в результате процессов пищеварения начинается в желудке, заканчивается в двенадцатиперстной кишке.
Цветные реакции – качественные реакции на белки:
а) биуретовая реакция (демонстрация опыта);
б) ксантопротеиновая реакция (демонстрация опыта).
Заполните рабочие листки (обратите внимание на условия протекания этих реакций, это понадобится для проведения опытов на следующем уроке).
Рабочий листок
Тема: «Белки. Строение и свойства»
Белки ____________________________________________________________________
__________________________________________________________________________
Белки (протеины, полипептиды)
Дано определение, состав, структура и функции белков организма человека. Приведена их классификация. Описаны синтез и катаболизм белков.
Белки (протеины, полипептиды)
Определение
Белки – высокомолекулярные азотсодержащие соединения, состоящие из аминокислот.
Молекулярная масса белков
Состав белков
Несмотря на то, что в составе белковой молекулы могут входить десятки, сотни и тысячи аминокислот, все белки синтезируются из 20 видов аминокислот. Эти аминокислоты имеют следующие названия: глицин, аланин, серин, цистеин, треонин, метионин, валин, лейцин, изолейцин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, лизин, аргинин, фенилаланин, тирозин, триптофан, гистидин, пролин.
Структура белков
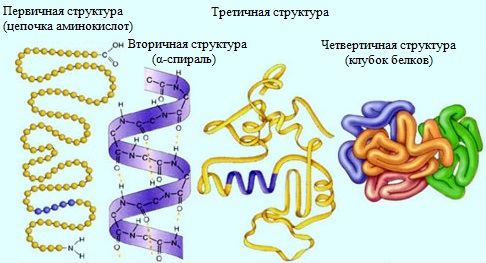
Различают четыре уровня структурной организации молекулы белка (рис.1).
Рис.1. Структуры белков
Первичная структура. Аминокислоты соединяясь друг с другом пептидной связью образуют длинные неразветвленные цепи – полипептиды.
Вторичная структура. Эта структура белков характеризует их определенную пространственную организацию. Например, многие белки имеют форму спирали. Фиксируется вторичная структура дисульфидными и водородными связями.
Третичная структура. Третичная структура отражает пространственную организацию вторичной структуры. Например, вторичная структура в виде спирали может укладываться в пространстве в виде глобулы, то есть иметь шаровидную или эллипсовидную форму. Примером белка, обладающего третичной структурой является миоглобин.
Четвертичная структура. Этой структурой обладают некоторые белки. Четвертичная структура – сложное образование, состоящее из нескольких белков, имеющих свою первичную, вторичную и третичную структуры. Примером белка, обладающего четвертичной структурой является гемоглобин.
Классификация белков
Существуют разные классификации белков. Приведу две классификации.
Согласно первой классификации белки делятся на простые (протеины) и сложные (протеиды). Простые белки состоят только из аминокислот. Пример: альбумины и глобулины крови. В молекуле сложного белка, кроме аминокислот, имеется еще неаминокислотная часть. В зависимости от неаминокислотной части выделяют такие сложные белки как нуклеопротеиды (содержат нуклеиновую кислоту), липопротеиды (содержат липоид) и. т.д.
Согласно второй классификации белки делятся на группы на основе своей пространственной формы. Различают глобулярные и фибриллярные белки. Молекулы глобулярных белков имеют шаровидную или эллипсовидную форму. Примерами таких белков являются альбумины и глобулины крови. Молекулы фибриллярных белков вытянутые. Их длина значительно превышает их диаметр. Примером фибриллярного белка является белок коллаген.
Функции белков
Функции, которые выполняют белки в организме настолько важны, что белки еще называют протеинами (от греч. слова proteus – первый, главный). Различают следующие функции белков в организме человека.
Перевариваривание белков в организме человека
В организм человека с пищей попадает в сутки около 100 г белков.
Расщепление белков начинается в полости желудка под воздействием желудочного сока, содержащего протеолитический фермент пепсин. Под воздействием пепсина в белках разрываются пептидные связи, образующие первичную структуру. В результате белковые молекулы превращаются в смесь полипептидов различной длины.
Дальнейшее переваривание белков протекает в тонкой кишке под воздействием ферментов: трипсина, химотрипсина и эсталазы, которые синтезируются в поджелудочной железе. В результате полипептиды расщепляются до олигопептидов, состоящих из нескольких аминокислот.
Завершается переваривание белков в тонкой кишке под воздействием ферментов кишечного сока. Образовавшиеся в результате этого процесса аминокислоты всасываются в кровь и по воротной вене поступают в печень и далее попадают в большой круг кровообращения.
Синтез белков
Синтез белков протекает в четыре этапа.
Первый этап синтеза белков протекает в ядрах клеток и называется транскрипцией.
Второй этап синтеза белков протекает в цитоплазме клетки и называется рекогницией.
Третий этап синтеза белков протекает на рибосомах и называется трансляцией.
Четвертый этап синтеза белков протекает в эндоплазматической сети и комплексе Гольджи и называется процессингом.
Более подробно синтез белков в мышечных волокнах описан в отдельной статье.
Катаболизм белков
В организме человека происходят одновременно два процесса: синтез белков и их распад (катаболизм). В тканях организма катаболизм белков происходит под воздействием внутриклеточных протеиназ, которые называются катепсинами. Эти ферменты локализованы в лизосомах.
Также катаболизм белков осуществляется особыми мультиферментными комплексами, которые называются протеосомы.
По данным С.С. Михайлова (2009) в сутки внутриклеточному протеолизу подвергается 200-300 г собственных белков организма. При этом при распаде как пищевых, так и собственных белков организма образуются одни и те же 20 видов аминокислот.
Фибриллярные белки нерастворимы в воде потому что
Физико-химические свойства белков
Аминокислотный состав и пространственная организация каждого белка определяют его физико-химические свойства. Белки обладают кислотно-основными, буферными, коллоидными и осмотическими свойствами.
Белки как амфотерные макромолекулы
Белки являются амфотерными полиэлектролитами, т.е. сочетают в себе, подобно аминокислотам, кислотные и основные свойства. Однако природа групп, придающих амфотерные свойства белкам, далеко не та же, что у аминокислот. Кислотно-основные свойства аминокислот обусловлены прежде всего наличием α-амино- и α-карбоксильной групп (кислотно-основная пара). В молекулах белков эти группы участвуют в образовании пептидных связей, а амфотерность белкам придают кислотно-основные группы боковых радикалов аминокислот, входящих в белок. Разумеется, в каждой молекуле нативного белка (полипептидной цепи) имеется как минимум по одной концевой α-амино- и α-карбоксильной группе (если у белка только третичная структура). У белка с четвертичной структурой число концевых групп —NН2 и —СООН равно числу субъединиц, или протомеров. Однако столь незначительное число этих групп не может объяснить амфотерность макромолекул белка. Поскольку большая часть полярных групп находится на поверхности глобулярных белков, то именно они определяют кислотно-основные свойства и заряд белковой молекулы. Кислотные свойства белку придают кислые аминокислоты (аспарагиновая, глутаминовая и аминолимонная), а щелочные свойства — основные аминокислоты (лизин, аргинин, гистидин). Чем больше кислых аминокислот содержится в белке, тем ярче выражены его кислотные свойства, и чем больше входит в состав белка основных аминокислот, тем сильнее проявляются его основные свойства. Слабая диссоциация SН-группы цистеина и фенольной группы тирозина (их можно рассматривать как слабые кислоты) почти не влияет на амфотерность белков.
Буферные свойства. Белки хотя и обладают свойствами буфера, но емкость их при физиологических значениях рН ограничена. Исключение составляют белки, содержащие много гистидина, так как только боковая группа гистидина обладает буферными свойствами в интервале значений рН, близких к физиологическим. Таких белков очень мало. Гемоглобин чуть ли не единственный белок, содержащий до 8% гистидина, является мощным внутриклеточным буфером в эритроцитах, поддерживая рН крови на постоянном уровне.
Заряд белковой молекулы зависит от содержания в ней кислых и основных аминокислот, а точнее, от ионизации кислых и основных групп бокового радикала этих аминокислот. Диссоциация СООН-групп кислых аминокислот вызывает появление отрицательного заряда на поверхности белка, а боковые радикалы щелочных аминокислот несут положительный заряд (за счет присоединения Н + к основным группам). В нативной молекуле белка заряды распределяются асимметрично в зависимости от укладки полипептидной цепи в пространстве. Если в белке кислые аминокислоты преобладают над основными, то в целом молекула белка электроотрицательна, т. е. является полианионом, и наоборот, если преобладают основные аминокислоты, то она заряжена положительно, т. е. ведет себя как поликатион.
Знание изоэлектрической точки очень важно для понимания стабильности белков в растворах, так как в изоэлектрическом состоянии белки наименее устойчивы. Незаряженные частицы белка могут слипаться друг с другом и выпадать в осадок.
Коллоидные и осмотические свойства белков
Поведение белков в растворах имеет некоторые особенности. Обычные коллоидные растворы устойчивы только в присутствии стабилизатора, который препятствует осаждению коллоидов, располагаясь на границе раздела «растворенное вещество — растворитель».
Светорассеивающую способность белков и других высокомолекулярных веществ используют для их количественного определения методом нефелометрии, сравнивая интенсивность светорассеивания взвешенными частицами исследуемого и стандартного золя.
Малая скорость диффузии. Диффузией называется самопроизвольное перемещение молекул растворенных веществ вследствие градиента концентраций (от зон с высокой концентрацией к зонам с низкой концентрацией). Белки имеют ограниченную скорость диффузии в сравнении с обычными молекулами и ионами, которые перемещаются в сотни и тысячи раз быстрее, чем белки. Скорость диффузии белков больше зависит от формы их молекул, чем от молекулярной массы. Глобулярные белки в водных растворах подвижнее фибриллярных белков.
Диффузия белков имеет важное значение для нормального функционирования клетки. Синтез белков в любом участке клетки (там, где имеются рибосомы) мог бы привести при отсутствии диффузии к скоплению белков в месте их образования. Внутриклеточное распределение белков происходит путем диффузии. Поскольку скорость диффузии белков невысока, она ограничивает скорость процессов, зависящих от функции диффундирующего белка в соответствующем участке клетки.
Осмотические свойства белков. Белки из-за высокой молекулярной массы не могут диффундировать через полупроницаемую мембрану, тогда как низкомолекулярные вещества легко проходят через такие мембраны. Это свойство белков используют в практике для очистки их растворов от низкомолекулярных примесей. Такой процесс называется диализом.
Неспособность белков диффундировать через полупроницаемые мембраны вызывает явление осмоса, т. е. перемещение молекул воды через полупроницаемую мембрану в раствор белка. Если раствор белка отделить от воды целлофановой мембраной, то, стремясь к достижению равновесия, молекулы воды диффундируют в раствор белка. Однако перемещение воды в пространство, где находится белок, повышает в нем гидростатическое давление (давление столба воды), которое препятствует дальнейшей диффузии молекул воды к белку.
То давление, или сила, которое следует приложить, чтобы остановить осмотический ток воды, называется осмотическим давлением. Осмотическое давление в очень разбавленных растворах белка пропорционально молярной концентрации белка и абсолютной температуре.
Биологические мембраны также непроницаемы для белка, поэтому осмотическое давление, создаваемое белком, зависит от концентрации его внутри и вне клетки. Осмотическое давление, обусловленное белком, называют также онкотическим давлением.
Высокая вязкость растворов белка. Высокая вязкость характерна не только для растворов белка, но вообще для растворов высокомолекулярных соединений. С увеличением концентрации белка вязкость раствора повышается, поскольку повышаются силы сцепления между молекулами белка. Вязкость зависит от формы молекул. Растворы фибриллярных белков всегда более вязки, чем растворы глобулярных белков. На вязкость растворов сильно влияют температура и присутствие электролитов. С повышением температуры вязкость растворов белка снижается. Добавки некоторых солей, например кальция, повышают вязкость, способствуя сцеплению молекул с помощью кальциевых мостикoв. Иногда вязкость белкового раствора увеличивается настолько, что он теряет текучесть и переходит в гелеобразное состояние.
Способность белков к образованию гелей. Взаимодействие между макромолекулами белка в растворе может привести к образованию структурных сеток, внутри которых находятся захваченные молекулы воды. Такие структурированные системы называются гелями или студнями. Считается, что белок протоплазмы клетки может переходить в гелеобразное состояние. Характерный пример — тело медузы является как бы живым студнем, содержание воды в котором до 90%.
Гелеобразование легче протекает в растворах фибриллярных белков; их палочковидная форма способствует лучшему контакту концов макромолекул. Это хорошо известно из бытовой практики. Пищевые студни готовят из продуктов (кости, хрящи, мясо), содержащих в большом количестве фибриллярные белки.
В процессе жизнедеятельности организма гелеобразное состояние белковых структур имеет важное физиологическое значение. Коллагеновые белки костей, сухожилий, хрящей, кожи и т. д. обладают высокой прочностью, упругостью и эластичностью, потому что находятся в гелеобразном состоянии. Отложение минеральных солей при старении снижает их упругость и эластичность. В гелеобразном или студнеобразном виде находится в мышечных клетках актомиозин, выполняющий сократительную функцию.
В живой клетке происходят процессы, напоминающие переход золь — гель. Протоплазма клетки представляет собой золеподобную вязкую жидкость, в которой обнаруживаются островки гелеподобных структур.
Гидратация белков и факторы, влияющие на их растворимость
Белки — гидрофильные вещества. Если растворять сухой белок в воде, то сначала он, как всякое гидрофильное высокомолекулярное соединение, набухает, а затем молекулы белка начинают постепенно переходить в раствор. При набухании молекулы воды проникают в белок и связываются с его полярными группами. Плотная упаковка полипептидных цепей разрыхляется. Набухший белок можно считать как бы обратным раствором, т. е. раствором молекул воды в высокомолекулярном веществе — белке. Дальнейшее поглощение воды приводит к отрыву молекул белка от общей массы и растворению. Но набухание не всегда ведет к растворению; некоторые белки, например коллаген, так и остаются в набухшем виде, поглотив большое количество воды.
Растворение связано с гидратацией белков, т. е. связыванием молекул воды с белками. Гидратная вода так прочно связана с макромолекулой белка, что отделить ее удается с большим трудом. Это говорит не о простой адсорбции, а об электростатическом связывании молекул воды с полярными группами боковых радикалов кислых аминокислот, несущих отрицательный заряд, и основных аминокислот, несущих положительный заряд.
Однако часть гидратной воды связывается пептидными группами, которые образуют с молекулами воды водородные связи. Например, полипептиды с неполярными боковыми группами тоже набухают, т. е. связывают воду. Так, большое количество воды связывает коллаген, хотя этот белок содержит преимущественно неполярные аминокислоты. Вода, связываясь с пептидными группами, раздвигает вытянутые полипептидные цепи. Однако межцепочечные связи (мостики) не дают молекулам белка отрываться друг от друга и переходить в раствор. При нагревании сырья, содержащего коллаген, межцепочечные мостики в коллагеновых волокнах разрываются и освобожденные полипептидные цепи переходят в раствор. Эта фракция частично гидролизованного растворимого коллагена называется желатиной. Желатина по химическому составу близка к коллагену, легко набухает и растворяется в воде, образуя вязкие жидкости. Характерным свойством желатины является способность к гелеобразованию. Водные растворы желатины широко используются в лечебной практике как плазмозамещающее и кровоостанавливающее средство, а способность к гелеобразованию — при изготовлении капсул в фармацевтической практике.
Факторы, влияющие на растворимость белков. Растворимость разных белков колеблется в широких пределах. Она определяется их аминокислотным составом (полярные аминокислоты придают большую растворимость, чем неполярные), особенностями организации (глобулярные белки, как правило, лучше растворимы, чем фибриллярные) и свойствами растворителя. Например, растительные белки — проламины — растворяются в 60-80%-ном спирте, альбумины — в воде и в слабых растворах солей, а коллаген и кератины нерастворимы в большинстве растворителей.
Стабильность растворам белков придают заряд белковой молекулы и гидратная оболочка. Каждая макромолекула индивидуального белка имеет суммарный заряд одного знака, что препятствует их склеиванию в растворе и выпадению в осадок. Все, что способствует сохранению заряда и гидратной оболочки, облегчает растворимость белка и его устойчивость в растворе. Между зарядом белка (или числом полярных аминокислот в нем) и гидратацией существует тесная связь: чем больше полярных аминокислот в белке, тем больше связывается воды (в расчете на 1 г белка). Гидратная оболочка белка иногда достигает больших размеров, и гидратная вода может составлять до 1/5 его массы.
Правда, некоторые белки гидратируются сильнее, а растворяются хуже. Например, коллаген связывает воды больше, чем многие хорошо растворимые глобулярные белки, но не растворяется. Его растворимости мешают структурные особенности — поперечные связи между полипептидными цепями. Иногда разноименно заряженные группы белка образуют много ионных (солевых) связей внутри молекулы белка или между молекулами белков, что мешает образованию связей между молекулами воды и заряженными группами белков. Наблюдается парадоксальное явление: в белке много анионных или катионных групп, а растворимость его в воде низкая. Межмолекулярные солевые мостики вызывают склеивание молекул белка и их выпадение в осадок.
Нейтральные соли в небольших концентрациях повышают растворимость даже тех белков, которые нерастворимы в чистой воде (например, эвглобулины). Это объясняется тем, что ионы солей, взаимодействуя с противоположно заряженными группами молекул белков, разрушают солевые мостики между молекулами белков. Повышение концентрации солей (увеличение ионной силы раствора) оказывает обратное действие (см. ниже — высаливание).
рН среды влияет на заряд белка, а следовательно, на его растворимость. Наименее устойчив белок в изоэлектрическом состоянии, т. е. когда его суммарный заряд равен нулю. Снятие заряда позволяет молекулам белка легко сближаться, склеиваться и выпадать в осадок. Значит, растворимость и устойчивость белка будут минимальны при рН, соответствующем изоэлектрической точке белка.
Строгой зависимости между температурой и характером растворимости белков не имеется. Одни белки (глобулины, пепсин, фосфорилаза мышц) в водных или солевых растворах с повышением температуры растворяются лучше; другие (альдолаза мышц, гемоглобин и т.д.) хуже.
Если в раствор белка, являющегося полианионом (кислый белок), добавить белок, являющийся поликатионом (основной белок), то они образуют агрегаты. При этом устойчивость вследствие нейтрализации зарядов теряется и белки выпадают в осадок. Иногда эту особенность используют для выделения нужного белка из смеси белков.
Растворы нейтральных солей широко используются не только для повышения растворимости белка, например при выделении его из биологического материала, но и для избирательного осаждения разных белков, т. е. их фракционирования. Процесс осаждения белков нейтральными солевыми растворами называется высаливанием. Характерной особенностью белков, полученных высаливанием, является сохранение ими нативных биологических свойств после удаления соли.
Механизм высаливания состоит в том, что добавляемые анионы и катионы солевого раствора снимают гидратную оболочку белков, являющуюся одним из факторов его устойчивости. Возможно, одновременно происходит и нейтрализация зарядов белка ионами соли, что также способствует осаждению белков.
Эти ряды называются лиотропными.
Сильным высаливающим эффектом в этом ряду обладают сульфаты. На практике для высаливания белков чаще всего применяют сульфат натрия и аммония. Кроме солей белки осаждают органическими водоотнимающими средствами (этанол, ацетон, метанол и др.). Фактически это то же высаливание.
Высаливание широко используют для разделения и очистки белков, поскольку многие белки различаются по размеру гидратной оболочки и величине зарядов. Для каждого из них имеется своя зона высаливания, т. е. концентрация соли, позволяющая дегидратировать и осадить белок. После удаления высаливающего агента белок сохраняет все свои природные свойства и функции.
Денатурация (денативация) и ренатурация (ренативация)
При действии различных веществ, нарушающих высшие уровни организации белковой молекулы (вторичную, третичную, четвертичную) с сохранением первичной структуры, белок теряет свои нативные физико-химические и, главное, биологические свойства. Это явление называется денатурацией (денативацией). Оно характерно только для молекул, имеющих сложную пространственную организацию. Синтетические и природные пептиды не способны к денатурации.
При денатурации разрываются связи, стабилизирующие четвертичную, третичную и даже вторичную структуры. Полипептидная цепь разворачивается и находится в растворе или в развернутом виде, или в виде беспорядочного клубка. При этом теряется гидратная оболочка и белок выпадает в осадок. Однако осажденный денатурированный белок отличается от того же белка, осажденного путем высаливания, так как в первом случае он утрачивает нативные свойства, а во втором сохраняет. Это указывает на то, что механизм действия веществ, вызывающих денатурацию и высаливание, разный. При высаливании сохраняется нативная структура белка, а при денатурации разрушается.
К физическим факторам относятся: температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучение.
Тепловая денатурация белков является наиболее изученным процессом. Она считалась одним из характерных признаков белков. Давно известно, что при нагревании белок свертывается (коагулирует) и выпадает в осадок. Большинство белков термолабильны, однако известны белки, очень устойчивые к нагреванию. Например, трипсин, химотрипсин, лизоцим, некоторые белки биологических мембран. Особой устойчивостью к температуре отличаются белки бактерий, обитающих в горячих источниках. Очевидно, у термостабильных белков тепловое движение полипептидных цепей, вызванное нагреванием, недостаточно для разрыва внутренних связей молекул белка. В изоэлектрической точке белки легче подвергаются тепловой денатурации. Этот прием используется в практической работе. Некоторые белки, наоборот, денатурируют при низкой температуре.
К химическим факторам, вызывающим денатурацию, относятся: кислоты и щелочи, органические растворители (спирт, ацетон), детергенты (моющие средства), некоторые амиды (мочевина, соли гуанидина и т. д.), алкалоиды, тяжелые металлы (соли ртути, меди, бария, цинка, кадмия и т. д.). Механизм денатурирующего действия химических веществ зависит от их физико-химических свойств.
Кислоты и щелочи широко используются в качестве осадителей белков. Многие белки денатурируются при крайних значениях рН — ниже 2 или выше 10-11. Но некоторые белки устойчивы к действию кислот и щелочей. Например, гистоны и протамины не денатурируются даже при рН 2 или рН 10. Крепкие растворы этанола, ацетон тоже оказывают денатурирующее влияние на белки, хотя для некоторых белков эти органические растворители используются как высаливающие агенты.
Тяжелые металлы, алкалоиды издавна применяются как осадители; они образуют прочные связи с полярными группами белков и тем самым разрывают систему водородных и ионных связей.
Особо следует остановиться на мочевине и солях гуанидина, которые в больших коцентрациях (для мочевины 8 моль/л, для гуанидина гидрохлорида 2 моль/л) конкурируют пептидными группами за образование водородных связей. В результате происходит диссоциация на субъединицы у белков с четвертичной структурой, а затем и разворачивание полипептидных цепей. Это свойство мочевины настолько ярко, что его широко используют для доказательства наличия четвертичной структуры белка и значения его структурной организации в осуществлении физиологической функции.
Последнее качество денатурированного белка широко известно. Термическая или иная обработка продуктов, содержащих белки (главным образом мясные), способствует лучшему перевариванию их с помощью протеолитических ферментов желудочно-кишечного тракта. В желудке человека и животных вырабатывается природный денатурирующий агент — соляная кислота, которая, денатурируя белки, помогает их расщеплению ферментами. Однако наличие соляной кислоты и протеолитических ферментов не позволяет применять белковые лекарственные препараты через рот, ибо они денатурируются и тут же расщепляются, теряя биологическую активность.
Заметим также, что денатурирующие вещества, осаждающие белки, используются в биохимической практике с иными целями, чем высаливающие. Высаливание как прием применяется для выделения какого-то белка или группы белков, а денатурация для освобождения от белка смеси каких-либо веществ. Удаляя белок, можно получить безбелковый раствор или устранить действие этого белка.
Долго считалось, что денатурация необратима. Однако в некоторых случаях удаление денатурирующего агента (такие опыты были сделаны при использовании мочевины) восстанавливает биологическую активность белка. Процесс восстановления физико-химических и биологических свойств денатурированного белка называется ренатурацией или ренативацией. Если денатурированный белок (после удаления денатурирующих веществ) вновь самоорганизуется в исходную структуру, то восстанавливается и его биологическая активность.