Фето фетальный синдром при двойне что
Фето-фетальный трансфузионный синдром ( Синдром фето-фетальной трансфузии )
Фето-фетальный трансфузионный синдром (ФФТС) – это тяжелое осложнение многоплодной монохориальной беременности, при которой из-за анастомозов в сосудистой сети плаценты возникает дисбаланс кровотока у плодов. Проявлениями служит диспропорциональность развития близнецов, многоводие в пузыре «рецепиента» при маловодии у «донора», ряд серьезных пороков развития обоих плодов, их внутриутробная гибель. Диагностика производится на основании картины ультразвуковых исследований, эхокардиографии и допплерографии, выполняемых обычно во второй половине беременности. Для сохранения беременности осуществляют лазеркоагуляцию плацентарных анастомозов, периодическое амниодренирование, окклюзию пуповины более пострадавшего плода для сохранения другого.
МКБ-10
Общие сведения
Причины
Морфологической предпосылкой для развития фето-фетального трансфузионного синдрома является наличие в хорионе анастомозов между сосудистыми сетями обоих плодов. При монохориальной беременности они выявляются в 60-90% и могут быть поверхностными и глубокими. Поверхностные вено-венозные и артерио-артериальные анастомозы способны транспортировать кровь в обоих направлениях (в зависимости от давления) и выравнивают объемы крови между близнецами. Строение глубоких анастомозов таково, что артериальная кровь, поступающая в котиледон плаценты из системы одного ребенка, переходит в венозную сеть другого. Предполагается, что превалирование количества глубоких сосудистых соединений в хорионе над числом поверхностных и становится причиной появления синдрома.
Факторы, приводящие к возникновению большего количества глубоких анастомозов, на сегодняшний момент неизвестны. Предполагается, что они возникают из-за патологии формирования плаценты «донора», в результате чего сосудистое сопротивление в ней растет, и формируются шунты, связывающие его с сосудами «реципиента». Обсуждается возможность влияния позднего разделения близнецов, тератогенных факторов, недостаточного кровоснабжения матки женщины. Выяснение точных причин ФФТС осложняется поздней диагностикой этого состояния и непредсказуемостью его появления.
Патогенез
Считается, что возникновение фето-фетального трансфузионного синдрома может произойти на разных сроках вынашивания, причем позднее возникновение осложнения благоприятней в прогностическом отношении. Иная точка зрения заключается в том, что предпосылки для ФФТС возникают еще на этапе разделения плодов (4-12 дни гестации), а выраженность и срок появления дальнейших нарушений зависит от количества глубоких анастомозов и степени дисбаланса кровообращения близнецов. Первоначально возникает простой переток крови от «донора» к «реципиенту», который не отражается на скорости развития и других характеристиках обоих плодов.
Уменьшение объема циркулирующей крови у близнеца-донора постепенно приводит к явлениям плацентарной недостаточности – внутриутробной гипоксии, задержке развития. Нарушается работа почек и снижается выделение мочи, что становится причиной уменьшения объемов мочевого пузыря и появления маловодия. Последний фактор оказывает влияние на скорость развития тканей легких, замедляя формирование дыхательной системы. При отсутствии лечения происходит внутриутробная гибель плода по причине гипоксии и тяжелого недоразвития основных органов и систем.
Классификация
Выделяют несколько степеней развития фето-фетального трансфузионного синдрома, основываясь на тяжести состояния плодов и разнице их основных показателей (КТР, объем околоплодных вод). По мере прогрессирования ФФТС нарушения беременности нарастают таким образом, что каждая стадия включает в себя патологии всех предыдущих этапов заболевания. Современная классификация выделяет пять стадий развития синдрома:
Стадийность ФФТС не имеет четкой привязки к сроку беременности – при неблагоприятном и раннем развитии осложнения признаки 1-й стадии могут выявлять на 14-17 неделе. В акушерстве при синдроме считается важной границей срок в 25 недель гестации, так как появление нарушений ранее часто приводит к прерыванию беременности даже при лечении. Нередко принимается решение о сохранении только одного (более жизнеспособного) ребенка, тогда врачебное вмешательство может производиться в ущерб его близнецу.
Симптомы
Субъективных проявлений ФФТС не имеет, его обнаруживают при скрининговых ультразвуковых исследованиях. Беременные с такой патологией чаще, чем в норме, имеют гипертонус матки и другие состояния, угрожающие прерыванием вынашивания ребенка. Ряд исследователей допускает, что значительная часть самопроизвольных абортов при многоплодной беременности обусловлена ФФТС до его обнаружения. Осложнения патологии (внутриутробная смерть) могут проявляться болью в животе и груди, профузным маточным кровотечением либо появлением кровянистых выделений из влагалища. На поздних сроках признаком гибели близнецов является прекращение их движений (замирание).
Осложнения
Диагностика
Обнаружение ФФТС происходит при плановом УЗИ беременной, уже при выявлении монохориальной многоплодной беременности женщина вносится в группу риска. УЗИ-признаки заболевания обнаруживаются после 16-й недели (крайне редко – после 11-12-й), затем для подтверждения диагноза и мониторинга состояния плодов назначают дополнительные методы исследования. С их помощью определяют прогностические перспективы фето-фетального трансфузионного синдрома и собираются данные для возможного лечения.
Лечение ФФТС
Консервативное лечение ангиопротективными средствами и препаратами для коррекции микроциркуляции признано неэффективным и может использоваться только в качестве вспомогательной терапии. Аналогичной позиции специалисты придерживаются и в отношении гормональных (препараты прогестерона) и других лекарств, использующихся в акушерстве для сохранения беременности. Увеличивают выживаемость как минимум одного близнеца только методы фетальной хирургии:
Прогноз
Фето-фетальный трансфузионный синдром характеризуется неблагоприятным прогнозом – при отсутствии лечения и регулярного наблюдения у акушера-гинеколога это состояние практически всегда приводит к гибели плодов и самопроизвольному прерыванию беременности. Результативность хирургического вмешательства зависит от многих факторов: стадии развития ФФТС, срока беременности, наличия или отсутствия сопутствующих патологий у женщины. Довольно часто лечебные меры приходится производить в ущерб более пострадавшему ребенку для сохранения другого. Профилактика развития синдрома не разработана, так как неизвестны причины его возникновения.
Ультразвуковые и допплерографические критерии диагностики вариантов фето-фетальной трансфузии и селективной задержки роста одного из монозиготных близнецов
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Введение
Хронический ФФТС необходимо дифференцировать с другими патологическими состояниями монозиготной многоплодной беременности, встречающимися реже: острой межблизнецовой трансфузией (ОМТ) и селективной задержкой роста (CЗР) одного из плодов. Несмотря на ряд схожих клинических проявлений, эти состояния имеют прогноз, отличный от прогноза при хроническом тяжелом ФФТС, требуют иной терапевтической тактики.
Хроническая форма ФФТС проявляется с середины II триместра гестации, имеет тяжелое течение, сопряжена с резко выраженным гемодинамическим дисбалансом между циркуляторными системами плодовблизнецов [9]. Клинически в течении хронического ФФТС различают 5 стадий (таблица). Критериями, на основании которых дифференцируется клиническая стадия синдрома, являются ультразвуковые и допплерографические изменения [10].
| Ультразвуковые критерии | Клиническая стадия ФФТС | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| Полиолигогидрамнион | + | + | + | + | + |
| Мочевой пузырь донора | + | — | — | — | — |
| Патологические допплерограммы | — | — | + | + | + |
| Водянка реципиента | — | — | — | + | + |
| Внутриутробная гибель плода (плодов) | — | — | — | — | + |
Селективная задержка роста одного из близнецов (дискордантный рост монозиготных близнецов) характеризуется отставанием роста одного из плодов [15]. При этом межблизнецовая трансфузия незначительна либо отсутствует, патогенез нарушений связан преимущественно с проявлениями плацентарной дисфункции, либо функциональной патологией плода. Терапевтическая тактика в большинстве таких случаев выжидательноконсервативная [16]. При остром нарушении плацентарно-плодового кровообращения возможна антенатальная гибель одного из плодов-близнецов. В подобном случае показана фетоскопическая лазерная коагуляция его пуповины. При наличии соответствующего гестационного срока и адекватной перинатальной тактике прогноз для жизни и здоровья второго плода может быть благоприятным.
Очевидной представляется невозможность клинической диагностики ФФТС на антенатальном этапе без применения серийных ультразвуковых и допплерографических исследований.
Целью работы явилось выявление последовательности ультразвуковых и допплерографических изменений на разных стадиях некорригированного хронического ФФТС, при острой межблизнецовой трансфузии и селективной задержке роста одного из монозиготных близнецов.
Материалы и методы
Проведен сравнительный анализ перинатальных исходов, а также результатов патоморфологических исследований последов.
Результаты и обсуждение
У двух из 3 женщин с хроническим ФФТС имелись указания на наличие в анамнезе пороков развития плода, перинатальных потерь и преждевременных родов. Средний возраст женщин составил 27,8±0,8 лет.
На рис. 1-12 представлены ультразвуковые и допплерографические признаки разных клинических стадий тяжелой формы хронического прогрессирующего ФФТС.
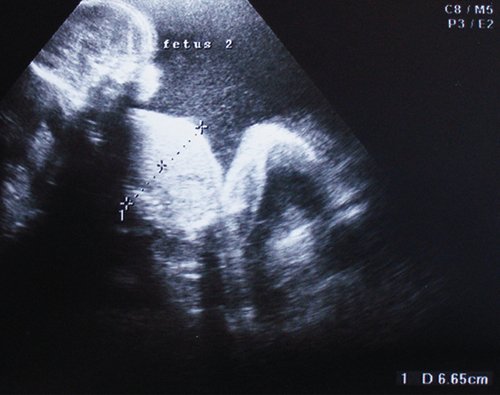
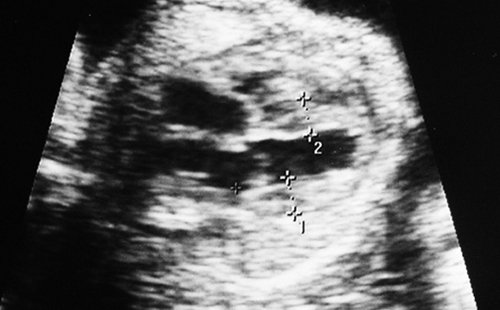
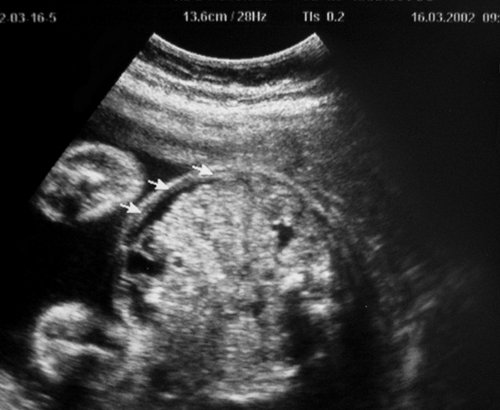
Рис. 1. Двуплодная монохориальная беременность, гестационный срок 25 нед. Выраженно дискордантный рост плодов: поперечное сечение туловища плода-донора (слева), аксиальное сечение головы плода-реципиента (справа). Отставание фетометрических показателей меньшего плода более чем на 3 SD.
Рис. 3. Плод-реципиент, имеющий нормальные для срока гестации размеры.
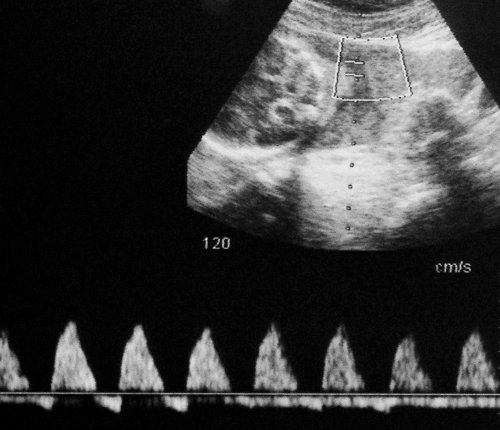
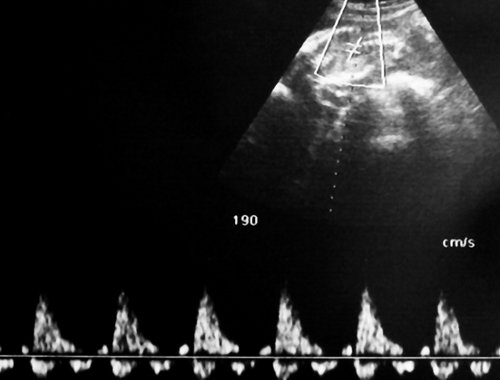
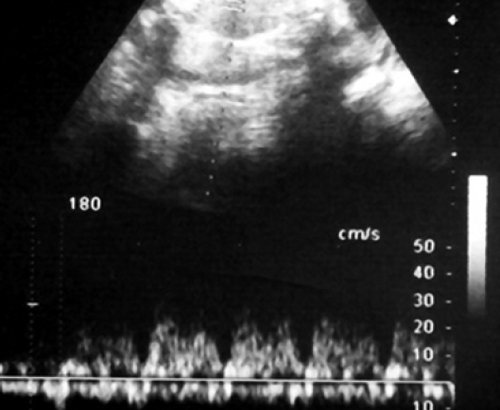
Рис. 5. Длительно регистрируемый постоянный нулевой диастолический кровоток, эпизоды реверсного диастолического кровотока в пуповинных артериях плода-донора. III стадия фето-фетального трансфузионного синдрома.
Рис. 6. Длительно регистрируемый нулевой диастолический кровоток в аорте близнеца-донора. Отсутствует визуализация мочевого пузыря плода.
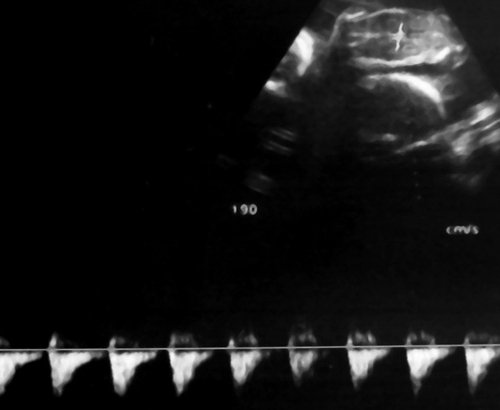
Рис. 7. Реверсный диастолический кровоток в торакальной аорте близнеца-донора. В условиях фето-фетальной трансфузии спектры, характерные для терминальной фетальной гемодинамики, могут регистрироваться до нескольких недель.
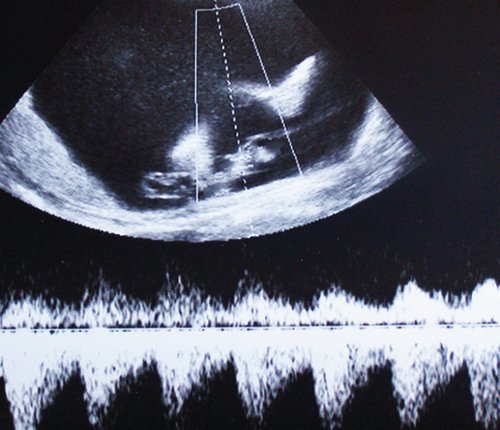
Рис. 8. Нормальная спектральная допплерограмма пуповинных артерий плода-реципиента сохраняется даже на фоне его терминального состояния, вплоть до внутриутробной гибели; выраженный полигидрамнион.
Рис. 9. Гипертрофическая компенсаторная кардиомегалия плода-реципиента (гестационный срок 26-27 нед): площадь сечения сердца занимает около 1/2 площади поперечного сечения грудной клетки, толщина миокарда желудочков и межжелудочковой перегородки сердца плода 6,5 и 6,8 мм соответственно.
Рис. 10. Пуповина плода-реципиента с признаками многократного «скручивания». Изменения зарегистрированы одновременно с допплерографическими признаками повышения резистентности венозного протока (см. рис. 11).
Рис. 12. Признаки развития сердечной недостаточности плода-реципиента вследствие гемодинамической перегрузки, начальный асцит (стрелки). IV, предтерминальная, стадия тяжелого хронического фето-фетального трансфузионного синдрома. Внутриутробная гибель обоих плодов наступила менее чем через 24 ч.
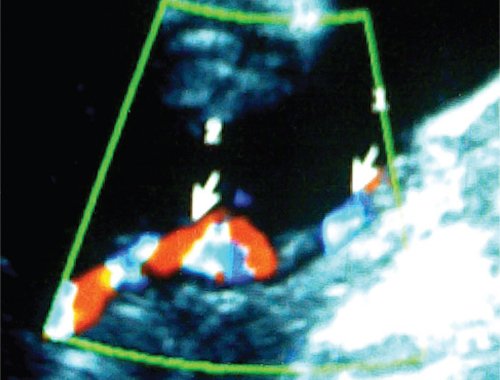
Межблизнецовые внутриплацентарные анастомозы были не единственным проявлением особенностей пуповинных сосудов. Для всех плодов при тяжелом хроническом ФФТС были характерны различные внеплацентарные изменения морфологии пуповин, выявленные антенатально в разных сочетаниях с помощью УЗИ: различная толщина пуповин близнецов за счет гипоплазии пуповинных сосудов меньшего плода, а также его гиповолемии; аномальное количество сосудов; децентрированное (краевое) отхождение пуповинных сосудов от плаценты; оболочечный ход сосудов пуповины; внеплацентарные межпуповинные анастомозы; многократно перекрученная, чрезмерно извитая пуповина большего плода; отсутствие спирального хода сосудов пуповины меньшего плода.
Патогномоничными для III клинической стадии тяжелой формы хронического ФФТС были гемодинамические изменения фетальных и пуповинных сосудов, регистрируемые с помощью спектральной допплерографии.
В то же время для пуповинных артерий плода-реципиента были характерны нормальные показатели кровотока, без повышения индексов сосудистой резистентности, регистрируемые вплоть до развития декомпенсированной трансфузии и гибели плодов. Особенностью плодовой гемодинамики близнеца-реципиента являлось нарастание объемной перегрузки с развитием застойной сердечной недостаточности, имевшей допплерографические проявления в виде повышения резистентности кровотока в субдиафрагмальных венозных сосудах плода прежде всего в венозном протоке. Ультразвуковым критерием позднего периода III клинической стадии ФФТС была регистрация допплерограммы венозного протока плода-реципиента с повышением систолодиастолического отношения (S/D) более 3,5. Таким образом, при тяжелом хроническом ФФТС именно патологические венозные допплерограммы реципиента свидетельствуют о скором развитии предтерминального состояния, что необходимо принимать во внимание при выработке акушерской тактики.
Вслед за регистрацией патологического спектра кровотока в венозном протоке быстро появлялись ультразвуковые признаки застойной сердечной недостаточности плода-реципиента: асцит, гидроторакс, гидроперикард либо анасарка, что отражало развитие IV клинической стадии тяжелого хронического ФФТС. Эта стадия в 2 случаях имела небольшую продолжительность (1-2 дня) и завершилась регистрацией внутриутробной гибели обоих пар плодов в 27 +4 и 28 +2 нед гестации; вес близнецов при рождении составил 690 и 1140 г и 810 и 1280 г, соответственно. В третьем случае при регистрации нарушений венозной гемодинамики реципиента было проведено оперативное родоразрешение в 30 +1 нед (вес при рождении составил 780 и 1630 г, меньший плод погиб интранатально, у большего плода имели место тяжелый интранатальный дистресс, полицитемия и неонатальные осложнения, связанные с недоношенностью).
Морфологическое исследование последа во всех случаях выявило наличие различных форм внутриплацентарных сосудистых анастомозов (артерио-артериальных, васкулярных цепей, артериовенозных, вено-венозных и сочетанных форм), а также внеплацентарных пуповинных аномалий.
В качестве иллюстрации синдрома острой межблизнецовой трансфузии и селективной задержки роста одного из плодов приводим клинические наблюдения.
Рис. 13. Беременность 31 нед. Монохориальная моноамниотическая двойня. Острая межблизнецовая трансфузия. Выраженное острое многоводие.
Рис. 14. Беременность 35-36 нед. Дискордантный рост монозиготных близнецов. Поперечные сечения туловищ плодов, имеющие разные диаметры и окружности. Допплерографически регистрировались признаки повышения резистентности в пуповинных артериях обоих плодов, венозная фетальная гемодинамика без изменений.
Выводы
В современной акушерской клинике сонография имеет безусловный приоритет как в первичной диагностике фето-фетального трансфузионного синдрома, так и в определении его клинической стадии, оценке гемодинамики фетоплацентарных систем плодов, их функционального состояния, прогнозировании перинатального исхода, дифференциальном диагнозе с другими вариантами осложнений монохориального многоплодия. Адекватный диагноз является необходимым условием выработки индивидуальной терапевтической тактики и cпособствует улучшению перинатальных результатов.
Литература
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Ультразвуковой скрининг при многоплодной беременности. Синдром фето-фетальной трансфузии и обратная артериальная перфузия. Лекция для врачей
Лекция для врачей «Ультразвуковой скрининг при многоплодии. Синдром фето-фетальной трансфузии и обратная артериальная перфузия». Лекцию для врачей проводит доктор медицинских наук, профессор кафедры акушерства, гинекологии и репродуктологии Н. Г. Павлова
На лекции рассмотрены следующие вопросы:
Дополнительный материал
Условные сокращения
ИКСИ — интрацитоплазматическая инъекция сперматозоида
МСС — максимальная систолическая скорость
МХДА — монохориальная диамниотическая двойня
САП — синдром анемии-полицитемии
СМА — средняя мозговая артерия
ТАР — трансабдоминальная амниоредукция
УЗИ — ультразвуковое исследование
ФЛК — фетоскопическая лазерная коагуляция анастомозов
ФФТС — фето-фетальный трансфузионный синдром
Введение
Монохориальное многоплодие является беременностью высокого риска в отношении неблагоприятных перинатальных исходов. Ангиоархитектура единой для двух плодов плаценты определяет как характер специфических осложнений, так и походы к их коррекции. ФФТС — одно из самых серьезных состояний, встречающихся исключительно при монохориальном многоплодии. Процесс изучения ФФТС является хорошим примером достижений в перинатальной медицине — смена диагностических критериев от педиатрических к пренатальным, развитие пренатального прогнозирования и подходов к лечению и динамическому наблюдению. ФФТС развивается примерно в 10—15% монохориальных двоен, т.е. примерно с частотой 1—3 на 10 000 беременностей. Учитывая широкое использование вспомогательных репродуктивных технологий, распространенность двоен продолжает расти. В 2012 г. в США было зарегистрированы 3 952 841 роды с частотой рождения двоен 33,1 на 1000, или 130 839 беременностей двойней, среди которых у 2—3%, или 3238 двоен крайне высок риск ФФТС. Применение вспомогательных репродуктивных технологий, в особенности интрацито- плазматической инъекции сперматозоида (ИКСИ) и отсроченного переноса эмбриона, увеличивает риск монохориальной плацентации в 3—4 раза. Также риск развития ФФТС увеличивается с возрастом матери.
Целью настоящего пособия является представить современный взгляд на патофизиологию, диагностику, подходы к лечению и наблюдению беременности, осложненной ФФТС.
Патогенез фето-фетального трансфузионного синдрома
Большинство исследователей считают, что ФФТС и синдром анемии-полицитемии (САП) развиваются вследствие несбалансированного сброса крови по васкулярным анастомозам общей плаценты. При фето-фетальном трансфузионном синдроме выделяют три типа анастомозов: поверхностные артерио-артериальные (АА), поверхностные вено-венозные (ВВ) и глубокие артериовенозные (ЛВ). Поверхностные анастомозы являются прямым сообщением между двумя участками вхождения пуповин, их ветви видны визуально и соединяются на поверхности плацентарной пластинки. Этот тип анастомозов обеспечивает быстрый сброс крови между плодами в обоих направлениях в зависимости от разницы в давлении в артериальной и венозной системах. В большинстве случаев трансфузия крови между плодами по АВ-анастомозам обычно сбалансирована и только в 15% развивается ФФТС. В соответствии с гипотезой «асимметричной редукции плацентарных анастомозов», существует множество двунаправленных артерио-венозных сообщений на ранних сроках беременности, но с ее прогрессированием происходит спонтанное закрытие или разрыв этих анастомозов. Наиболее тяжелые случаи ФФТС связаны с наличием глубоких артерио-венозных анастомозов и отсутствием поверхностных артерио-артериальных и вено-венозных. В случае если котиледон снабжается артерией от одного плода из двойни и дренируется веной другого плода, есть потенциальный риск сброса крови от донора (с артериальной стороны) к реципиенту (с венозной стороны). В такой ситуации более вероятно преобладание однонаправленных артерио-венозных анастомозов, чем двунаправленных артерио-артериальных. В таком случае формируется дисбаланс между кровотоком по мелким сосудам плаценты от плода-донора к плоду-реципиенту, что приводит к диссоциации развития плодов и развитию ФФТС. Артерио-артериальные и вено-венозные сообщения, в свою очередь, оказывают протективное действие и могут компенсировать артериовенозный сброс путем шунтирования кровотока между плодом и реципиентом (Denbow и соавт.). Несмотря на то что анастомозы и, как следствие этого, сброс крови между плодами имеются при всех монохориальных двойнях, ФФТС обычно развивается только при диамниотических двойнях. Это вероятно связано с тем, что при моноамниотических беременностях больше двунаправленных поверхностных анастомозов, чем при диамниотических.
Нарушенная васкулярная анатомия и аномальный сброс крови не единственные факторы, приводящие к развитию ФФТС. В настоящее время активно обсуждаются теории развития ФФТС как следствие нарушения регуляции транспорта жидкости через плаценту и амниотические оболочки. Варна и соавт. в 2003 г. исследовали роль натриуретического пептида в регуляции объема амниотической жидкости при монохориальных двойнях, осложненных хроническим ФФТС. Их данные показали, что концентрация натриуретического пептида коррелирует с количеством околоплодных вод. Концентрации натриуретического пептида у реципиентов с многоводием были почти в 7 раз выше, чем у доноров с маловодием. В другом исследовании Варна и соавт. в 1999 г. исследовали роль потенциального вазоконстрикторного фактора эндотелина-1 при ФФТС. В исследовании было показано повышение уровня эндотелина-1 у реципиента при тяжелом ФФТС, при этом причину этого явления объяснить не удалось. По одной из гипотез причиной выработки эндотелина является гипоксия, вследствие нарушения газообмена в части плаценты, принадлежащей реципиенту.
Кроме того, важную роль могут играть изменения в работе ренин-ангиотензиновой системы, которая активирована у донора и подавлена у реципиента. Увеличение концентрации ренина и ангиотензина снижает почечный и плацентарный кровоток донора, приводя к олигурии, маловодию и замедлению роста плода. Более того, эндотелин-1 и сброс ренина по анастомозам плаценты может быть причиной гипертензивной кардомиопатии у реципиента. Учитывая вышесказанное, оценка этих вазоактивных факторов может иметь большое значение в понимании патогенеза ФФТС.
При монохориальных двойнях первичное нарушение развития донорской части плаценты приводит к повышению периферического сопротивления плацентарной циркуляции, что приводит к сбросу крови к реципиенту, таким образом, донор страдает от гиповолемии вследствие кровопотери и гипоксии вследствие плацентарной недостаточности. Реципиент пытается компенсировать гиперволемию полиурией, но так как белки крови, остающиеся в его кровеносном русле, повышают онкотическое давление это приводит к перераспределению жидкости через плаценту из материнского организма.
На фоне прогрессирования кардиальной дисфункции у реципиента часто развиваются асцит и генерализованный отек и антенатальная гибель плода, что приводит к гипотензии у плода-донора, вследствие сброса крови по внутриплацентарным анастомозам. Это может приводить к внутримозговым кровоизлияниям и ишемии вплоть до гибели донора. Подобная картина развивается и при гибели донора, у реципиента также развивается гипотензия вследствие сброса крови по открытым анастомозам, однако вследствие снижения преднагрузки это может даже улучшить состояние плода-реципиента и его кардиофункцию.
Другой причиной высокой смертности и заболеваемости, связанной с ФФТС, являются преждевременные роды, вызванные многоводием плода-реципиента или антенатальной гибелью одного из плодов, что может приводить к гибели или неблагоприятным неврологическим последствиям для плода или новорожденного. По данным разных авторов неврологические нарушения встречаются среди 18—26% выживших при ФФТС.
Клинические проявления фето-фетального трансфузионного синдрома
Принципиальным клиническим признаком ФФТС является сочетание гиперволемии у плода-реципиента и гиповолемии у плода-донора с последующим возможным присоединением вторичных кардиоваскулярных изменений. Следует принимать во внимание, что признаки гипо- и гиперволемии изменяются в течение беременности, поэтому клиническая картина в первом и втором триместрах может различаться.
В первом триместре мочепродукция плодов вносит небольшой вклад в количество околоплодных вод, соответственно сочетание гипо- и гиперволемии не так выражено, как при поздних сроках беременности. На ранних сроках беременности основными признаками дисбаланса околоплодных вод являются дискордантность толщины воротникового пространства, а также аномалии кровотока в венозном протоке и трикуспидальная регургитация. Во втором триместре ведущим симптомом является наличие полиурии реципиента и олигурии донора. Нарастающее многоводие и кардиоваскулярные проявления у плодов определяют риск преждевременных родов, поражения внутренних органов и мертворождения. Гиперволемия реципиента проявляется при ультразвуковом исследовании наличием увеличенного в объеме перерастянутого мочевого пузыря, с нарушенной функцией сократимости и увеличением максимального кармана амниотической жидкости. У плода реципиента снижается частота опорожнения мочевого пузыря вплоть до полного отсутствия его наполнения в течение 60 мин. Проявления кардиальной дисфункции — атриовентрикулярная регургитация и реверсивный кровоток в дуге аорты. Последующее повышение пульсационного индекса в венозном протоке и наличие пульсовых волн в вене пуповины сопровождают формирование отека плода.
В третьем триместре беременности на передний план выходит диссоциация роста плодов и околоплодных вод, повышение сократительной активности матки может прогрессивно ухудшать гемодинамику плодов. Симптомы со стороны матери обусловлены многоводием, которое приводит к перерастяжению стенки матки, укорочению шейки матки и преждевременным родам. Довольно редким осложнением может быть развитие синдрома зеркала, выражающегося в анасарке у матери на фоне генерализованного отека плода. В случае быстрого развития отечного синдрома у матери в сочетании с дыхательной и сердечно-сосудистой недостаточностью следует исключить ФФТС.
Кроме хронического течения, в 2,5% случаев описана острая форма ФФТС, характеризующаяся разницей уровней гемоглобина у плодов более 80 г/л без ретикулоцитоза или гиповолемическим шоком. Эта форма течения ФФТС более характерна для первородящих при родах через естественные родовые пути.
Диагностика фето-фетального трансфузионного синдрома
Для диагностики ФФТС необходимо соблюдение следующих ультразвуковых критериев:
2) наличие максимального кармана амниотической жидкости 8,0 см — на другой стороне.
После установления диагноза ФФТС его стадия определяется в соответствии с классификацией Quintero:
Стадия I: соблюдены критерии ФФТС без признаков более тяжелых стадий.
Стадия II: мочевой пузырь донора не визуализируется при 60-минутном ультразвуковом исследовании, допплеровские показатели в норме.
Стадия III: критические нарушения гемодинамики при допплерометрии (отсутствие или реверсный диастолический кровоток в артерии пуповины, реверсный кровоток в венозном протоке или пульсирующий в вене пуповины) у любого плода.
Стадия IV: отек плода.
Стадия V: гибель одного или обоих плодов.
Применение диагностических критериев и классификации по Quintero позволяет исследователям сравнивать результаты различных методов лечения и формировать прогноз перинатальной выживаемости после терапевтических вмешательств.
Наблюдение беременных с фето-фетальным трансфузионным синдромом
До определения типа плацентации все беременности двойней должны расцениваться как группа риска ФФТС. Определение хориальности наиболее достоверно на ранних сроках беременности. Хориальность может быть определена уже на 4-й неделе беременности при использовании трансвагинального датчика. К 8-й неделе беременности появляется возможность визуализировать амниотическую мембрану как линейную структуру. Таким образом, к 9-й неделе беременности можно достоверно оценить тип многоплодной беременности. Дифференциальная диагностика монохориальной и дихориальной беременности сложна в случае сращения хорионов. В конце I триместра можно визуализировать структуры оболочек в месте слияния их с хорионом. Дифференциальный диагноз основывают на Т- и лямбда-признаках. Монохориальные двойни требуют наиболее тщательного наблюдения, учитывая, что сроки развития и темпы прогрессирования ФФТС крайне вариабельны. Ранняя диагностика и соответствующее лечение ФФТС позволяют пролонгировать беременность и улучшить выживаемость плодов.
Начиная с 16 недель беременности показано проведение ультра-звукового исследования каждые 2 недели. Необходимо оценивать максимальный и минимальный карманы амниотических вод, размеры мочевых пузырей и динамику роста плодов. Еженедельное ультразвуковое исследование показано при подозрении на формирование ФФТС, первым признаком которого будет дисбаланс околоплодных вод. При подтверждении диагноза ФФТС выполнение допплерометрии и цервикометрии позволяет уточнить стадию и принять решение о выборе адекватных лечебных вмешательств. Ультразвуковые признаки, указывающие на высокий риск развития ФФТС, включают дискордантность величин толщины воротникового пространства, патологический кровоток в венозном протоке в сочетании с разнице в размерах плода более 25%.
В процессе наблюдения монохориальных двоен необходимо учитывать риск развития синдрома анемии-полицитемии, которому будет посвящен отдельный раздел данного руководства.
Хотя различие в предполагаемом весе плодов не входит в диагностические критерии ФФТС, до 20% беременностей с селективным замедлением роста одного из плодов впоследствии развиваются в ФФТС и при позднем развитии в 30% имеется значимая дискордантность в показателях гемоглобина к моменту родов.
Принимая во внимание повышенный риск анеуплоидий и врожденных аномалий всем МХДА показано детальное ультразвуковое исследование, включающее эхокардиографию, в II триместре беременности. В 10% случаев МХДА конкордантны по структурным аномалиям, кроме того, в 6% особенности развития могут быть выявлены у одного из плодов. Наиболее часто выявляются врожденные пороки сердца, ЦНС, а также урогенитальные аномалии и дисгенезии клоаки. Среди аномалий развития ЦНС распространены вентрикуломегалия, гидроцефалия и микроцефалия. Перивентрикулярная лейкомаляция может развиваться в том числе и после лазерной хирургии вследствие реперфузионных нарушений.
На исход монохориальной беременности, осложненной ФФТС прогностически неблагоприятно влияет также неравномерное расположение «экватора» плаценты и также оболочечное прикрепление пуповины, хотя эти особенности не являются непосредственной причиной ФФТС. Степень выраженности диссоциации роста плодов коррелирует с неравномерным разделением плаценты и аномалиями прикрепления пуповины. При монохориальных двойнях как при наличии ФФТС, так и при его отсутствии, оболочечное прикрепление пуповины коррелирует с повышением риска развития плода, малого к сроку гестации, выраженной диссоциации развития плодов, а также антенатальной гибели плода. При ФФТС малая площадь плаценты и оболочечное прикрепление пуповины чаще встречается у доноров и ухудшает прогноз в отношении их выживаемости. Учитывая вышеизложенное, при выявлении в I триместре аномалий прикрепления пуповины эти пациенты требуют тщательного наблюдения, Учитывая высокий риск развития у них раннего ФФТС с неблагоприятным прогнозом в отношении плодов. Также показано, что повышение скорости кровотока в среднемозговой артерии у плода-реципиента перед планируемым оперативным лечением, является неблагоприятным фактором в отношении его выживаемости.
Лечение фето-фетального трансфузионного синдрома
При выжидательной тактике перинатальная смертность при ФФТС достигает 95%. Для лечения ФФТС применяются фетоскопическая лазерная коагуляция анастомозов плаценты, амнио- редукция, селективная редукция одного плода из двойни или прерывание беременности. Факторами, влияющими на выбор тактики, являются срок беременности, длина шейки матки, а также технические возможности, ограничивающие проведение фетоскопии (локализация плаценты, места прикрепления пуповин и особенности анатомии матери).
Подходы к коррекции ФФТС I стадии в настоящее время являются предметом активных дискуссий, так как описаны случаи спонтанного разрешения или отсутствия прогрессии данного состояния у 90% больных. До получения данных рандомизированного исследования, сравнивающего результаты выжидательной тактики и лазерной терапии, при I стадии возможно применение консервативной тактики, амниоредукций или лазерной хирургии. При прогрессировании ФФТС или укорочении шейки матки в связи с нарастанием многоводия показано проведение ФЛК.
При выявлении ФФТС ГГ—ГУ стадии при сроке 16—26 нед. беременности показано проведение ФЛК. СЛК воздействует на причину развития синдрома путем абляции сосудистых анастомозов плаценты. Эта операция выполняется с помощью эндоскопов диаметром 3,3 мм, которые используются для прямой визуализации сосудов на поверхности плаценты. После выявления коммуникантных анастомозов выполняется их коагуляция с использованием лазерной энергии, которая проводится в амниотическую полость с помощью кварцевого волокна через операционный канал эндоскопа. Техника хирургического вмешательства претерпела несколько модификаций. Вначале пересекались все сосуды, пересекающие амниотическую мембрану. Учитывая, что в таком случае пересекаются также сосуды, не соединяющие системы циркуляции обоих плодов и не участвующие в развитии синдрома ФФТС, Quintero и соавт. разработали методику селективной лазерной коагуляции. При этом подходе коагулируются только коммуникантные сосуды, которые могут анатомически быть не связаны с амниотической перегородкой (рис. 6—8). По данным двух контролируемых нерандомизированных исследований, в которых сравнивались серийные амниоцентезы и селективная фотокоагуляция анастомозов плаценты, частота выживания хотя бы одного плода составила 79% и 83,1%. Сравнивая данные этих исследований, частота выживаемости в группе амниоредукции составила 64,4% (78/121) по сравнению с 81,5% (137/168) в группе лазерной терапии (p=0,001). Отдаленная неврологическая заболеваемость в этих группах варьировала от 4,2 до 5,6%.
На этапе дебатов о потенциальной эффективности двух подходов к лечению ФФТС группа Eurofetus провела рандомизированное контролируемое исследование, в котором сравнивали серийные амниоцентезы и лазерную селективную фотокоагуляцию анастомозов плаценты. Предварительный статистический анализ показал необходимость включения в исследование 172 пациенток, чтобы подтвердить значимые различия между двумя терапевтическими подходами. Однако после включения 142 пациенток статистический анализ показал перинатальную выживаемость хотя бы одного плода в группе амниоредукции 51% (36/70) по сравнению с 76% (55/72) в группе лазерной коагуляции, в связи с чем исследование было остановлено. Также была выявлена четырехнедельная разница в продолжительности беременности между двумя группами (29 и 33 нед, амниоцентез и лазер, соответственно, p=0,003). В группе амниоцентеза частота неврологических отклонений была значительно выше (14% и 6%, p=0,02). Эта разница сохранялась в течение 6-месячного наблюдения.
В последние годы научная группа Quintero предложила третью модификацию операции лазерной коагуляции. Эта техника предполагает пересечение артериовенозных анастомозов от донора к реципиенту в первую очередь, с последующей коагуляцией оставшихся коммуникантов (последовательная селективная лазерная коагуляция анастомозов или ПСЛК). Выполнение лазерной абляции в такой последовательности позволяет предотвратить сброс крови донора в систему гемоциркуляции реципиента во время операции. ПСЛК характеризуется повышением частоты выживаемости обоих плодов по сравнению с СЛК (74% и 57%, p=0,005). Частота выживаемости хотя бы одного плода из двойни такая же (91% и 88%).
Противопоказаний к применению ФЛК нет, хотя укорочение длины шейки матки менее 15 мм может повышать риск преждевременных родов и требовать постановки акушерского пессария с целью коррекции истмико-цервикальной недостаточности. Лазерная хирургия должна проводиться перед амниоредукцией, которая может провоцировать разрыв амниотической мембраны или приводить к ухудшению визуализации вследствие кровотечения в амниотическую полость. Эти осложнения снижают эффективность фетоскопического вмешательства.
Сходные результаты были получены в ходе двух контролируемых нерандомизированных исследований, сравнивавших исходы серийных амниоцентезов и лазерной терапии, которые показали выживаемость хотя бы одного плода из двойни в группе амниоредукции 60,5% и 66,7% в группе лазерной терапии. Однако серийные амниоредукции являются паллиативной мерой, так как борются только с одним симптомом ФФТС, а именно с многоводием, и не воздействует на причину развития патологического состояния. Так как сосудистые анастомозы продолжают функционировать, физиологический стресс у плодов сохраняется, что клинически подтверждается высокой неонатальной смертностью среди выживших плодов. Данные в отношении отдаленных исходов развития нервной системы при лечении ФФТС методом амниоредукции показывают частоту церебрального паралича 5,8—22,5% и задержку развития 7,5—22,5%. В связи с этим в настоящее время амниоредук- ция считается методом выбора только при I стадии ФФТС или при сроке беременности более 24 нед, когда выполнение фетоскопиче- ской лазерной коагуляции технически может быть трудновыполнимо в связи с высоким риском развития кровотечения из коагулируемых анастомозов большого диаметра.
В последней публикации Общества Материнско-плодовой медицины (БМРМ), посвященной ФФТС, отмечено, что «фетоскопическая лазерная коагуляция анастомозов плаценты считается большинством экспертов наилучшим подходом к терапии II, III и IV стадий ФФТС при сроке менее 26 недель, однако мета-анализ не подтверждает его эффективность в отношении увеличения выживаемости плодов».
Селективный фетоцид применяется в случае выраженного селективного замедления роста одного плода с высоким риском его гибели, наличием аномалий развития или повреждения головного мозга одного плода из двойни. Наиболее часто применяется лазерная или биполярная коагуляция пуповины редуцируемого плода.
Подводя итог, современные данные подтверждают, что лазерная фетоскопия в специализированных центрах является терапией первой линии при ФФТС с 16-й по 26-ю неделю.
Исходы
Перинатальная смертность при ФФТС достигает без лечения 90— 95%. При использовании серийных амниоредукций перинатальная выживаемость достигала по данным различных исследований 68%. Перинатальная выживаемость при ФФТС после применения лазерной коагуляции анастомозов плаценты со временем улучшилась с 50% до 60—70%. К сожалению, риск потери беременности после этих процедур высок по-прежнему. Хотя риск антенатальной гибели плодов в группе ФФТС выше, чем при неосложненной многоплодной беременности, эта закономерность не прослеживается в отношении неонатальной смертности. ФФТС приводит к высокому риску внутриутробной гибели плода, однако прогноз для новорожденного зависит от степени недоношенности. Анализ неонатальной заболеваемости показывает, что новорожденные после ФФТС страдают более органоспецифическими проблемами. В группе ФФТС чаще встречается острая почечная недостаточность вследствие сниженной продукции мочи и высокий уровень креатинина в плазме крови. Как ни странно, но по данным некоторых авторов почечная недостаточность чаще встречается у реципиентов, чем у доноров. Во многом это можно объяснить тем, что при преждевременных родах часто развиваются серьезные кардиореспираторные проблемы, и в связи с этим вероятность развития острой почечной недостаточности у реципиента такая же, как у донора. В дальнейшем восстановление функции почек проходит обычно благоприятно.
Эхокардиография в неонатальном периоде выполняется только по показаниям, в основном при подозрении на персистирующий ductus arteriosus, в связи с чем пока нет полноценного представления о кардиофункции в постнатальном периоде. Гипотензия, требующая инотропной поддержки, случается в группе ФФТС достоверно чаще. Это косвенно подтверждает, что значимая кардиальная дисфункция встречается чаще. В этом случае целесообразно проведение рутинной оценки функции сердца для подбора оптимальной тактики лечения. Среди выживших при ФФТС высока частота отклонений при ультразвуковом исследовании головного мозга, вплоть до 28%. По данным Denbow и соавт., 35% пациентов с ФФТС имеют признаки антенатальных церебральных ишемических инсультов, приводя к кистам белого вещества, эхогенности базальных ганглиев, умеренной дилатации желудочков головного мозга. Клиническая значимость этих находок неясна, так же как и не описаны отдаленные исходы при их наличии. Относительно мало исследований посвящено отдаленным последствиям для плодов при ФФТС. При амниоредукциях частота повреждений головного мозга составляла до 25%.
Trespidi и соавт., которые предлагали тактику проведения агрессивных серийных амниоредукций, не описали продолжительность и протокол динамического наблюдения, но выявили до 15% серьезных отклонений, приведших в дальнейшем к инвалидности. Исследования, посвященные неврологическим последствиям при применении лазерной терапии ФФТС, выявили меньшую частоту повреждений головного мозга, с частотой не более 5%. Ville и соавт. сообщали о частоте инвалидности в связи с неврологическими отклонениями в возрасте до 1 года около 4,2%. Следует отметить, что почти 70% родов в этой группе произошло при сроке беременности более 32 недель. Лазерная коагуляция анастомозов прерывает сосудистые коммуникации между системами гемоциркуляции двух плодов, хотя при этом отмечается значительный риск внутриутробной гибели. Если это происходит с плодом-донором, то это последствие острой облитерации части плаценты плода, который и так находится в состоянии дефицита кровотока. Гибель обоих плодов происходит обычно при неполной коагуляции анастомозов, при которой вместо разобщения циркуляций происходит прогрессирование шунтирования крови от одного плода к другому. При проведении успешной коагуляции беременность следует пролонгировать, и это профилактирует развитие нарушений гемодинамики, приводящих к повреждению ткани головного мозга. С улучшением технологии выполнения лазерной коагуляции вероятно удастся снизить перинатальные потери при данном вмешательстве. С другой стороны, серийные амниоредукции, снижая количество околоплодных вод приводят к пролонгированию беременности, при этом не влияя никак на процесс шунтирования крови из циркуляции одного плода к другому. Hecher и соавт. сравнили эффект от серийных амниоредукций и лазерной коагуляции в двух европейских центрах. В группе лазерной коагуляции было значительно больше внутриутробных гибелей одного из плодов, но ниже частота гибели обоих плодов. В общем, выживаемость была сходной в обоих группах. Однако при дальнейшем наблюдении в группе амниоредукций было выявлено большее количество аномальных сканов головного мозга плода при нейросонографии (дефектов паренхимы, микроцефалии и перивентрикулярных кровоизлияний).
Как описано выше, частым осложнением при ФФТС является гибель одного плода из двойни. При этом в случае гибели плода-реципиента происходит сброс крови по закону сообщающихся сосудов от плода-донора, вызывая еще большую его анемизацию и гиповолемию, и, как правило, приводя к летальному исходу. При гибели плода-донора прогноз для реципиента более благоприятный. При ФФТС у реципиента часто развивается стеноз легочной артерии, что отражает наличие правожелудочковой сердечной недостаточности вследствие перегрузки объемом или увеличения постнагрузки. В случае гибели одного плода in utero у выжившего плода развивается острая анемия, вследствие того, что кровь от выжившего плода оттекает к мертвому по плацентарным анастомозам плаценты. Изменения гемодинамики выжившего плода можно описать как острую кровопотерю, которая происходит сразу после гибели другого плода.
Трансфузия крови от выжившего реципиента к донору уменьшает объем, перегружающий его кровеносную систему, приводящую к быстрому прогрессивному восстановлению функции сердца, поэтому ранняя гибель плода-донора может играть значительную роль в улучшении состояния гемодинамики реципиента при ФФТС. Описанный выше сценарий частично объясняет, почему перинатальный исход зависит от того, кто из плодов погибает первым, донор или реципиент. Baioria и соавт. наблюдали спонтанное разрешение многоводия и отека плода в 6 из 10 случаев выживания реципиента после гибели плода-донора. Альтернативным путем можно добиться благоприятного исхода для реципиента можно путем пересечения однонаправленных анастомозов в плаценте. Случаи внутриутробной гибели донора могут также быть в ситуации, когда имеет место тяжелый СЗРП у донора в сочетании с тяжелой кардиоваскулярной недостаточностью у реципиента или выраженным гемодинамическим дисбалансом между донором и реципиентом, приводящим к высокой смертности заболеваемости в случае выживания реципиента. По данным рандомизированных исследований заболеваемость выжившего при гибели одного плода из двойни при лечении ФФТС методом серийных амниоредукций выше (35%), чем при использовании лазерной коагуляции анастомозов плаценты (7%). Это можно объяснить предотвращением сброса крови к мертвому плоду путем коагуляции анастомозов. Выявление анемии или ишемических повреждений головного мозга у выжившего плода свидетельствует о неполной коагуляции анастомозов. При ФФТС стеноз легочной артерии часто развивается у плода реципиента вследствие наличия недостаточности правых отделов сердца из-за перегрузки объемом или постнагрузки. Признаки недостаточности правых отделов сердца (выраженный реверсный кровоток в предсердие и высокие значения пульсационного индекса в венозном протоке) быстро исчезают в случае гибели плода-донора. Благоприятный исход может быть достигнут с помощью ограничения кровотока по трансплацентарным анастомозам от донора к реципиенту, который может персистировать до гибели донора. Однако восстановление кардиальной функции плода-реципиента в такой ситуации требует гораздо большего времени, по сравнению со случаями, в которых происходит острая кровопотеря. Факт, что во многих случаях у плода при рождении не отмечается анемии, можно объяснить длительным временным промежутком с момента внутриутробной гибели одного плода до рождения. Если первым погибает плод-донор, сброс крови усугубляет уже имеющуюся анемию в результате фето-фетальной трансфузии, что приводит к его гибели или тяжелым ишемическим повреждениям головного мозга.
Описаны артерио-артериальные, артерио-венозные и веновенозные анастомозы плаценты, однако глубокие анастомозы практически всегда артерио-венозные. Соотношение различных типов анастомозов может играть роль в развитии ФФТС и перинатальном исходе монохориальной беременности. При беременностях, осложненных ФФТС выявлено примерно одинаковое количество артерио-венозных и вено-венозных анастомозов по сравнению с нормально протекающими беременностями, но меньшее количество артерио-артериальных. Вено-венозные анастомозы отсутствуют в 75% монохориальных двоен, независимо от наличия или отсутствия ФФТС и их связывают с снижением перинатальной выживаемости. Действительно, поверхностные вено-венозные анастомозы часто наблюдаются при гибели одного плода из двойни. Это позволяет предположить, что гибель одного плода из двойни чаще встречается при наличии вено-венозных анастомозов. Однако описанная частота вено-венозных анастомозов по данным ряда исследований составляет 18% случаев гибели одного плода из двойни. При этом предполагается, что частота таких анастомозов при монохориальном многоплодии составляет 20%. И поэтому до сих пор окончательно неясно, играют ли вено-венозные анастомозы или наличие глубоких артерио-венозных и/или артерио-артериальных анастомозов в развитии ФФТС, приводящего к гибели одного плода из двойни и выживанию второго.
Синдром анемии-полицитемии
Синдром анемии-полицитемии еще одно недавно описанное осложнение монохориального многоплодия, в патогенезе которого также ключевое значение имеют сосудистые анастомозы плаценты. Основным клиническим признаком этого состояния является дискордантность уровня гемоглобина при отсутствии дисбаланса околоплодных вод, в отличие от ФФТС. САП может развиваться спонтанно или ятрогенно после выполнения ФЛК. Частота развития спонтанного СП 3—5% монохориальных двоен, распространенность ятрогенных случаев — 2—13% среди всех ФЛК.
В отличие от случаев классического ФФТС, плацента при САП характеризуется более мелкими (менее 1 мм в диаметре) артерио-ве-нозными анастомозами и отсутствием артерио-артериальных анастомозов. В связи с этим происходит медленный трансфер крови от одного плода к другому при отсутствии значимого транспорта вазоактивных агентов. В случае ятрогенного развития САП сброс крови происходит по мелким резидуальным анастомозам, которые не были коагулированы при ФЛК. Относительно небольшие объемы сброса крови между плодами объясняют факт, что клинические проявления САП в отличие от ФФТС, как правило, выявляются после 26 недель беременности или спустя 1-5 недель после успешной ФЛК на фоне разрешения ФФТС.
Реже причиной спонтанного развития САП может быть тромбоз анастомозов, выполняющих «протективную» роль в обеспечении баланса циркуляции крови. Кроме того, важно дифференцировать САП от острого сброса крови во время родов, так как оба этих состояния клинически проявляются внешне бледными кожными покровами одного плода и плеторой у другого. В этом случае для хронического течения САП характерен дисбаланс ретикулоцитов и наличие мелких анастомозов при инъекционном окрашивании плаценты.
Диагноз САП основывается на выявлении признаков анемии у одного плода и полицитемии у другого. Для пренатального выявления САП применяют допплеровскую оценку скоростей кровотока в средней мозговой артерии. Повышение скорости кровотока более 1,5 МоМ у одного плода и снижение менее 1 МоМ у другого принято считать диагностическими критериями САП. Менее объективными ультразвуковыми признаками САП являются различия в толщине и эхогенности плацентарных территорий анемичного и полицитемичного плодов.
После родов диагноз САП основывается на сочетании различий в значении абсолютных уровней гемоглобина у плодов и наличии ретикулоцитоза у анемичного плода как подтверждения хронической природы процесса. Абсолютные значения гемоглобина менее 110 г/л у анемичного и более 200 г/л у полицитемичного плодов являются диагностическим критерием. Альтернативным подходом является выявление разницы в 80 г/л у плодов.
Классификация САП в некоторой мере сходна с классификацией ФФТС по Quintero, в том числе в интерпретации прогрессирования синдромов в зависимости от стадии (таблица).