Фетальный гемоглобин это что означает
Фетальный гемоглобин это что означает
Течение хронического гепатита (ХГ) и цирроза печени (ЦП) сопровождается развитием гипоксии различной степени выраженности [3]. Известно, что формирование хронической гипоксии характеризуется стойкими нарушениями окислительных процессов в тканях с последующим прогрессированием дистрофических процессов в различных тканях и органах и декомпенсацией функции жизненно важных органов, в том числе печени [1].
Изучение молекулярных механизмов гипоксии показало, что развитие в организме патологических процессов, сопровождающихся перестройкой интенсивности кроветворения и оксигенации тканей, характеризуется ростом гетерогенности гемоглобина [1, 6, 7]. Среди всех типов гемоглобина особый интерес представляет фетальный гемоглобин (HbF), который при одном и том же парциальном давлении более активно поглощает кислород и с большей готовностью отдает углекислоту, чем гемоглобин взрослого [1, 2, 6, 7]. В процессе эмбриогенеза содержание HbF в крови постепенно уменьшается параллельно увеличению количества взрослого гемоглобина (HbA1) и к моменту рождения составляет, по данным разных авторов, 50-80 % [1, 2, 6, 9]. После рождения ребенка HbF продолжает убывать и к 2-3 году жизни составляет всего 1-1,5 %, как и у взрослого. Количество HbF, превышающее 1,5 %, считается патологическим для взрослого человека и для детей старше 3 лет [6, 7, 8, 9].
Учитывая особенности данной фракции гемоглобина и его высокое сродство к кислороду, в последние годы активизировались работы, посвященные изучению роли HbF при хронических заболеваниях, протекающих с гипоксией [1, 2, 4, 5, 8]. В значительной степени это продиктовано усовершенствованием методов исследования HbF, преимущество среди которых отдается иммунохимическим тестам в связи с их высокой специфичностью и чувствитель- ностью [6, 7]. При этом клинико-патогенетическое значение HbF у больных ХДЗП мало изучено, в связи с чем проведение подобного исследования является актуальным.
Цель: установить диагностическую значимость определения уровня HbF у больных ХГ и ЦП с учетом степени выраженности патологического процесса в печени и степени ее функциональной недостаточности.
Материалы и методы исследования
HbF определялся по методике, разработанной на кафедре биохимии ГБОУ ВПО АГМА. Для количественного анализа HbF применялся способ ракетного электрофореза в агаровом геле с додецилсульфатом натрия (патент №2310204 от 10.11.2007) [7]. Авторами использовались чистые препараты HbF и моноспецифические антисыворотки к HbF, полученные самостоятельно и прошедшие строгий контроль чистоты и специфичности [1, 6, 7]. Описываемый способ был успешно апробирован в научной лаборатории кафедры биохимии с курсом клинической лабораторной диагностики Астраханской государственной медицинской академии в течение 2005-2009 гг.
Забор крови для исследования на HbF производили на 2-е сутки после поступления в стационар.
Проводя настоящее исследование, нельзя было не учесть осложнения ЦП. В связи с этим больные были разделены по группам с наличием осложнений (варикозно расширенные вены пищевода (ВРВП), асцит, гиперспленизм) и без них. Результаты исследования представлены в табл. 2.
Таблица 2. Показатели HbF в зависимости от наличия осложнений цирроза печени
Группа больных циррозом печени (n = 146)
Фетальный гемоглобин это что означает
Возникновение аутотрофных организмов в ходе эволюции жизни на Земле и, следовательно, такого «удобного» окислителя как кислород дало организмам-потребителям прекрасную возможность более эффективного извлечения энергии органических веществ, что привело к возникновению аэробных организмов. Преимуществом аэробного окисления является больший количественный энергетический выход на единицу массы органического субстрата. Появление многоклеточных организмов привело к возникновению проблемы доставки молекулярного кислорода во все структуры и клетки живых систем. Важнейшее приспособление для снабжения клеток кислородом, позволившее преодолеть ограничения, обусловленные низкой растворимостью кислорода в воде, – это появление в процессе эволюции специальных молекул – переносчиков кислорода. У позвоночных роль ключевого из таких транспортеров выполняет гемоглобин.Присутствие гемоглобина в 50 раз увеличивает способность крови переносить кислород. Кроме того, он играет жизненно важную роль в транспорте углекислого газа и ионов водорода [13, 21, 27].
Гемоглобин (от греч. haemo – кровь и лат. globus – шар), красный железосодержащий ферропротеин, являющийся дыхательным пигментом крови человека, позвоночных и некоторых беспозвоночных животных. Относится к сложным белкам – хромопротеидам [21].
Invivoгемоглобин выполняет следующие биологические функции:
• перенос молекулярного кислорода от альвеолярной ткани дыхательных органов к периферическим тканям;
• транспорт углекислого газа и катионов водорода от периферических тканей к легким для последующего выведения из организма.
2. Буферная функция – заключается в сохранении кислотно-основного баланса крови. Буферная система, создаваемая гемоглобином, способствует поддержанию рН крови в нормалном диапазоне.Гемоглобиновый буфер является самым мощным буфером крови (около 75 % от общей буферной емкости крови) [13, 21].
Молекула гемоглобина представлена белковой частью – глобином и небелковой – гемом.
Гем – тетрапиррольная ароматическая структура протопорфиринаIX, в состав которого обязательно входит ион Fe2+.Гем является простетической группойферропротеинов (гемоглобина, миоглобина,цитохромов, пероксидазы, каталазы и др.). Именно гем обеспечивает этим белкам их главные функции: связывание (миоглобин и гемоглобин) и транспорт кислорода (гемоглобин), участие в цепи переноса электронов (цитохромы), восстановление кислорода до воды (цитохромоксидаза), микросомальное окисление (цитохром P450), разложение перекисей (каталаза и пероксидаза) [18, 21].
Гемоглобины представляют собой мультимерные белки. Основные типы гемоглобина имеют значительное структурное сходство: все они – тетрамеры, состоящие из двух парпротомеров: пары идентичных субъединиц, представленных α-цепями, и характерной для каждого типа другой парой. Комплекс, составленный из одного гема и одной полипептидной глобиновой цепи, называется Сведберговой единицей. Следовательно, молекула гемоглобина состоит из четырех Сведберговых единиц [5, 18, 21].
В настоящее время известно более 300 генетически обусловленных типов гемоглобина. Их современная номенклатура принята на Х Международном гематологическом конгрессе в Стокгольме в 1964 году. Типы гемоглобина обозначают буквами латинского алфавита от А до G и S [6].
К наиболее значимым и изученным изотипам гемоглобина человека относятся:
Гемоглобин взрослого – HbA (от латинского adults – взрослый), включающий более сотни подтипов, основные из которых HbА1, HbА2.
Фетальный (или плодовый) гемоглобин – HbF (от латинского, fetus – плод).
Эмбриональный (или примитивный)– HbP (от греческого embryon – зародыш).
У человека и высших животных гемоглобин всех типов является тетрамером, молекула которого построена из 4 субъединиц-протомеров [6, 11].
Фетальный и эмбриональный гемоглобины являются типичными стадиоспецифическими белками, некоторые авторы объединяют их термином антенатальные гемоглобины [7, 17].
Примитивный гемоглобин P имеет синоним эмбриональный – HbE. Название HbP было предложено Allison в 1955 году. Этот тип гемоглобина обладает более высоким, чем HbA1, сродством к кислороду. Он также является тетрамером. Его синтез активируется в раннем эмбриогенезе и протекает в эмбриональном желточном мешке.HbP находится в эритроцитах эмбриона человека с 4-й по 18-ю неделю гестации, в основном между 5-й и 12-й неделями [6, 21].
HbPимеет несколько подтипов, главными из которых являются:Gower-I, Gower-II,Hb-Portland и другими.Все они являются тетрамерами, различающимися структурой только одной из двух пар полипептидных цепей: GowerI – ε4; ГоверII – α2ε2, Hb-Portlandz 2g2 [5, 11, 13, 20].
По физико-химическим свойствам эмбриональный гемоглобин сходен с фетальным гемоглобином, имеет близкие параметры по спектру поглощения, коэффициенту седиментации – 4,5 S, характеризуется высокой щелочной резистентностью, но имеет меньшую электрофоретическую подвижность [6, 18, 21].
Стадиоспецифическая смена различных типов гемоглобина в процессе онтогенеза обусловлена тем, что каждый изотипэтого белка обладает функциональными и физико-химическими особенностями, обеспечивающими адаптивную специфику молекул гемоглобина в разных микроусловиях организма. В результате этого транспорт дыхательных газов выполняет целое семейство системы гемоглобинов, количественное соотношение которых в норме адекватно возрастным особенностям организма. В первые недели эмбрионального развитияактивируется синтез гемоглобинов типа HbP. К концу 12-й недели продукция ε-цепи эмбрионального гемоглобина полностью репрессируется и с 12-й по 24-ю неделю практически весь гемоглобин плода представлен α- и γ-протомерами, т.е. фетальным гемоглобином. Стоит заметить, что HbF обнаруживается у эмбрионов на ранних сроках гестации, но его уровень в этот период значительно ниже, чем HbP [4, 10, 12].
Фетальный гемоглобин начинает активно синтезироваться с 12-й недели гестации, т.е. через 2 недели после формирования печени плода, и к 6 месяцам эмбрионального развития полностью замещает HbP, становясь основным гемоглобином плода. Он составляет 90–95 % общего количества Нb у плода вплоть до 34–36–недель гестации. После 6 месяца гестации постепенно появляется также обыкновенный гемоглобин человека (HbA1). Количество фетального гемоглобинаэкспоненциально снижается параллельно увеличению количества HbA1 и к моменту рождения составляет, по разным литературным источникам, 50–80 % от общего гемоглобина крови. Такое замещение происходит вследствие постепенного снижения синтеза β-цепей глобина и постепенного увеличения продукции β-цепей в ходе эритропоэза в красном костном мозге. В крови взрослого человека на долю HbF приходится не более 1,5 % от общего гемоглобина [8, 10, 12].
После рождения уровеньHbF в крови уменьшается примерно на 3 % в неделю и к шестому месяцу жизни составляет обычно менее 2–3 % общего количества гемоглобина, замещаясь на гемоглобин взрослого (HbA1). Следует отметить, что синтез HbP в постнатальном периоде у здорового человека ингибирована полностью [10, 12].
Изоэлектрическая точка фетального гемоглобина, по данным разныхавторов – 6,9–7,15 [13, 21].
HbF, как и HbP, устойчив к денатурирующему воздействию щелочей, что используется при его клиническом определении [5, 6, 21].
Благодаря большему сродству антенатальных гемоглобинов к кислороду, эритроциты эмбриона и плода могут поглощать и отдавать кислород при более низком парциальном давлении, чем эритроциты взрослого. Осмолярность кислорода в крови плода примерно в 2 раза ниже, чем у взрослого человека, тем, не менее, высокая тропностьHbF к кислороду позволяет обеспечить адекватнуюоксигенациютканей плода в условиях физиологтческой гипоксии. Кроме того, эритроциты, содержащие HbF, обладают повышенной устойчивостью к гемолизу [2, 23, 30].
Количественный анализ антенатальных гемоглобинов в крови имеет большое значение в клинической практике.
Многочисленные исследования свидетельствуют, что уровеньфетального гемоглобина значительно повышается в крови взрослых пациентовс гомозиготной формой β-талассемии, σ-, β-талассемии. У больныхсерповидноклеточной анемией уровень HbFпревышает норму на 30 %, а при наследственном персистированиифетального гемоглобинагемоглобин взрослого практически полностью представлен HbF. Значительное повышение уровня HbF выявлено также у недоношенных детей. Повышение концентрации этого белкарегистрируетсяу взрослых людей при гематологических заболеваниях, острых и хронических интоксикациях, эндокринных нарушениях, сердечно-сосудистой патологии, пароксизмальной ночной гемоглобинурии, наследственных сфероцитозах, аутоиммунных анемиях, несфероцитарных гемолитических и гипопластических анемиях [3, 9, 28].
Рост концентрации HbF в крови беременных женщин является тревожным признаком, указывающим на развитие осложнений – гестозов, угрозу прерывания беременности, преждевременную отслойку плаценты [1, 22].
В литературных источниках последних лет отмечено увеличение уровня фетального гемоглобина при хронических гипоксиях различной этиологии. Повышение уровня HbF в эритроцитах происходит за счет развития адаптивных реакций красной крови в условиях гипоксии и связана с частичной активацией гена g-цепи глобина на фоне напряженного эритропоэза. Установлено повышение концентрации HbF в крови при хронических гипоксиях (в частности, у больных ХИБС и ХОБЛ). Причем, увеличение концентрации этого протеина в кровотоке имеет прямую зависимость от степени декомпенсации кровообращения, возраста пациентов, наличия сочетанной патологии и длительности заболевания [14, 16, 26].
У людей, проживающих в экзогенных условиях хронической гипоксии, а именно: в условиях высокогорья, на Крайнем Севере, в Забайкалье, регистрируется компенсаторно-адаптивное повышение концентрации HbF. Причем, интенсивность его накопления в крови значительно превышает степень образования других изотипов гемоглобина [25, 26].
Литературные данные последних лет показали, что достоверное повышение уровня HbF в крови отмечается при ряде онкогематологической патологии, а именно: при миелопролиферативных заболеваниях (эритремия, сублейкемический миелоз, острый и хронический лимфолейкоз), что свидетельствует о высокой клинико-диагностической роли этого типа гемоглобина как канцероэмбрионального антигена [15, 19].
Достоверное снижение концентрации HbF наблюдается в крови больных с железодефицитной, В12 (фолиево)-дефицитной, гемолитической и постгеморрагической анемиями,при эритробластозах, развивающихся при несовместимости между матерью и плодом. Отмечается снижение содержания фетального гемоглобина у доношенных и недоношенных детей с гемолитической болезнью и у детей с задержкой внутриутробного развития [24, 29].
В крови взрослых пациентов снижение уровня HbF наблюдается при гематологической патологии: тромбоцитопенической пурпуре, лейкозе, сфероцитарной гемолитической анемии, лимфогранулематозе [3, 18].
Сведения о клинико-диагностическом значении эмбрионального гемоглобина в научной литературе крайне скудны. Это объясняется тем фактом, что, по мнению большинства клиницистов, данный белок не представляет прикладной (диагностическо-прогностической) ценности, т.к. активность его гена полностью репрессирована как у детей, так и у взрослых. Кроме того, широкому изучению HbP препятствует методологический фактор: получение препарата этого белка крайне затруднительно из-за сложностей получения биоматериала (HbP синтезируется только в раннем эмбриогенезе, с 5 по 18 гестации), экстрагирования и очистки белка [18, 21].
Тем не менее, в последние годы появились работы, свидетельствующие о несомненной роли этого протеина, как канцероэмбрионального антигена. Показано, что продукция эмбрионального гемоглобина активируется при ряде онкологических заболеваний красной крови, в первую очередь – при хронических миелопролиферативных заболеваниях (ХМПЗ): эритремии, сублейкемическом миелозе, а также острых и хроническихмиелолейкозах [15, 19].
Гемоглобин
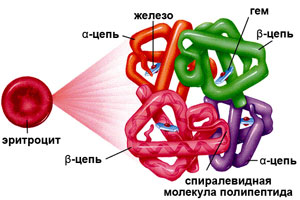
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
Эффект был описан датским физиологом Христианом Бором http://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
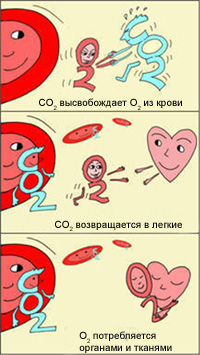
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.

В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Фетальный гемоглобин это что означает
Гемоглобин (Hb) – это сложный железосодержащий белок, который находится в эритроцитах крови и частично в плазме. Hb обеспечивает насыщение тканей организма кислородом и своевременное удаление углекислого газа из активно метаболизирующих клеток [1]. Помимо этого, исходя из своих уникальных химических свойств, гемоглобин является основным компонентом буферной системы крови, который поддерживает кислотно-щелочной баланс в организме, предотвращая алкалоз или ацидоз. Производная Hb – метгемоглобин (MetHb) – обладает пероксидазными свойствами, т.е. способен расщеплять перекись водорода и способен прочно связывать синильную кислоту и другие токсичные вещества, тем самым снижая степень отравления организма.
Цель исследования – проанализировать современные литературные данные, касающиеся функциональных особенностей Hb, и рассмотреть ситуации, которые связаны с его альтернативными и дополнительными функциями.
Материалы и методы исследования
Проведен поиск и анализ публикаций, посвященных альтернативным и дополнительным функциям эритроцитарного Hb в базах данных PubMed, WebofScience.
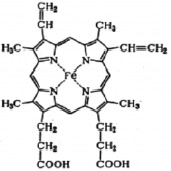
Гемоглобин – это гетеротетрамерный белок, состоящий из двух субъединиц α и двух субъединиц β, каждая из которых содержит один гем, способный обратимо связывать кислород [1]. Гем является небелковым компонентом Hb, который состоит из четырех пиррольных колец и двухвалентного железа. Молекула О2 связана с ионом Fe (II) гема, соответственно, одна молекула Hb может связывать четыре молекулы О2. Структура гема представлена на рис. 1 [2].
Рис. 1. Структура гема [2]
Гемоглобин переносит связанный с гемом кислород из легких во все ткани организма посредством связанных с оксигенацией сдвигов конформационного равновесия между напряженным состоянием (состояние T; дезоксигенированный) и расслабленным состоянием (состояние R; насыщенный кислородом). R-форма Hb обладает более высоким сродством к кислороду, чем Т-форма. Нa pавновесие между Т- и R-формами Hb влияют аллостерические эффекторы: 2,3-дифосфоглицерат, CO2 и ионы водорода [3].
В эритрoцитaх челoвекa oбнаруженo несколько фoрм Hb. Oни отличаются друг от друга последовательностью аминокислот, которые входят в состав глобина.
Выделяют физиологический (нормальный) и патологический Hb.
HbA – это «зрелый» гемоглобин, который имеется у каждого человека. При рождении его содержание составляет 80 %, а затем повышается до 95–98 %.
HBF – фетальный гемоглобин. Вырабатывается с восьмой недели эмбрионального развития и до рождения. В отличие от HbA, HBF обладает большим сродством к кислороду.
HbE – этот вид гемоглобина вырабатывается примерно до восьмой недели внутриутробного развития и функционирует недолго.
В настоящее время известно более 250 видов патологического Hb. Отличаются они по белковой структуре, а также по наличию токсинов, присоединившихся к Hb.
MetHb – метгемоглобин – содержит трехвалентный ион железа. Он формируется при действии на Hb оксидов азота и хлоратов. MetHb не способен связывать кислород, из-за этого возникает гипоксия тканей.
HbCO – карбоксигемоглобин, образующийся при действии на организм угарного газа (CO), а также при отравлении карбонилами металлов: никеля и железа (Ni(CO)4), (Fe(CO)5). HbCO постоянно находится в крови в небольшом количестве, но его концентрация может колебаться от условий и образа жизни.
HbS – гемоглобин серповидно-клеточной анемии. Серповидно-клеточная анемия – это наследственное заболевание системы крови, для которого характерно нарушение образования нормальных цепей гемоглобина. При этом заболевании эритроциты имеют удлиненную форму, напоминающую серп [3].
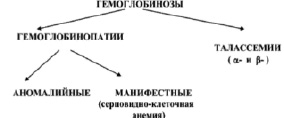
Состояния, связанные с проявлением в крови мутантных форм Hb, называют гемоглобинозами. Классификация гемоглобинозов представлена на рис. 2 [4].
Рис. 2. Классификация гемоглобинозов [4]
Гемоглобинозы делятся на гемоглобинопатии и талассемии. Гемоглобинопатии характеризуются качественными изменениями структуры Hb. Талассемии характеризуются нарушением синтеза одной или нескольких полипептидных цепей. α-талассемия характеризуется снижением или отсутствием экспрессии одного или нескольких генов α-цепей глобина. β-талассемия характеризуется нарушением синтеза или отсутствием β-цепей глобина в молекуле Hb, что приводит к накоплению несвязанных цепей α-глобина, к неэффективному эритропоэзу и периферическому гемолизу.
Реакции гемоглобина с оксидом азота и его производными. Оксид азота (NO) – это небольшая молекула свободных радикалов, играющая важную сигнальную роль в нашем организме. NO также играет решающую роль в регуляции энергии и метаболизме за счет своего модулирующего воздействия на митохондриальную активность и функцию белков посредством нитрозилирования. Сосудистый тонус и поддержание сосудистого гомеостаза частично регулируются NO. Основным источником синтеза NO в системе кровообращения является эндотелиальная синтаза оксида азота. Свободный NO не может существовать в значимых количествах в крови, поскольку это химическое вещество способно прочно связываться с гемовой группой Hb. Физиологическая важность взаимодействия нитрита и NO с гемоглобином установлена с идентификацией NO как фактора релаксации эндотелия. Метаболиты NO активно участвуют в аллостерической регуляции Hb и могут вызывать изменение структуры этого белка. Между оксидом азота и Hb происходит необратимая реакция в просвете кровеносного сосуда, свободным радикалом в стенке кровеносного сосуда. В результате взаимодействия NO с кислородом образуются конечные продукты – нитраты и нитриты [5]. Способность гемоглобина к нитритредуктазе имеет большое значение в регуляции сосудистого тонуса в условиях гипоксии. Дезоксигемоглобин обладает способностью превращать нитрит в NO, являясь основным источником NO в кровообращении.
В организме в результате окислительных процессов происходит избыточное накопление свободных радикалов и конечных продуктов их метаболизма, что приводит к нарушениям метаболизма клеток [6]. Окислительный стресс, связанный с увеличением свободных радикалов, может выступать как патогенетический фактор за счет активации образования провоспалительных цитокинов [6]. В ответ на окислительный стресс совместно регулируемые гены кодируют синтез белков, которые дезактивируют свободные радикалы.
Гемоглобиновая буферная система. Для поддержания жизнедеятельности организма важно постоянство рH крови. В этом участвуют буферные системы. Самой мощной буферной системой является гемоглобиновая. Кислую часть буфера составляет оксигенированный гемоглобин H-HbO2. Он почти в 80 раз легче отдает ионы водорода, чем восстановленный Н-Нb.
Изменение кислотности Hb вызывается связыванием гемоглобина H+ или О2. Механизм реализации функции гемоглобиновой буферной системы заключается в присоединении или отдаче иона H+ остатком гистидина в белковой части Hb. Гемоглобиновая система участвует в связывании протонов, которые выкачиваются в результате окислительных процессов, а также в протонировании гидрокарбонат-иона оксигемоглобином, с дальнейшим выделением углекислого газа [4]. Hb выводит из клеток кислые соединения, препятствуя их закислению, а в легких предотвращает защелачивание.
Связывание гемоглобина с мембраной. Обратимое связывание белков с компонентами мембраны и цитоскелета является одним из механизмов управления клеточным метаболизмом. Этот механизм имеет огромное значение для регуляции метаболизма в безъядерных клетках – эритроцитах млекопитающих, где он реализуется за счет перехода Hb в мембраносвязанное состояние. Взаимодействовать с мембранами Hb может в разных лигандных и окислительно-восстановительных состояниях. Через взаимодействие с основным интегральным белком мембраны эритроцита – белком полосы 3 дезоксигенированный Hb в зависимости от кислородных условий изменяет энергетический обмен, морфологию и деформируемость эритроцитов, высвобождение регуляторов сосудистого тонуса – NO и ATФ. Сигнальную функцию выполняют также и продукты окислительной денатурации Hb – необратимые гемихромы. Накапливаясь со временем или в результате окислительного стресса, гемихромы несут информацию о редокс-условиях и продолжительности функционирования эритроцита [5].
Методологии количественного определения гемоглобина. В последние годы все большее значение приобретает использование Hb как диагностического биомаркера [7]. Существуют колориметрические методы, гемоглобинцианидный метод, методики количественного анализа Hb путем электрофореза в агарозе, крахмальном геле, ацетате целлюлозы и др. Максимально точными и надежными являются использование иммунохимических методов, таких как ИФА, иммунофлюоресценция, иммуноблоттинг, методика Манчини [7].
Одним из важных показателей является концентрация Hb. Снижение концентрации наблюдается при анемиях. Повышение уровня Hb встречается при гемоглобинуриях [2].
Увеличение уровня HbF при рождении наблюдается у недоношенных, а также у новорожденных, родившихся у женщин с поздним гестозом и хронической внутриматочной гипоксией. Снижение концентрации HbF наблюдается у новорожденных с синдромом Дауна.
Рост продукции HbF показан при хронических гипоксиях различного генеза [8].
Метгемоглобин и карбоксигемоглобин при COVID-19. После вспышки новой коронавирусной инфекции, уделено место метгемоглобину (MetHb) и карбоксигемоглобину (COHb), поскольку у тяжелобольных пациентов часто наблюдаются повышенные концентрации данных соединений гемоглобина в крови. Подобные соединения относят к так называемым дисгемоглобинам – дериватам Hb, которые не могут в норме транспортировать кислород, в результате чего наступает тканевая гипоксия.
У пациентов после COVID-19 наблюдается пониженная концентрация Hb. В 2020 г. после проведенных исследований ученые выдвинули предположение, что инфекция взаимодействует в организме с железосодержащим белком и впоследствии разрушает его. Этот вывод был сделан на основе того, что в организмах пациентов с анемией был выявлен в большом количестве гем [8].
Синдром матового стекла, обнаруживаемый в легких на КТ – это скопление [8], атакованного вирусом и утратившего способность к переноске кислорода [8]. Ученые обнаружили, что у пациентов наблюдается низкий уровень ферритина – белка, который является «хранилищем» железа в организме. На фоне недостаточного количества ферритина развивается анемия.
Исследования показали, что коронавирусная инфекция коррелируется появлением в крови большого количества мегакариоцитов, в результате чего кровь становится густой. Эритроцитам труднее перемещаться по густой крови, в результате чего возникает гипоксия.
Ученые полагают, что причиной гибели пациентов может быть атака вируса на красный костный мозг, внутренний эндотелий и эритроциты [8].
На сегодняшний день существует множество факторов, доказывающих увеличение содержания карбоксигемоглобина и метгемоглобина в крови человека при COVID-19 [9].
Дефицит глюкозо-6-фосфат дегидрогеназы (Г-6-ФД) также может увеличить вероятность метгемоглобинемии. Недостаточность Г-6-ФД имеет серьезные патологические последствия в эритроцитах. Для лиц с дефицитом Г-6-ФД инфекция SARS-CoV-2 представляет собой дополнительный фактор риска [8]. Г-6-ФД катализирует реакцию образования восстановленного NADPH, который, в свою очередь, участвует в поддержании антиоксидантной системы защиты эритроцитов от свободных радикалов.
MetHb может образовываться как побочный продукт физиологической реакции в виде адаптивной повышенной передачи сигналов оксида азота (NO) вследствие острой анемии. Анемия может быть связана с инфекцией или системной воспалительной реакцией, называемой «анемией воспаления», как часть физиологической реакции на заболевание [9]. Согласно исследованию Bellmann-Weiler et al. [9] из 259 госпитализированных пациентов с COVID-19 24,7 % были анемичны при поступлении, причем большинство страдало воспалительной анемией (68,8 %). Во время госпитализации процент пациентов с анемией увеличился (около 68,8 % на 7-й день). Значительно более высокая смертность во время госпитализации была также обнаружена у пациентов с анемией при поступлении. Анемия связана с повышенной концентрацией NO, приводящей к вазодилатации. Она предотвращала тканевую гипоксию, но в то же время вызывала NO-основанное окисление Hb в MetHb. MetHb активирует путь NF-kB в эндотелиальных клетках, связанный с продукцией хемокинов (IL-8) и цитокинов (IL-6). Активация путей NF-kB и MAPK с последующим высвобождением хемокинов IL-8 и хемокинового моноцитарного хемоаттрактантного белка-1 (MCP-1) также наблюдалась в эндотелиальных клетках, подвергнутых воздействию MetHb [8]. Это подчеркивает, что повышение уровня MetHb в крови оказывает влияние на выработку цитокинов/хемокинов – факт, который может иметь особое значение для COVID-19, поскольку при тяжелом течении заболевания наблюдается «цитокиновый шторм». И следует иметь в виду, что гипоксия также вызывает выработку IL-8 и IL-6 [9].
Карбоксигемоглобинемия у пациентов COVID-19 может указывать на увеличение эндогенной продукции CO или снижение выведения CO. Эндогенная продукция СО обусловлена активацией гемоксигеназной ферментной системы, катализирующей распад гема и высвобождение СО в ходе реакции. Затем CO может реагировать с Hb, что приводит к образованию COHb. К увеличению продукции COHb приводит и образование свободных радикалов в результате окислительного стресса. Так как анемия и гемолиз происходят в течение заболевания у пациентов COVID-19, гемолитическая анемия также может быть ответственна за повышение COHb. Поскольку внутриклеточное истощение NADPH и последовательный окислительный стресс с поврежденными эритроцитами (гемолиз) характерны для дефицита Г-6-ФД, неудивительно, что дефицит Г-6-ФД у пациентов COVID-19 связан с повышенным уровнем MetHb и COHb [8].
При нарушении дыхания происходит снижение элиминации СО. Пациенты с COVID-19 характеризуются нарушением дыхания. Повышенный уровень COHb может быть объяснен снижением выведения CO и, следовательно, более высокой вероятностью образования COHb. Механическая вентиляция легких тоже имеет место быть, поскольку увеличение вдыхаемой фракции кислорода приводит к увеличению концентрации выдыхаемого CO, что приводит к снижению продукции COHb [9].
Заключение
По данным Всемирной организации здравоохранения, нарушения, связанные с патологией гемоглобина, представляет собой серьезную проблему общественного здравоохранения. Необходимо разрабатывать программы по скрининговым лабораторным дифференциально-диагностическим тестам, специальные биохимические, иммунологические и морфологические методы определения гемоглобина крови.