Фенотип пациента что такое
Фенотип пациента что такое
Исследование включает в себя определение наличия на исследуемых эритроцитах наиболее клинически значимых антигенов системы Rh (C, E, c, e) и Kell (K).
Анализ крови на фенотип, риск гемотрансфузионных осложнений, анализ крови на эритроцитарные антигены.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
На поверхности красных кровяных телец-эритроцитов находится более 250 антигенов, которые разделяются на 29 генетических систем. Каждая система кодируется собственным геном (или группой генов). Значение этих антигенов состоит в том, что они способны образовывать комплексы с антителами, с исходом в образование реакции агглютинации эритроцитов. Такие комплексы могут возникнуть при иммунном ответе во время переливании крови у реципиента с отсутствием какого-либо антигена, если у донора данный антиген присутствует. Наибольшее клиническое значение групп крови, основанных на наличии различных антигенов, находится в области трансфузиологии и акушерстве (так как могут возникать реакции антиген-антитело при разном антигенном статусе крови матери и плода).
Е и е антигены кодируются аллелями гена RHCE и являются кодоминантными. Во всех популяциях е встречается чаще, чем Е (примерно 30% белого населения имеют Е и 98% имеют е-антигены). Е имеет более сильные иммуногенные свойства, чем е. В редких случаях может быть наследование инактивированных или частично неактивных генов RHCE, которые не кодируют Е- и е-антигены и/или не кодируют С- и с-антигены.
Система Kell также является одной из наиболее важных групп крови в транфузиологии и в акушерской практике. Антитела Kell считаются значительно иммуногенными. Система группы крови Kell содержит 35 антигенов, из которых K/k (KEL1/KEL2), Kp a /Kp b (KEL3/KEL4), Js a /Js b (KEL5/KEL6) являются наиболее важными.
Исследование системы Rh (С, Е, с, е) и Kell успешно проводится методами реакции с моноклональными антителами и гель-фильтрацией. В первом методе используются специальные моноклональные смеси, предназначенные только для прямого тестирования и не используются в антиглобулиновом тесте. Rh-типирование также выполняется с использованием гель-фильтрации. Антисыворотка распределяется равномерно по всем частицам гелем. Антиген-положительные эритроциты реагируют с антисывороткой, при этом агглютинины связываются и не могут высвободиться из геля при центрифугировании.
Когда назначается исследование?
Что означают результаты?
Референсные значения: «отрицательно» для всех компонентов исследования.
Система Rh имеет пять разновидностей антигенов: C, D, E, c, e. Наиболее иммуногенным является антиген D. Иммуногенность других антигенов системы «резус» существенно ниже и убывает в следующем ряду: с > Е > С > е. Фактор Kell (K) стоит на втором месте после фактора D в шкале трансфузионно опасных антигенов эритроцитов.
Наличие или отсутствие определенных белков на мембране эритроцитов (фенотип антигенов) преимущественно определяется наследованием от родителей и не меняется в течение жизни. Люди, у которых отсутствует какой-либо конкретный антиген, могут развивать иммунный ответ с образованием антител при попадании в организм эритроцитов, несущих этот антиген. Такая ситуация возможна при переливаниях донорской крови или при прохождении эритроцитов плода в кровь матери во время беременности. Клиническими следствиями появления таких «аллоантител» являются гемолитические реакции при переливании крови, которая содержит эритроциты, несущие соответствующий антиген, и гемолитическая болезнь новорождённых вследствие прохождения через плаценту материнских IgG-антител, направленных против эритроцитарных антигенов плода. В результате воздействия аллоантител, направленных против эритроцитарных антигенов, эритроциты разрушаются (происходит гемолиз эритроцитов). Риск появления аллоиммунных антител повышен при сенсибилизации предыдущими переливаниями крови, выкидышами с трансплацентарным кровотечением, предыдущими беременностями с иммунологическим конфликтом при отсутствии соответствующей терапии.
Кто назначает исследование?
Трансфузиолог, акушер-гинеколог, хирург, онколог, уролог.
40 Группа крови и резус-фактор
13 Аллоиммунные антиэритроцитарные антитела (в том числе антирезусные), титр
Современные подходы к изучению плодового фенотипа в эру генетического ультразвука
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Настоящая работа посвящена изучению плодового фенотипа при ультразвуковом исследовании в различные сроки беременности при помощи новейших технологий Samsung, оптимизирующих диагностику многих врожденных пороков развития, аномалий, нарушений строения, особенностей развития с оценкой значимости отдельных ультразвуковых патологических маркеров в качестве потенциальных признаков генетических синдромов и ассоциаций.
Одной из ведущих причин детской и младенческой смертности являются врожденные пороки развития (ВПР), среди которых в 20% случаев встречаются множественные ВПР (МВПР) с установленной частотой 1:250 новорожденных [1]. Особое значение в профилактике МВПР имеет пренатальная диагностика – современный и высокоэффективный метод диспансеризации плода, направленный на своевременное выявление патологии, впоследствии определяющий выбор адекватной акушерской тактики при данной беременности и специфических мер профилактики болезни в данной семье в дальнейшем [2]. Современные ее возможности позволяют из комплекса патологических нарушений у плода выделить достоверно значимые ультразвуковые маркеры для постановки диагноза генетических синдромов различной этиологии. Сегодня пренатальная синдромология активно развивается, как в плане расширения спектра возможных лабораторных исследований, так и описания значимых, ключевых, таргетных ультразвуковых признаков многих наследственных синдромов различного происхождения.
Группа МВПР включает сотни нозологических форм, различных по этиологии, фенотипическим проявлениям и прогнозу. В силу огромной гетерогенности МВПР представляют собой сложную проблему для постановки окончательного диагноза. Основными этиологическими факторами, приводящими к возникновению синдромов с множественными пороками развития, являются генные, хромосомные мутации и действие на плод неблагоприятных факторов внешней среды [3, 4].
Любые наследственные или врожденные генетические болезни являются результатом повреждения генетической информации на геномном, хромосомном или генном уровне. В 60% всех случаев МВПР встречаются хромосомные синдромы, достаточно широко изученные и хорошо диагностируемые. Для лабораторной диагностики этих повреждений разработаны разнообразные и хорошо известные методы: цитогенетический, молекулярно-цитогенетический и молекулярно-генетический. МВПР нехромосомного генеза встречаются в 40% случаев. Среди них выделяют синдромы, ассоциации и неклассифицированные комплексы. Применительно к нехромосомным синдромам цитогенетическое исследование позволяет лишь отвергнуть хромосомную природу данного комплекса пороков развития, но не установить диагноз.
Синдромы с известным типом наследования представлены моногенными синдромами, в структуре которых наиболее часто встречаются аутосомно-доминантные (АД) и аутосомно-рецессивные (АР) нозологии, и спорадическими синдромами с различными известными ассоциациями (устойчивыми сочетаниями ВПР с этиологической общностью). Неклас си фицированные комплексы МВПР в международном классификаторе наследственных синдромов и ассоциаций (OMIM- www. omim.org) не зарегистрированы, судить о типе их наследования не представляется возможным в связи с отсутствием опубликованных данных о причинах их возникновения. Большая часть неклассифицированных комплексов представляет собой случайное сочетание 2–3 ВПР, однако некоторые из них могут быть не случайны, а пред ставлять собой новые, не описанные и не выделенные в самостоятельные нозологические формы синдромы [5].
Сегодня имеется определенное количество публикаций о выявлении некоторых синдромов и ассоциаций при пренатальной эхографии [6, 7]. Однако дородовая идентификация нозологических форм нехромосомных синдромов пока не вошла в рутинную практику врачей в области пренатальной диагностики и носит случайный характер. В литературе отсутствуют четкие рекомендации о системном подходе к диагностике наследственных синдромов различной этиологии, нет диагностических алгоритмов и определенных схем взаимодействия врачей ультразвуковой пренатальной диагностики, генетиков, акушеров-гинекологов.
Использование эхографии делает возможным пренатальное выявление не менее 80% врожденных дефектов во II, III триместрах беременности и свыше 50% значимых нарушений анатомии плода уже в I триместре начиная со сроков 11–12 нед. Весь комплекс диагностированных пороков развития и различных микроаномалий в совокупности составляет фенотипический спектр синдрома, который состоит из «ядерных» (главных, ключевых) признаков и дополнительных аномалий, наличие которых не является обязательным для диагностики клинической нозологии синдрома.
Революцией в пренатальной ультразвуковой диагностике явилось появление объемной эхографии, которая, обладая такими качествами, как неинвазивность, безопасность и возможность многократного применения у одной пациентки, имеет высокую информативность в исследовании анатомии плода и изучении его фенотипа. При применении различных режимов объемной эхографии абсолютно очевидно их преимущество по сравнению с обычным сканированием. Детально можно изучить лицо плода (рис. 1–4) в различные сроки беременности, начиная со сроков первого пренатального скрининга в 11–14 нед, конечности плода, причем не только их наличие и положение (рис. 5, 6), но и состояние и количество пальцев (рис. 7–9) как на руках, так и на ногах. Также можно изучить позвонки плода (рис. 10), состояние твердого нёба (рис. 11, 12), строение наружного уха (ушной раковины) (рис. 13), состояние основных швов черепа и родничков, исключая их преждевременное закрытие при кранисиностозах (рис. 14, 15).
Рис. 1. Нормальное лицо плода, 12 нед беременности.
Фенотип антигенов эритроцитов и индекс сенсибилизации у доноров компонентов крови и пациентов г. Астаны
Ж.К. Буркитбаев, Р.Б. Меирбекова, Е.Н. Курганская, Л.Л. Карп, Р.З. Магзумова
Научно-производственный центр трансфузиологии, г. Астана, Казахстан
Трансфузиология №2, 2013
Резюме
В результате проведенного исследования установлено большое разнообразие фенотипов в системе Резус, а также достаточно высокая степень сенсибилизации у реципиентов и высокий индекс сенсибилизации населения города Астаны.
Ключевые слова: антигенный состав эритроцитов.
Введение
Исследование распространенности у доноров основных клинически значимых антигенов эритроцитов, определение индекса аллоиммунизации является непременным условием адекватной профилактики посттрансфузионных реакций и осложнений гемолитического типа. Определение группы крови, резус-принадлежности и типирование антигенов эритроцитов имеет большое значение при проведении гемотрансфузий для подбора совместимых пар донор-реципиент и профилактики наиболее опасных для жизни реципиентов посттрансфузионных осложнений гемолитического типа [1–16]. Методика агглютинации в геле была разработана с целью стандартизации реакций гемагглютинации и получения достоверных результатов. Тестирование на индивидуальную совместимость крови донора и реципиента по антигенам эритроцитов не заменяет обязательное иммуногематологическое исследование, а лишь дополняет его. Использование гелевой системы позволяет также снизить риск заражения персонала даже при работе с потенциально инфицированными образцами [2]. Благодаря высокой чувствительности, стандартности и хорошей воспроизводимости результатов, методы агглютинации в геле получили широкое распространение [3].
Цель и задачи исследования
Целью работы явилось изучение частоты встречаемости антигенов эритроцитов и определение уровня сенсибилизации населения г. Астаны.
Материал и методы исследования
Материалом исследования служили 119882 образцов крови доноров и 6313 реципиентов за период 2010–2012 гг. Возраст доноров колебался от 18 до 60 лет. Средний возраст доноров составил 43,4±5,1 года. Возраст больных колебался от 0 до 77 лет. Средний возраст больных составил 37,9±9,5 года. Среди доноров было 64736 мужчин (54,0%) и 55146 – женщин (46,0%). Среди реципиентов мужчины составили 66,9%, женщины – 33,1%. Контингент обследованных пациентов: реципиенты, в анамнезе которых многократные трансфузии; беременные, входившие в группу риска по аллоиммунизации; дети с гемолитической болезнью новорожденных. Все образцы крови доноров исследовались на групповую принадлежность по системе АВО перекрестным методом с использованием моноклональных антител, стандартных эритроцитов, а также методом микроколоночной агглютинации с использованием кассет ORTHO BioVue. Образцы крови реципиентов исследовались на групповую принадлежность по системе АВО с применением гелевой методики Scangel. А нтиген D с истемы Р езус выявляли с помощью Цоликлона АнтиD Супер (ООО «Гематолог», Москва) и с применением метода микроколоночной агглютинации с использованием кассет ORTHO BioVue, дополнительно все RH(D)-отрицательные доноры (3464 из 119 тысяч) исследовались на наличие вариантных и слабых форм антигена D с помощью моноклональных антител анти-RH1(D)/ RhW1 в реакции Кумбса с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), «BioRad Laboratories», США). Все образцы крови доноров тестировались на наличие антигена К системы Кell с использованием моноклональных антител анти-К Супер (ООО «Гематолог», Москва) и с помощью метода микроколоночной агглютинации с использованием ORTHO BioVue анти-К. Все RH(D)-отрицательные доноры, а также «кадровые» RH(D)-положительные доноры были фенотипированы по антигенам С, с, Е, е системы Резус с использованием метода микроколоночной агглютинации с использованием кассет RH/K ORTHO BioVue, все реципиенты были фенотипированы по антигенам С, с, Е, е системы Резус с помощью гелевого метода с использованием карт Scangel Моноклональные RH/Kell производст- ва «Bio-Rad Laboratories», США. Во всех образцах крови доноров и реципиентов был проведен скрининг антиэритроцитарных аллоантител с помощью реакции Кумбса, выполненной с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), с эритроцитами Scangel I-II-III производства фирмы «Bio-Rad Laboratories», США-Франция). При положительных результатах скрининга проводилась идентификация анти- тел с эритроцитами ScanPanel из 10 линий клеток, «Bio-Rad laboratories», США.
Результаты и обсуждения
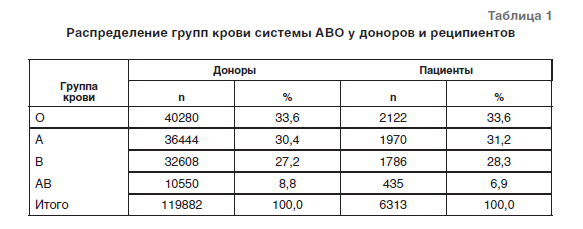
Нами было проанализировано распределение групп крови системы АВО у доноров и реципиентов (таблица 1).
Полученные данные свидетельствуют о том, что распределение групп крови по системе АВО у доноров и пациентов сходны. Преобладающими являются O и А группы крови. Выявленная нами частота встречаемости антигена А2 в группе крови А и АВ составляет для доноров 0,32%, а для пациентов 3,2%. Выявленное нами соотношение Rh(D)-положительных и Rh(D)-отрицательных лиц среди пациентов составило 94,39 и 5,6% соответственно. Для доноров это соотношение составило 92,43% Rh(D)-положительных и 7,57% Rh(D)-отрицательных (табл. 2).
Полученные нами данные выявили значительно больший процент антигена D вариантного у пациентов. Возможно, это является результатом ослабления антигена D при заболеваниях. Изучение антигенного состава эритроцитов кадровых доноров и пациентов показало, что наиболее распространенным фенотипом среди Rh(D)-положительных лиц является фенотип CCDee-, далее следуют фенотипы CcDee-, CcDEe- и ccDEe- (табл. 3).
Наибольшую опасность представляют в трансфузионном отношении гомозиготные сочетания антигенов системы Резус (СС, сc, ЕЕ и ее), которые встречаются у 86% резус-положительных (D+). Всем донорам и реципиентам независимо от групповой и резус- принадлежности предварительно проводился скрининг на наличие антиэритроцитарных антител. При оценке антиэритроцитарных антител у 13,3% пациентов обнаружены иммунные антитела различной специфичности. В связи с тем, что среди контингента обследованных в лаборатории лиц превалировали беременные, входившие в группу риска по аллоиммунизации, а также больные получившие многократные трансфузии, – индекс сенсибилизации у пациентов оказался высоким. Антитела к антигенам эритроцито системы Резус появляются в организме в результате трансфузий эритроцитов доноров, содержащих антигены, отсутствующие у реципиента, а также при иммунизации матери эритроцитами плода. Частота встречаемости аллоантител к антигенам эритроцитов системы Резус различна и определяется иммуногенностью антигена и частотой встречаемости в популяции. В 31% случаев антитела не идентифицировали, что связано с сочетанной специфичностью антител или наличием антител к широко распространенным в популяции антигенам. При изучении частоты аллосенсибилизации среди RH(D)-положительных и RH(D)-отрицательных лиц, было обнаружено, что RH(D)-отрицательные люди иммунизируются в 2–2,5 раза чаще, чем RH(D)-положительные. Антитела к минорным антигенам эритроцитов чаще встречаются у резус-положительных лиц, чем у резус-отрицательных. У доноров встречаемость аллоантител составила 0,46% (табл. 4).
Проблема гемолитической болезни новорожденных (ГБН) для города Астана актуальна. Наиболее часто ГБН развивается вследствие конфликта по антигенам системы Резус и АВ0 (табл. 5).
Фенотипы ринита: дифференциальный диагноз
В отчете PRACTALL «Фенотипы и эндотипы ринита: диагностика и лечение» изложены подходы к диагностике и лечению ринита с учетом фенотипа/эндотипа. Концепция лечения основана на контроле клинической симптоматики. Классификация на основе фенотипа/эндотипа призвана обеспечить переход к персонализованной медицине в сфере ринита. В статье рассмотрены основные позиции, изложенные в данном документе.
В отчете PRACTALL «Фенотипы и эндотипы ринита: диагностика и лечение» изложены подходы к диагностике и лечению ринита с учетом фенотипа/эндотипа. Концепция лечения основана на контроле клинической симптоматики. Классификация на основе фенотипа/эндотипа призвана обеспечить переход к персонализованной медицине в сфере ринита. В статье рассмотрены основные позиции, изложенные в данном документе.
Ринит – острое или хроническое заболевание слизистой оболочки носа. Это собирательный термин, включающий совокупность симптомов, таких как гиперемия слизистой оболочки носа, затрудненность носового дыхания, насморк (ринорея), чихание, зуд в полости носа, нарушение обоняния, вызванные воспалением, и/или нарушение нормальных функций слизистой оболочки носа.
Ринит характеризуется высокими показателями заболеваемости, что приводит к значительным экономическим затратам во всем мире [1]. Нельзя недооценивать общее влияние ринита на качество жизни пациентов. Речь прежде всего идет о расстройстве сна, снижении работоспособности и успеваемости в школе, психологических нарушениях [2, 3].
Несмотря на высокую распространенность данной патологии и длительность ее изучения, единого определения и классификации видов ринита не существует. Нет и четких объективных критериев, которые позволили бы определить форму заболевания и выбрать обоснованный метод лечения.
Ринит может быть различной этиологии. Чаще это инфекционный процесс или аллергические реакции немедленного типа. Известны и другие триггерные факторы, провоцирующие развитие ринита, например раздражающие вещества, ряд лекарственных средств, гормональный дисбаланс, нейровегетативная дисфункция. В настоящее время актуальна проблема дифференциальной диагностики хронического ринита [4].
Последние десять лет благодаря концепции фенотипирования, основанной на определении подтипа заболевания по его клиническим проявлениям, а также концепции эндотипов, то есть определению подтипа заболевания исходя из патофизиологических механизмов, удалось глубже изучить такие заболевания, как бронхиальная астма и хроническая обструктивная болезнь легких. Сегодня назрела острая необходимость упорядочивания имеющихся знаний о разнообразии подтипов ринита.
Опубликованный в 2015 г. отчет PRACTALL «Фенотипы и эндотипы ринита: диагностика и лечение» – результат консенсуса, достигнутого экспертами Европейской академии аллергологии и клинической иммунологии и Американской академии аллергологии, астмы и иммунологии [5]. В отчете PRACTALL описаны фенотипы и эндотипы ринита, представлены подходы к его диагностике и лечению с учетом фенотипа/эндотипа. Концепция лечения основана на контроле клинической картины и охватывает все подтипы ринита. Предложенная классификация на основе фенотипа/эндотипа способствует переходу к стратифицированной и персонализованной медицине в сфере ринита. Документ предназначен для практикующих врачей. Рассмотрим основные позиции, изложенные в нем.
Ринит традиционно подразделяют на три основных клинических фенотипа: аллергический, инфекционный и неаллергический/неинфекционный. У ряда пациентов возможно комбинированное (смешанное) течение. Фенотипы/эндотипы не имеют четких границ, динамичны, способны переходить из одного в другой, что затрудняет четкую систематизацию.
Не исключено, что классификация на основе эндотипов в какой-то мере позволит объяснить вариабельность как клинических проявлений, так и ответа на проводимое лечение. Но до тех пор пока мы не научимся идентифицировать все эндотипы, приводящие к развитию того или иного фенотипа, эту проблему решить не удастся.
Классифицируя ринит на основе фенотипов, можно использовать различные клинические критерии, в частности возраст на момент начала заболевания, тяжесть, внешние проявления заболевания, провоцирующие факторы. Разрабатываются также кластерные подходы. Однако в отличие от концепции фенотипирования бронхиальной астмы концепция в отношении ринита подлежит доработке [6, 7]. Необходимость проведения и оптимизации именно кластерного анализа обусловлена возрастающим разнообразием выявляемых симптомов ринита. Кроме того, каждая группа пациентов, вероятно, по-разному реагирует на предложенные варианты лечения. В этом смысле перспективные виды лечения не станут исключением.
Дополнительно учитывается коморбидная патология (респираторная аллергия, риноконъюнктивит) или сочетание аллергического ринита и астмы у одного и того же пациента. Фенотипы могут быть идентичны некоторым эндотипам, когда их определение основано на патоморфологических (неаллергический ринит с синдромом эозинофилии (НАРСЭ)) или патофизиологических (аллергический ринит) симптомах. Возможно также выявление соответствующих биомаркеров.
Рассмотрим сравнительно четко определяемые фенотипы, а также их возможное сочетание с тем или иным эндотипом.
Острый инфекционный ринит (ИР) при острой респираторной вирусной инфекции (ОРВИ) проявляется заложенностью носа, ринореей, чиханием. Назальные симптомы преобладают на второй-третий день и уменьшаются к пятому дню заболевания. Иногда к ИР присоединяется вторичная бактериальная инфекция [16]. Некоторые заболевания, включая попадание инородного тела в носовые ходы или прободение перегородки носа, перелом носа, предрасполагают к длительному течению инфекционного ринита. В подобных случаях этиология нередко бактериальная. При наличии устойчивых клинических проявлений свыше двух недель можно предположить наличие аллергического ринита (АР).
В клинической практике затруднение вызывает диагностика персистирующих форм АР, обост-
рение которых нередко спровоцировано ОРВИ. Увеличение количества нейтрофилов в анализах крови и отделяемого из носовой полости свидетельствует о присоединении вторичной инфекции.
Высокая частота ОРВИ в детском возрасте, стереотип мышления врача о преимущественно инфекционной природе ринита, невнимательное отношение к признакам атопии затрудняют диагностику АР. Анализ так называемых острых респираторных заболеваний в летний период показал, что они, как правило, протекают с нормальной или субфебрильной температурой тела и нередко типичными риноконъюнктивальными симптомами: слезотечением, светобоязнью, гиперемией склер и век, зудом, ощущением инородного тела в глазах, отеком век, ринореей, затрудненным носовым дыханием, умеренной интоксикацией. При дальнейшем обследовании выявляют сенсибилизацию к пыльце деревьев, трав. Вместе с тем АР требует дифференциации с хроническим инфекционным ринитом, при котором также имеет место затруднение носового дыхания, однако наблюдается слизисто-гнойное с зеленоватым оттенком отделяемое из носа.
Другой формой ИР является грибковый риносинусит. Это заболевание включает различные подтипы, в том числе инвазивные (острый инвазивный, гранулематозный инвазивный и хронический инвазивный) и неинвазивные (сапрофитная грибковая инвазия, грибковый ринит с шаровидной аспергилломой и эозинофильный грибковый риносинусит, разновидностью которого является аллергический грибковый риносинусит) [17].
Аллергический грибковый риносинусит первоначально развивается в молодом возрасте у пациентов с атопией. Причем одновременно с возникновением данного заболевания возрастает риск назальных полипов. При обследовании выявляют положительные кожные тесты на грибковые аллергены и повышение уровня общего иммуноглобулина (Ig) класса E и аллергенспецифических IgE-антител в сыворотке. В слизистой оболочке пазух носа обнаруживают характерное эозинофильное воспаление с заполнением синусов слизистым секретом (вязким, эозинофильным, с грибковыми частичками и кристаллами Шарко – Лейдена). Аллергический грибковый риносинусит более чем в 50% случаев протекает как одностороннее поражение пазух носа. Нередко у больных с подобной патологией развивается бронхиальная астма.
Под хроническим риносинуситом (ХРС) понимают воспаление слизистой оболочки носа и околоносовых пазух на протяжении более чем 12 недель. В зависимости от локализации воспаления его называют гайморитом (воспаление верхнечелюстной пазухи), этмоидитом (воспаление решетчатого лабиринта), фронтитом (воспаление лобной пазухи) или сфеноидитом (воспаление пазух клиновидной кости). Фенотип ХРС подразделяют на ХРС без полипов (CRSsNP) и ХРС с полипами в носу (CRSwNP) [18]. В основе некоторых форм ХРС может лежать ответ на хроническую бактериальную инфекцию суперантигеном (главным образом Staphylococcus aureus), что определяет особый эндотип заболевания [11]. Потенциальная роль биологических пленок S. aureus в патогенезе ХРС в настоящее время изучается [19].
В целях диагностики бактериального синусита прежде всего следует оценивать клинические проявления заболевания: при бактериальном процессе отсутствуют симптомы раздражения – зуд и чихание. Основная симптоматика связана со слизисто-гнойными выделениями (возможны односторонние поражения, что исключено при аллергическом воспалении), болевыми ощущениями в проекции пораженной пазухи, повышением температуры и т.д. Следует оценивать и сроки течения процесса: бактериальное воспаление (острое или рецидивирующее) не может длиться недели и месяцы.
У ряда больных возникает необходимость дифференцировать АР от полипозного риносинусита в связи с жалобами на наличие выраженной обструкции носа. Отличить АР от полипоза носа помогают данные анамнеза, аллергодиагностики и выявление характерных для полипоза изменений при эндоскопическом исследовании. Не стоит забывать, что у части пациентов с АР развивается хронический полипозный риносинусит, что демонстрирует динамическое перекрытие фенотипов.
Неинфекционный неаллергический ринит
Неинфекционный неаллергический ринит (ННАР) – гетерогенная группа назальных патологических состояний с симптомами ринита. ННАР подразделяется на следующие субфенотипы:
По данным разных исследователей, в целом примерно половина взрослых пациентов с ринитом (20–70%) рассматриваются как больные ННАР [20–22]. Диагностика проводится на основании анамнеза заболевания с исключением эндоназальной инфекции и признаков аллергенной сенсибилизации.
Неаллергический ринит с синдромом эозинофилии
Неаллергический ринит с синдромом эозинофилии характеризуется наличием выраженной назальной эозинофилии, отсутствием положительного аллергологического анамнеза, отрицательными результатами кожного тестирования. В клинической картине отмечают персистирующие симптомы ринита, слабо выраженное чихание и зуд, склонность к образованию назальных полипов, отсутствие адекватного ответа на терапию антигистаминными препаратами (АГП), хороший эффект при использовании ИнГКС. Повышенное содержание эозинофилов в анализе крови и назальном секрете позволяет выделить среди больных неаллергическим ринитом тех, у кого заболевание обусловлено нарушениями метаболизма арахидоновой кислоты. У таких пациентов ринит часто служит предвестником развития аспириновой триады – тяжелого полипозного риносинусита, бронхиальной астмы и непереносимости аспирина.
Локальный аллергический ринит
Локальный (местный) аллергический ринит (ЛАР) – особый эндотип ринита, характеризующийся клинической симптоматикой, аналогичной таковой АР. Между тем аллергенспецифические IgE удается выявить лишь локально, в носовой полости, в отсутствие системного аллергического ответа. В ряде исследований выдвигалось предположение, что ЛАР – ранний этап АР [23]. Однако результаты недавнего клинического исследования с пятилетним сроком наблюдения за пациентами показали, что ЛАР не переходит в АР [24]. Иммунологическими характеристиками ЛАР являются наличие местного Th2-воспалительного ответа в результате выработки в полости носа специфических IgE [23] и скопление в ней эозинофилов, базофилов, тучных клеток и CD3+/CD4+ Т-клеток [24–26]. Активация тучных клеток, эозинофилов, синтез специфического IgE потенцируются локально, что подтверждается немедленной реакцией на назальный провокационный тест и сопровождается увеличением продукции триптазы, эозинофильного катионного протеина и антител к специфическому IgE в назальном секрете [24].
Установлена корреляция нарастания уровня триптазы с появлением и выраженностью назальных симптомов (зуд, чихание). Больные ЛАР отмечают те же симптомы ринита, что и пациенты с обычным классическим АР: ринорею, чихание, зуд в носу и заложенность носа. Эти симптомы, развивающиеся, как правило, во взрослом возрасте, могут носить круглогодичный или сезонный характер. Следовательно, по отношению к ЛАР применима классификация, используемая при обычном АР. В зависимости от вида аллергена ЛАР может быть круглогодичным и сезонным, а в зависимости от длительности симптомов – интермиттирующим и персистирующим [5].
Большинство пациентов с ЛАР отмечают среднетяжелые симптомы, сопровождающиеся в 25–57% случаев проявлениями конъюнктивита [23]. Необходимы дальнейшие исследования для оценки механизмов, лежащих в основе этого заболевания, и изучение его распространенности в разных странах. Назальный провокационный тест с аллергеном и определение специфических IgE в полости носа составляют основу диагностики ЛАР [27].
Исследование жидкости назального лаважа представляет собой неинвазивную методику, позволяющую оценить клеточный состав, маркеры воспаления и ряд иммунологических показателей. Определение специфических IgE в жидкости назального лаважа, особенно после естественной или искусственной провокации аллергеном, служит полезным инструментом диагностики локальной сенсибилизации. Этот диагностический тест in vitro характеризуется высокой специфичностью и низкой чувствительностью (22–40%), что обусловлено прежде всего эффектом разведения [28]. Назальный провокационный тест с аллергеном более чувствителен по сравнению с определением специфических IgE, триптазы и эозинофильного катионного белка в назальной слизистой оболочке [26–28].
Таким образом, положительный провокационный назальный тест с аллергеном у пациентов, имеющих соответствующие данные анамнеза и клинические проявления, позволяет диагностировать ЛАР. При ЛАР эффективны ИнГКС и пероральные АГП. В ходе недавнего исследования с применением специфической иммунотерапии были получены обнадеживающие результаты [5, 29].
Эта форма ринита развивается вследствие воздействия на рабочем месте переносимых по воздуху агентов. В зависимости от природы последних профессиональный ринит классифицируют [5]:
1) на неаллергический:
2) аллергический, вызываемый агентами с высоким молекулярным весом.
Профессиональный аллергический ринит опосредован выработкой IgE. Для него характерно эозинофильное воспаление слизистой. В то же время ринит, вызываемый низкомолекулярными агентами, включает эндотип с IgE-опосредованной и неIgE-опосредованной адаптивной иммунной реакцией.
Аллергический ринит – это хроническое заболевание, в основе которого лежит воспалительная IgE-опосредованная реакция, вызванная попаданием аллергенов на слизистую оболочку полости носа. АР проявляется четырьмя основными симптомами: выделениями из носа, затруднением носового дыхания, чиханием и жжением в полости носа. Данные симптомы носят обратимый характер: после прекращения экспозиции аллергенов или под воздействием лечения они исчезают.
В отличие от фенотипа и эндотипа любой другой формы ринита патофизиологические аспекты АР описаны и изучены лучше [30]. Субфенотипы АР по временному паттерну традиционно подразделяют на группы с сезонным и круглогодичным течением. Выделяют также сенсибилизацию к соответствующим сезонным или круглогодично присутствующим аллергенам, проявляющуюся соответствующей симптоматикой [5]. Классификация ARIA по длительности персистирования симптомов (интермиттирующие или персистирующие), а также по тяжести в зависимости от степени влияния на качество жизни (легкое или умеренное/тяжелое течение) стала попыткой классифицировать фенотипы АР [9]. Предложенные границы для определения персистирующего ринита (четыре дня в неделю и четыре недели подряд в году) были апробированы в широкой когорте больных [31]. Обе классификации фенотипов (сезонный или круглогодичный и интермиттирующий или персистирующий) имеют как преимущества, так и недостатки и могут быть полезны в клинической практике. Еще один временной фенотип «эпизодический ринит» обусловлен, видимо, спорадическим воздействием соответствующего аллергена, вызывающего определенную реакцию [5].
Факторы риска развития аллергического ринита
Факторы, снижающие риск развития аллергического ринита
Триггерные факторы аллергического ринита
К триггерным факторам причисляют:
Аллергический ринит не следует рассматривать как легкое безобидное заболевание. АР не только влияет на качество жизни больных, но и является предвестником и предрасполагающим фактором развития более тяжелых, нередко приводящих к инвалидизации заболеваний (табл. 1).
Диагностика и определение фенотипа ринита
В большинстве случаев диагностика ринита на основе клинической симптоматики сложностей не вызывает. Но определение конкретного фенотипа может вызвать затруднение.
Для диагностики фенотипа ринита следует опираться на данные анамнеза, объективного обследования и лабораторные исследования.
Присутствие в истории заболевания коморбидной атопической патологии и частая повторяемость приступов чихания и зуда свидетельствуют о диагнозе АР (табл. 2). ЛАР имеет ту же симптоматику и типичные временные паттерны, что и АР, и нередко сопровождается характерными сопутствующими заболеваниями. Данные анамнеза, укладывающиеся в картину ННАР, могут включать заложенность носа и ринорею без зуда и чихания, курение, гормональный дисбаланс, корреляцию с использованием лекарственных препаратов, отсутствие связи с воздействием аллергенов, отсутствие атопии в семейном анамнезе. Однако фенотипирование по данным одного только клинического анамнеза не рекомендовано, поскольку для фенотипов ринита характерна взаимная перекрестная симптоматика [5].
Выявляемая типичная картина аллергической слизистой оболочки носа наряду с наличием в анамнезе сообщений о реакции на воздействие аллергенов свидетельствует в пользу диагноза АР (табл. 2), хотя такие признаки и неспецифичны. Дополнительно рекомендуется выполнять переднюю риноскопию и/или эндоскопию, поскольку эти методы позволяют выявить патологию слизистой оболочки или отклонения в анатомическом строении носа (например, анатомическую патологию перегородки, гипертрофию аденоидов или носовой перегородки, носовые опухоли/травмы/инородные тела, полипы, гранулемы) и/или признаки, указывающие на явный фенотип/эндотип ринита (табл. 2) [32].
Исследования in vivo/in vitro
Верифицированный диагноз АР можно поставить только после специфического аллергологического обследования, которое служит дифференциально-диагностическим приемом в отношении неаллергического ринита. Для установления диагноза АР используются следующие методы обследования: аллергологический анамнез, кожные аллергологические диагностические пробы, при необходимости определение уровня специфических IgE-антител, аллергологические провокационные пробы со специфическими антигенами, анализ назального секрета и содержимого синусов, риноскопия, функциональные, лабораторные и рентгенологические исследования [33]. Назальный провокационный тест с предполагаемым причинно-значимым аллергеном может также идентифицировать пациентов с ЛАР [27, 34], хотя в настоящее время необходимы дальнейшие исследования для определения четких диагностических количественных критериев. При некоторых разновидностях профессионального ринита существенную диагностическую помощь может оказать провокация предполагаемым агентом [35]. Провокационные назальные тесты признаны золотым стандартом диагностики профессионального ринита и обычно выполняются в клинических условиях с имитацией воздействия окружающей среды дозозависимым способом. Вместе с тем эти тесты можно выполнять и на рабочем месте. В целом основным показанием к проведению провокационных назальных тестов с аллергенами является необходимость продемонстрировать этиологическую роль аллергена, идентифицировать клинически значимые аллергены у полисенсибилизированных пациентов, оценить эффекты проводимого лечения и роль профессиональных аллергенов. Однако из-за отсутствия общепринятых диагностических пороговых величин результаты часто трудно интерпретировать. Именно поэтому такие тесты выполняют главным образом в специализированных центрах врачи-аллергологи.
Чтобы исключить диагноз риносинусита, проводят рентгенологическое исследование придаточных пазух носа. Возможно выполнение назальной эндоскопии и компьютерной томографии.
Бактериологический анализ образцов из носовой полости и пазух носа в качестве рутинного метода при диагностическом обследовании на ринит и/или риносинусит не рекомендуется, поскольку клиническое значение обнаруживаемых при этом микроорганизмов обычно неизвестно. Оценка степени назальной обструкции выполняется с помощью ряда объективных методов (определение пиковой скорости инспирационного назального потока, риноманометрия, акустическая ринометрия и проч.). Все они имеют свои преимущества и недостатки.
Лечение ринита включает фармакологический и нефармакологический компонент и сводится к исключению триггерных факторов, обучению пациентов специфической иммунотерапии аллергенами и хирургическому вмешательству по показаниям. Лечение можно стратифицировать на основании конкретного для каждого пациента фенотипа.
Для оценки результатов лечения и упрощения мониторинга заболевания используется так называемый контроль ринита (табл. 3).
Несмотря на то что контроль ринита означает главным образом отсутствие симптоматики, в настоящее время единое точное определение этого понятия отсутствует, ведь выявление симптомов зависит от используемых методов (баллы по системе CARAT, RCAT, VAS для полной оценки назальных симптомов) [36–39]. Тем не менее использование понятия контроля представляется весьма перспективным для рутинного лечения ринита. В отличие от концепта тяжести понятие «контроль» может применяться к пациентам, уже получающим терапию [40].
Следует отметить, что необходимость увеличения потребности в использовании деконгестантов для купирования симптомов тоже свидетельствует об отсутствии контроля. Наконец, наличие сопутствующих заболеваний при рините способно нарушать контроль ринита, поскольку от 10 до 40% больных ринитом страдают одновременно астмой. У многих из них наблюдается синдром ночного апноэ. Тяжесть и контроль перечисленных заболеваний скорее всего связаны с тяжестью и контролем ринита.
Подход, предусматривающий оценку контроля, должен стать практическим руководством в клинических условиях для всех пациентов с ринитом независимо от фенотипа и эндотипа и дополнить валидизированные инструменты оценки контроля ринита.
Поэтапное лечение аллергического ринита, основанное на концепции контроля, представлено на рисунке. В принципе этот алгоритм можно использовать и при лечении других фенотипов ринита, но на данном этапе такой подход преждевременный, поскольку наше понимание механизмов и методов лечения ННАР и его субфенотипов и эндотипов пока весьма ограниченно.
Контроль факторов внешней среды и информирование пациентов
В зависимости от конкретного фенотипа ринита термин «элиминация» может означать меры по контролю внешних воздействий (при АР, ринитах, вызываемых раздражителями, и идиопатическом рините), воздержание от определенных видов пищи (при пищевом рините), отказ от ряда лекарственных препаратов (при лекарственном рините) и/или внесение изменений в образ жизни/организацию рабочего места (при профессиональном рините).
При большинстве фенотипов ринита следует исключить контакт с распространяемыми по воздуху раздражителями, такими как диоксид серы и диоксид азота, особенно взвешенные аэрозольные частицы, табачный дым, летучие органические соединения.
В случае идиопатического ринита следует исключить выявленные индивидуальные триггеры, провоцирующие его развитие.
При профессиональном рините могут быть целесообразны изменения на рабочем месте и использование защитной маски, что позволит избежать полной изоляции пациента от рабочей окружающей среды.
При АР эффективны рекомендуемые аллергологами разносторонние элиминационные мероприятия в жилом помещении, школе или на рабочем месте.
Лекарственные средства имеют различные показания и разную эффективность для лечения определенных фенотипов ринита.
Препараты для контроля заболевания
Интраназальные глюкокортикостероиды – краеугольный камень лечения АР. Как уже отмечалось, ИнГКС превосходно дополняют комбинацию перорального приема Н1-антигистаминных средств и антагонистов лейкотриенового рецептора [41, 42] либо каждого из этих препаратов в отдельности [42–44]. Современные ИнГКС безопасны при приеме в рекомендуемых дозах для взрослых и детей [45]. Они могут быть также эффективны в лечении НАРСЭ за счет лежащего в его основе эозинофильного воспаления (правда, это пока окончательно не доказано) и в лечении ХРС в отсутствие полипов [46], хотя данная группа безусловно показана при фенотипе ХРС с полипами [47].
Некоторые данные не позволяют сделать окончательных выводов, но свидетельствуют о том, что ИнГКС подходят для лечения лекарственного ринита, рефрактерного к отмене сосудосуживающего препарата, вызвавшего заболевание [48].
Продемонстрировали эффективность ИнГКС при ЛАР [29].
ИнГКС чаще применяются при АР. Обладая мощными противовоспалительными свойствами, они непосредственно воздействуют на патофизиологические процессы при АР, изменяя их.
В эксперименте при выполнении назального провокационного теста предварительное лечение ИнГКС способствовало значительному снижению медиаторов и цитокинов наряду со значительным торможением активации секреции базофилов, эозинофилов, нейтрофилов и мононуклеарных клеток в полости носа. ИнГКС также уменьшали специфическую назальную реактивность при последующих контактах с антигеном [37].
Кроме того, использование этой группы препаратов при сезонном АР приводит к уменьшению числа воспалительных клеток и цитокинов в слизистой оболочке полости носа и объема назального секрета пациентов с АР.
Плацебоконтролируемые клинические исследования демонстрируют эффективность ИнГКС как средства уменьшения назальной симптоматики, включая чихание, ощущение зуда в носу, ринорею и заложенность носа у детей и взрослых с АР. Снижая выраженность назальной симптоматики, ИнГКС значительно улучшают качество жизни и сон пациентов с АР. Вместе с тем ИнГКС рекомендуется принимать на постоянной основе. Это эффективнее эпизодического использования [5].
Если считать предшествующую применению ИнГКС терапию неэффективной, начало действия препаратов этого класса приходится на период от 3–5 до 36 часов после приема первой дозы.
Как показали результаты клинического исследования, клинический эффект, достигнутый после первого приема препарата, сохранялся на протяжении всего периода исследования. Основываясь на приведенных данных, можно предположить, что эффект от применения препарата будет достигнут через неделю терапии. Если в течение этого периода никакого действия не наблюдается, лечение следует расценивать как неэффективное [49].
Мометазона фуроат назальный спрей (Назонекс®) имеет самые широкие показания среди всех препаратов ИнГКС, зарегистрированных в нашей стране:
Результаты многочисленных контролируемых клинических исследований мометазона фуроата продемонстрировали его высокую эффективность и преимущество перед системными и топическими АГП в лечении АР. Назонекс® начинает действовать уже через 7–11 часов после приема первой дозы. Применение Назонекса один раз в сутки позволяет контролировать симптомы АР (уменьшает заложенность носа, снижает выраженность других сопровождающих АР симптомов, в том числе со стороны глаз) в течение 24 часов у пациентов в возрасте двух лет и старше. При длительном использовании Назонекса его эффективность не снижается. Препарат не вызывает сухость слизистой оболочки носа, поскольку содержит увлажнитель. При длительном применении Назонекс® способствует восстановлению гистологической структуры слизистой оболочки носа до нормы.
Мометазона фуроат (Назонекс®), беклометазон (Альдецин) и будесонид (Тафен назаль) – три топических ГКС, в инструкции которых предусмотрены показания к применению при хроническом полипозном риносинусите (ХПР). Использование ИнГКС при ХПР позволяет снизить клиническую симптоматику, включая ощущение заложенности носа и нарушение обоняния, уменьшить размеры полипов, улучшить исходы операции и вероятность рецидива после оперативного лечения. Однако профиль безопасности ИнГКС определяется его биодоступностью, которая зависит от попадания вещества в системный кровоток с поверхности слизистой оболочки носа, объема абсорбции препарата в желудочно-кишечном тракте и выраженности эффекта первого прохождения через печень, благодаря чему в системный кровоток поступают уже неактивные метаболиты.