Фасеточный синдром поясничного отдела позвоночника что это
Фасеточный синдром или синдром фасеточных суставов
Фасеточный синдром или синдром фасеточных суставов
Последнее редактирование: 21/02/2019, Доктор Мигель Б. Ройо Сальвадор, Номер в коллегии: 10389. Нейрохирурга и Невролога.
Определение
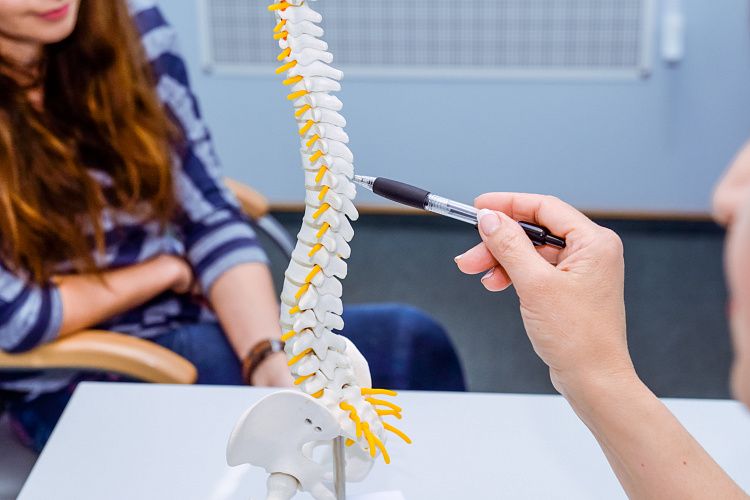
Позвоночник состоит из 33 позвонков: 7 позвонков шейного отдела, 12 позвонков грудного отдела, 5 позвонков поясничного отдела, 5 позвонков крестцового отдела и 4 или 5 позвонков копчика. Крестцовые и копчиковые позвонки формируют отдельные группы костей, соединенные суставом, в то время, как другие, за исключением двух первых позвонков шейного отдела, соединены между собой межпозвоночными дисками, дугоотростчатыми суставами и связками. Эти соединения позволяют человеку тянуться, наклоняться, делать повороты в стороны.
Спереди позвонки поддерживают друг друга своей основной массой или телом позвонка, между позвонками расположены межпозвоночные диски. Сзади позвонки с каждой стороны соединяются дугоотростчатыми суставами.
Дугоотростчатый сустав состоит из: фиброзной капсулы, синовиальной мембраны, гиалинового хряща и кости. Если межпозвоночный диск теряет в высоте, то трение и ограничение подвижности, которое происходит между костями, постепенно приводит к дегенерации окружающих тканей, что приводит к появлению болезненных ощущений, которые называют фасеточный синдром.
Симптомы
Когда дугоотростчатые суставы дегенерируются и сдавливаются, то фасеточный синдром может привести к появлению боли в шейном, грудном или поясничном отделе позвоночника. В зависимости от повреждения сустава, боль может быть двухсторонней или с одной стороны.
Как правило, боль чаще всего появляется в поясничном отделе позвоночника, так как на него приходится нагрузка вышележащего тела. Но боль может также отдавать в ягодицы, пах, по задней стороне бедра (люмбаго) или в нижние и даже в верхние конечности. Если фасеточный синдром происходит в шейном и грудном отделе, то боль иррадирует в верхние конечности и в грудной или брюшной отделы соответственно.
Другой возможный симптом – потеря чувствительности в руках и ногах. Воспаление суставов также может спровоцировать жесткость, трудности при выпрямлении и вставании из сидячего положения.
Боль может усиливаться при физических усилиях или поднятии тяжестей, при долгом нахождении в позиции стоя, при поворотах, наклонах или боковых растягиваниях. Боль может снижаться в положении лежа или при наклоне вперед.
Диагностика
Фасеточный синдром предполагают, когда есть боль в шейном отделе и руках, в грудном отделе или поясничном отделе даже при отдыхе, присутствуют другие характерные симптомы, а неврологические и дополнительные исследования отрицательные (когда на МРТ, КТ и ЭМГ нет никаких иных возможных причин для данных симптомов).
В этом случае проводится диагностическая инъекция. Когда пациент испытывает болезненные ощущения, в область рядом с нервом дугоотростчатого сустава, который предположительно является источником боли, при помощи аппарата рентгенографии вводят местную анестезию.
Если боль снижается после инъекции, то ставится диагноз фасеточного синдрома.
Причины
Фасеточный синдром поясничного отдела как правило происходит из-за дегенеративных изменений позвоночных суставов и суставных тканей, например, остеоартроза, дегенеративных изменений в хрящах, которые происходят со временем в дугоотростчатых суставах.
Также синдром может развиться из-за функциональных нарушений в суставах (например, снижение высоты межпозвоночных дисков с или без грыж), блокирование и ограничение подвижности. Или других патологий (грыжи или протрузии дисков, кисты и т.д.).
Факторы риска
Факторами риска для развития фасеточного синдрома в поясничном отделе позвоночника могут быть:
Осложнения
Болезненные симптомы при фасеточном синдроме в поясничном отделе могут стать хроническими, если их не лечить, снижая качество жизни пациента.
Лечение
Основные методы лечения при фасеточном синдроме:
– Консервативное лечение: может состоять из нескольких подходов, среди которых: релокализация суставов посредством манипуляций с позвоночником и ЛФК для развития гибкости и укрепления мускулатуры. В случае, если эти методы лечения оказываются неэффективными, переходят к следующему.
– В случае, если консервативное лечение не подействовало, иногда лечение может продолжится при помощи инфильтрации анестезии и кортизона в область поврежденного сустава.
– Окончательное избавление от болезненных симптомов при фасеточном синдроме происходит за счет повреждения нерва дугоотростчатого сустава, который останавливает передачу болевого импульса. Существуют несколько техник, например, радиочастотное устранение нервных окончаний.
– Согласно методу Filum System ® :
Для лечения фасеточного синдрома мы применяем электрокоагуляцию нервных окончаний, результаты данного лечения успешны.
Список литературы:
Свяжитесь с нами
Меня зовут Нина, я буду ассистентом в Вашей консультации.
Все консультации, полученные через этот формуляр или по электронной почте Барселонского Института Киари & Сирингомиелии & Сколиоза, передаются медицинскому отделу, и ответы проверяются доктором М. Б. Ройо Сальвадор.
Что такое синдром фасеточных суставов и как его лечить
Синдром фасеточных суставов — патологическое состояние, при котором фасеточные суставы провоцируют боли в спине. Синдром провоцирует деформирующий спондилоартроз, некоторые врачи считают эти состояния одним заболеванием. У 55% пациентов фасеточный синдром охватывает позвонки шейного отдела, у 30% — поясничного отдела. В запущенных случаях заболевание перерастает в спинной остеоартрит или спондилёз.
Синдром фасеточных суставов дает о себе знать рядом характерных симптомов:
Методы лечения
Медикаментозное лечение
Показано в периоды обострения, чтобы купировать острую боль и включает введение анестетиков или кортикостероидов. При сильных болях и мышечном спазме, которые не удается снять упомянутыми выше способами, проводят блокаду нервных окончаний фасеточных суставов и вводят ботокс, который снимает спазм.
Физиотерапия и мануальная терапия
Направлены на снятие боли и воспаления в нервах, восстановление подвижности поражённого участка спины.
Лечебная физкультура
Включает программу специально разработанных упражнений, которые помогают восстановить правильную осанку, укрепить мышцы и связки.
Ношение ортопедических конструкций
Шейный воротник и специальные ортопедические подушки эффективны при синдроме фасеточных суставов в шейном отделе позвоночника. С их помощью поражённую область можно иммобилизировать и снять с неё нагрузку.
Хирургическое вмешательство
Операция показана в тяжелых случаях, когда патологические изменения затронули не только фасеточные суставы, но и межпозвоночные диски.
Статью проверил
Дата публикации: 16 Марта 2021 года
Дата проверки: 16 Марта 2021 года
Дата обновления: 26 Декабря 2021 года
Содержание статьи
Лечение синдрома фасеточных суставов в клиниках ЦМРТ
Синдром фасеточных суставов диагностируют и лечат в медицинских центрах сети ЦМРТ. Мы оценим степень развития заболевания и общее состояние пациента и в зависимости от этого подберем соответствующее консервативное или оперативное лечение.
Чтобы записаться на приём к нашему специалисту, позвоните на ресепшн или заполните заявку на сайте.
Проблема хронической боли в спине: фасеточный синдром
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В современном обществе боли в спине приобрели характер «неинфекционной эпидемии» и встречаются у 84% взрослого населения индустриально развитых стран мира [1]. При этом основной проблемой в медицинском и социальном плане являются не острые, а хронические боли в спине, которые характеризуются упорным течением, нередким отсутствием значимого эффекта от проводимой терапии и высокими затратами, связанными с лечением. Актуальность проблемы обусловлена еще и тем обстоятельством, что как любой хронический болевой синдром, боли в спине способствуют формированию тревоги, депрессии, нарушений сна, а также избыточной стимуляции симпатоадреналовой системы, значимо повышающей риск кардиоваскулярных катастроф, и, таким образом, негативно влияют не только на качество жизни, но и на ее продолжительность [2, 3].
Согласно существующим в альгологии представлениям, для любой боли (в т. ч. и для боли в спине) «… наиболее приемлемым сроком для оценки ее как хронической считается продолжительность более 3 мес.» [Merskey H.M., Bogduk N., 1994]. Особенности течения хронических болей в спине были описаны одним из основоположников отечественной вертеброневрологии Я.Ю. Попелянским, который выделял эпизодический, хронически-рецидивирующий с редкими обострениями, хронически-рецидивирующий с частыми и/или более длительными обострениями, рецидивирующе-прогредиентный и перманентный типы течения болевого синдрома [4].
Несмотря на то, что в подавляющем большинстве случаев боли в спине имеют неспецифический (скелетно-мышечный) характер, любой случай хронизации болевого синдрома прежде всего требует исключения «специфических» причин его развития (онкопатология, спондилиты, спондилоартриты, переломы тел позвонков на фоне остеопороза, заболевания внутренних органов с отраженной болью). Отсутствие «красных флажков» (клинических и анамнестических признаков, позволяющих заподозрить «специфическую» патологию), а при необходимости – проведение рентгенологического или нейровизуализационного исследования (компьютерной и/или магнитно-резонансной томографии) в большинстве случаев позволяют клиницисту уже при первичном обследовании пациента исключить воспалительные и/или деструктивные изменения позвоночника в качестве причины болевого синдрома [5].
Возникновение неспецифических (скелетно-мышечных) болей в спине, как правило, связывается с дегенеративно-дистрофическими изменениями структур позвоночного столба и/или с неблагоприятными статодинамическими нагрузками на позвоночник. В качестве потенциальных источников неспецифических болей в спине могут выступать межпозвонковые диски, фасеточные суставы, крестцово-подвздошные сочленения, а также мышцы и фасции. Считается, что острые боли в спине у большинства пациентов регрессируют в течение 4–6 нед., однако в 15–20% случаев они приобретают хронический характер [6].
Среди отдельных структур позвоночно-двигательного сегмента наиболее частым источником хронических болей в спине, в особенности у пожилых пациентов, являются фасеточные суставы (фасеточный синдром). Данные о распространенности фасеточного синдрома при острых болях в спине широко варьируют из-за использования разными авторами различных критериев диагностики. При хронических болях в спине, согласно результатам исследований, проводившихся с использованием диагностических блокад, поражение фасеточных суставов является причиной болевого синдрома на поясничном уровне в 30–60% случаев, на шейном – в 49–60%, на грудном уровне – в 42–48% случаев [7].
Следует отметить, что помимо «морфологических» предпосылок к хронизации болевого синдрома (нарушения биомеханики позвоночника, регионарные нейродистрофические изменения мышц, связок, суставных капсул) хронизации болей в спине могут способствовать наследственная предрасположенность, присоединение нейропатического компонента боли, а также личностные особенности пациента, нарушения в психоэмоциональной сфере и использование неадекватных копинг-стратегий. В реальной клинической практике у пациента, как правило, имеет место целый комплекс причин, обусловливающих хроническое течение болевого синдрома [8].
Фасеточные суставы (синонимы – дугоотростчатые, межпозвонковые суставы, articulationes zygapophysiales) формируются при соединении нижнего и верхнего суставных отростков позвонков и имеют типичное строение: суставные отростки, покрытые слоем гиалинового хряща, синовиальная оболочка, синовиальная жидкость и капсула, укрепленная волокнами многораздельной мышцы. Ориентация суставных полостей в шейном отделе приближается к горизонтальной плоскости, в грудном – к фронтальной и в поясничном отделе – к сагиттальной плоскости. У 20–40% лиц в популяции имеют место так называемые аномалии тропизма (врожденная асимметрия ориентации суставных поверхностей на одном уровне), клиническое значение которых в настоящее время остается предметом дискуссий. Симметричные фасеточные суставы являются комбинированными сочленениями, в которых движение в одном суставе обязательно влечет за собой смещение в другом. В функциональном отношении они представляют собой группу малоподвижных суставов ввиду небольшого объема совершаемых движений, преимущественно в сагиттальной, в меньшей степени – во фронтальной и горизонтальной плоскостях [9]. Следует отметить, что фасеточные суставы (прежде всего суставные капсулы, связки, перикапсулярная ткань) имеют достаточно сложную и обширную ноцицептивную и проприоцептивную иннервацию. При этом каждый сустав иннервируется из 2–3 сегментов спинного мозга, что обеспечивает «перекрытие» зон распространения боли при поражении суставов соседних позвонков [10].
Болевой синдром, связанный с повреждением фасеточных суставов, может наблюдаться при ряде патологических состояний, таких как спондилоартриты (псориатический, болезнь Бехтерева), ревматоидный артрит, метаболические расстройства (подагра), а также подвывихи, микропереломы, разрывы капсулы и хряща суставов при травмах. Однако в подавляющем большинстве случаев причиной поражения фасеточных суставов являются дегенеративно-дистрофические процессы (спондилоартроз). Считается, что частота дегенеративных изменений фасеточных суставов в популяции варьирует от 40 до 85% и увеличивается с возрастом [11]. Описания болевого синдрома, связанного с поражением фасеточных суставов, появились еще в 30–х гг. прошлого века [12], а сам термин «фасеточный синдром», под которым понимается боль, исходящая из структур фасеточных суставов (капсулы, связки, перикапсулярные ткани, субхондральные пластины), был введен V. Mooney и J. Robertson в 1976 г. [13]. Многими авторами термины «фасеточный синдром» и «спондилоартроз» рассматриваются как синонимы.
Спондилоартроз, являющийся морфологической основой фасеточного синдрома, представляет собой частную форму остеоартроза и характеризуется поражением всех составляющих элементов фасеточных суставов – хряща, субхондральной кости, связок, капсулы и периартикулярных мышц. Спондилоартроз может развиваться изолированно, но значительно чаще он формируется на фоне дегенерации межпозвонковых дисков, приводящей к повышению нагрузки на фасеточные суставы и их хронической травматизации. Очевидно, что, как и поражение дисков, спондилоартроз чаще наблюдается у пожилых пациентов. Однако при определенных условиях он может развиваться и у лиц молодого возраста, чему способствуют наследственная предрасположенность, врожденные аномалии, травмы позвоночника, гипермобильность позвоночно-двигательных сегментов, избыточная масса тела. В отдельных случаях при травмах (по типу «хлыста», тракции, ротации) фасеточный синдром может развиваться остро.
Развитие спондилоартроза связано с нарушениями функциональной анатомии позвоночного столба, передние отделы которого (к ним относятся межпозвонковые диски) предназначены, главным образом, для сопротивления силам тяжести (компрессии), а задние отделы (в т. ч. фасеточные суставы) – для стабилизации позвоночника при ротации и смещении позвонков в переднезаднем направлении. В норме 70–88% осевой компрессионной нагрузки приходится на передние отделы и лишь 12–30% – на задние. При развитии дегенеративных изменений в дисках снижается их высота, нарушается амортизирующая функция, и доля осевой компрессионной нагрузки, приходящейся на фасеточные суставы, постепенно увеличивается, достигая 47–70%. Такая перегрузка суставов на фоне формирующейся нестабильности позвоночно-двигательного сегмента ведет вначале к воспалительным изменениям (синовиту), а затем – к дегенерации суставного хряща, деформации капсул суставов и подвывихам в них. Довольно часто этот патологический процесс носит асимметричный характер, что может быть связано с неравномерностью нагрузки на парные фасеточные суставы. Повторные микротравмы, компрессионные и ротаторные перегрузки ведут к прогрессированию дегенеративных изменений хряща вплоть до практически полной его утраты, развитию периартикулярного фиброза и формированию остеофитов, что приводит к увеличению размеров верхних и нижних фасеток, приобретающих грушевидную форму. Под влиянием импульсации из пораженного позвоночно-двигательного сегмента, в особенности из задней продольной связки, возникает рефлекторное напряжение межпоперечных, межостистых мышц и мышц-вращателей, что в случае асимметричного их вовлечения вызывает формирование сколиоза. Сочетание изменений в диске, фасеточных суставах и мышечно-тонических нарушений приводит к резкому ограничению движений в соответствующем позвоночно-двигательном сегменте.
Болевые ощущения, возникающие при фасеточном синдроме, являются примером ноцицептивной боли, связанной с явлениями синовита, прямым механическим раздражением ноцицепторов суставной капсулы на фоне явлений нестабильности и мышечно-тонических нарушений. Наиболее часто спондилоартроз развивается в поясничном отделе позвоночника, преимущественно в позвоночно-двигательных сегментах L4-L5 и L5-S1, испытывающих наибольшие перегрузки. Максимальный риск травматизации фасеточных суставов возникает при резких скручивающих движениях в пояснице. Дополнительным фактором, способствующим развитию спондилоартроза, является слабость брюшной стенки, сопровождающаяся увеличением выраженности поясничного лордоза и компрессионной нагрузки на фасеточные суставы. Значительно реже поражение фасеточных суставов наблюдается в шейном (преимущественно на уровнях С2-С3 и С5-С6) и грудном отделах позвоночника.
Для фасеточного синдрома характерно рецидивирующее течение, при котором трудно прогнозировать как частоту обострений, так и характер, интенсивность и продолжительность болевого синдрома. Но в целом, характерными являются постепенное развитие и медленный регресс каждого болевого эпизода и тенденция к удлинению и утяжелению каждого последующего обострения [14, 15].
Особенности клинической картины фасеточного синдрома на поясничном уровне были детально описаны T. Helbig и C. Lee в 1988 г. [16]. Боль, как правило, умеренной интенсивности, носит диффузный характер, плохо локализуется, нередко описывается пациентами как «глубокая», «ноющая», «давящая», «скручивающая», «сжимающая». Характерны феномен «утренней скованности» и максимальная выраженность болевых ощущений в утренние часы (признаки, отражающие воспалительный компонент боли), а также после нагрузки в конце дня (что обусловлено явлениями нестабильности и дисфиксации в области пораженного позвоночно-двигательного сегмента). Болевые ощущения локализуются паравертебрально, могут быть двусторонними или латерализованными. Боль, исходящая из фасеточных суставов нижнепоясничного уровня (L4-L5, L5-S1), может отражаться по склеротомам в ягодичную область, область копчика, тазобедренного сустава, паха, в бедро (по задней поверхности) и, как правило, не «спускается» ниже колена. Боль от суставов верхнепоясничного уровня (L1-L2, L2-L3, L3-L4) может распространяется в область груди, боковой поверхности живота. Боли при фасеточном синдроме на шейном уровне чаще имеют более локальный характер, могут отражаться в область надплечий и/или верхнюю часть спины и значительно реже – в плечо, предплечье, кисть (более характерно для дискогенных радикулопатий). Важно отметить, что от обострения к обострению паттерн боли (ее локализация, характер и интенсивность) может меняться.
Характерной особенностью фасеточного болевого синдрома на поясничном уровне является появление или усиление болевых ощущений при разгибании и ротации поясничного отдела позвоночника, возникающих при переходе из положения сидя в положение стоя, при длительном стоянии, «скручивании» в пояснице. При этом сгибание и наклон в поясничном отделе могут приводить к уменьшению болевых ощущений. Многие пациенты отмечают уменьшение боли на фоне «разгрузки» позвоночника – при принятии положения лежа либо при сгибании позвоночника с опорой на руки (стойка, перила).
Важно отметить, что в отличие от болевого синдрома при радикулопатии отраженная боль при фасеточном синдроме не достигает пальцев, плохо локализуется, не несет в себе паттерны нейропатического болевого синдрома (ощущения «электрического тока», жжения, парестезии и др.), усиливается при экстензии (а не флексии) позвоночника, не сопровождается появлением выраженных симптомов натяжения (Ласега, Мацкевича, Вассермана), а также симптомов выпадения в двигательной, чувствительной и рефлекторной сферах.
При неврологическом осмотре, как правило, выявляются сглаженность поясничного лордоза, сколиоз в грудном и поясничном отделах, локальная боль в пробе Кемпа, локальная болезненность при пальпации в проекции «проблемного» фасеточного сустава, напряжение паравертебральных мышц и квадратной мышцы спины на больной стороне, дискомфорт и ограничение объема движений, возникающие главным образом при наклонах назад, а не вперед.
Следует отметить, что, несмотря на достаточно характерную и узнаваемую клиническую картину, при фасеточном синдроме отсутствуют патогномоничные клинические признаки, позволяющие надежно дифференцировать его от болей дискогенного и мышечного генеза, что значительно затрудняет диагностику данной патологии [7]. Примечательно, что даже углубленное нейроортопедическое обследование при выявлении фасеточного синдрома хотя и демонстрирует высокую чувствительность (88%), обнаруживает низкую специфичность (39%) по сравнению с результатами диагностических блокад под рентген-контролем [17].
Очевидно, что рентгенологическое исследование и компьютерная томография обладают достаточно высокой информативностью в отношении выявления признаков спондилоартроза. При этом факт обнаружения дегенеративных изменений фасеточных суставов не означает, что именно данные изменения являются причиной испытываемого пациентом болевого синдрома. Не получено убедительных данных о связи между изменениями фасеточных суставов при нейровизуализации и клиническими проявлениями фасеточного синдрома [7]. Известно, что в асимптомной популяции дистрофические изменения фасеточных суставов выявляются в 8–12% случаев [18]. C учетом того, что также не были выявлены корреляции между данными нейровизуализации и результатами диагностических блокад [19], а также эффективностью радиочастотной денервации фасеточных суставов [20], рутинное использование методов нейровизуализации для диагностики фасеточного синдрома, по всей видимости, следует признать нецелесообразным [8].
В настоящее время общепризнанным стандартом и единственным доказательным методом для подтверждения связи болевого синдрома с патологией фасеточных суставов является исчезновение (или значительное уменьшение) боли через несколько минут после проведения блокады медиальной ветви задней первичной ветви спинномозгового нерва под визуализационным (рентгеновская компьютерная томография) контролем [21–23]. В то же время очевидно, что диагностические блокады медиальной ветви не являются широко используемым методом в рутинной клинической практике.
Подобные диагностические сложности в отношении верификации фасеточных суставов как источника боли, очевидно, явились одной из причин того, что в МКБ-10 диагноз «фасеточный синдром», равно как и диагноз «спондилоартроз», отсутствует. Как правило, фасеточный синдром кодируется в рамках спондилеза – рубрика М47.8 «Другой спондилез (без миелопатии и радикулопатии)» [8].
Лечение фасеточного синдрома включает в себя купирование боли в острой стадии и комплекс мер по профилактике последующих обострений. Терапия обострений фасеточного синдрома проводится в соответствии с общими принципами лечения неспецифических болей в спине и имеет своей целью максимально быстрое и полное обезболивание с последующим ранним проведением реабилитационных мероприятий. Существующие Европейские рекомендации по лечению неспецифических болей в спине (low back pain) носят универсальный характер вне зависимости от источника болевых ощущений (диск, фасеточные суставы, мышцы и др.). Во многом это обусловлено тем, что патогномоничные симтомы, характерные для дискогенных, фасеточных или мышечных болей, отсутствуют, а характер и интенсивность болевого синдрома в значительной степени зависят от когнитивных установок и состояния психоэмоциональной сферы пациента. Кроме того, в клинической практике нередки случаи одновременного наличия у пациентов дископатии, спондилоартроза, дисфункции крестцово-подвздошного сочленения и миофасциального болевого синдрома в различных сочетаниях. Все это чрезвычайно затрудняет достоверное определение источника боли, и, по мнению многих авторов, существующие методы исследования не позволяют достоверно выявлять причину боли в пояснице в 70–80% случаев.
Согласно существующим Европейским рекомендациям по лечению острых неспецифических болей в спине [van Tulder М. et al., 2006], наивысшим уровнем доказательности обладают: нестероидные противовоспалительные препараты (НПВП), миорелаксанты, а также комбинации НПВП с миорелаксантами или традиционными анальгетиками (парацетамол). Кроме того, рекомендуется сохранение повседневной двигательной активности, в то время как соблюдение постельного режима рассматривается в качестве фактора риска хронизации болей в спине. Важное значение придается информированию пациента о природе заболевания, его прогнозе и методах лечения. Показано, что объяснение пациенту в доступной форме причин развития болевого синдрома с акцентом на доброкачественность данного состояния и хороший прогноз способствует снятию стресса, значимо улучшает результаты терапии и делает участие пациента в реабилитационных программах более активным [24]. При хронических неспецифических болях в спине, в соответствии с Европейскими рекомендациями [Airaksinen O. et al., 2006], наивысшим уровнем доказательности обладают НПВП (на период обострений или короткими курсами – до 3 мес.), бензодиазепиновые миорелаксанты, антидепрессанты, опиоидные анальгетики, занятия ЛФК и когнитивно-поведенческой психотерапией, капсаицин местно и мультидисциплинарный подход [25].
Обращает на себя внимание, что в рекомендациях по лечению как острых, так и хронических болей в спине в качестве препаратов первой линии, имеющих самую большую доказательную базу, выступают НПВП. Очевидно, это объясняется их патогенетически обусловленным обезболивающим эффектом на основе противовоспалительного действия. Быстрота наступления и выраженность анальгезии, разнообразие лекарственных форм, простота использования и относительная доступность превратили НПВП в одну из наиболее широко применяемых в современной медицине групп лекарственных средств. К недостаткам НПВП, существенно ограничивающим их применение в клинической практике, прежде всего следует отнести побочные эффекты терапии (гастроинтестинальные, кардиоваскулярные осложнения, нарушения функции печени, почек), частота и спектр которых различаются у отдельных препаратов и определяются особенностями фармакокинетики и фармакодинамики. Серьезность возможных осложнений терапии послужила причиной выработки современных подходов к назначению НПВП, согласно которым основным фактором, определяющим выбор препарата в конкретной клинической ситуации, является не его терапевтическая эффективность (считается, что все препараты группы НПВП в этом отношении сопоставимы [26]), а риск развития побочных эффектов у данного пациента с учетом его возраста, сопутствующей патологии, получаемой лекарственной терапии [8, 27].
Следует отметить, что при фасеточном синдроме вопрос безопасности НПВП-терапии имеет особую актуальность. Это обусловлено хроническим рецидивирующим характером болевого синдрома, требующим проведения повторных, зачастую длительных курсов НПВП-терапии, а также тем обстоятельством, что большинство пациентов – люди пожилого возраста, нередко с тяжелой сопутствующей патологией, для которых риск развития побочных эффектов максимален [27].
В России одним из наиболее популярных препаратов из группы НПВП является нимесулид (Найз), широко применяющийся в т. ч. и при патологии опорно-двигательного аппарата, как при остром болевом синдроме, так и при заболеваниях, требующих длительной терапии (ревматоидный артрит, анкилозирующий спондилит, остеоартроз). Как и все НПВП, нимесулид, блокируя в очаге воспаления и тканевого повреждения фермент ЦОГ-2, подавляет продукцию простагландинов – медиаторов воспаления и ноцицептивной боли и за счет этого оказывает противовоспалительный и анальгетический эффекты, по выраженности которых он не уступает, а по некоторым данным [28], несколько превосходит многие препараты данной группы. При этом благодаря минимальному влиянию на ЦОГ-1 (нимесулид относится к препаратам, преимущественно действующим на ЦОГ-2) он характеризуется благоприятным профилем безопасности, в особенности в отношении риска гастроинтестинальных осложнений НПВП-терапии [29, 45].
Кроме того, нимесулид обладает рядом фармакологических эффектов, имеющих значение для клинической практики и не связанных напрямую с влиянием на активность ЦОГ-2. В частности, он способен подавлять синтез ИЛ-6 и урокиназы, а также снижать активность металлопротеиназ, разрушающих протеогликаны и коллаген, что позитивно влияет на сохранение структуры хрящевой ткани и субхондральной кости [30–32]. Очевидно, этот эффект нимесулида может быть особенно значим у пациентов с заболеваниями позвоночника и суставов, связанных с дегенеративными изменениями хрящевой ткани, в т. ч. фасеточным синдромом.
В последние годы широко обсуждается вопрос о центральных механизмах обезболивающего действия НПВП. Считается, что ингибирование синтеза простагландинов в центральной нервной системе способно препятствовать формированию феномена центральной сенситизации и, следовательно, уменьшать риск присоединения нейропатического компонента боли и ее хронизации. Наличие «центральных» анальгетических эффектов у нимесулида подтверждается данными экспериментальных исследований [33, 34].
Существующие рандомизированные клинические исследования демонстрируют высокую эффективность нимесулида при лечении боли в спине. Так, в исследовании T. Pohjolainen et al. (2000) у 104 пациентов с острой неспецифической болью в нижней части спины терапия нимесулидом (200 мг/сут) сопровождалась большим эффектом по сравнению с терапией ибупрофеном (1800 мг/сут) как по выраженности анальгетического действия, так и в отношении восстановления функции позвоночника. При этом нимесулид почти в 2 раза реже по сравнению с ибупрофеном (7% и 13% соответственно) вызывал побочные эффекты со стороны желудочно-кишечного тракта (ЖКТ) [35].
В работе L. Konstantinovic et al. (2010) была продемонстрирована эффективность нимесулида в дозе 200 мг/сут при лечении 546 пациентов с вертеброгенной радикулопатией (т. е. при болевом синдроме смешанного – ноцицептивного и нейропатического характера) при хорошей переносимости терапии [36].
В исследовании K. Ilic et al. (2009) у пациентов с болью в нижней части спины и гонартрозом, получавших нимесулид в дозе 200 мг/сут в течение 3 нед., отмечали достоверное уменьшение выраженности локального болевого синдрома, нарастание объема активных движений в пораженных суставных группах, уменьшение выраженности мышечно-тонических нарушений и симптомов «натяжения» нервных стволов; переносимость терапии была расценена как хорошая [37].
Учитывая, что фасеточный синдром является по сути своей патологией суставов, определенный интерес представляют результаты рандомизированных исследований по применению нимесулида у пациентов с остеоартрозом. Так, в исследовании P. Lucker et al. (1994) у 199 пациентов терапия нимесулидом 200 мг/сут в течение 3 мес. оказалась более эффективной, чем применение этодолака 600 мг/сут при сопоставимой частоте побочных эффектов [38]. В работе E. Huskisson et al. (1999) у 279 пациентов с остеоартрозом эффективность терапии нимесулидом (200 мг/сут) и диклофенаком (150 мг/сут) в течение 6 мес. была практически одинаковой, однако переносимость нимесулида была значительно лучше (ЖКТ-осложнения были отмечены у 36% больных, получавших нимесулид, и у 47% – принимавших диклофенак) [39]. В наиболее масштабном и продолжительном исследовании W. Kriegel et al. (2001), изучавших эффективность и безопасность терапии нимесулидом (200 мг/сут) и напроксеном (750 мг/сут) у 370 больных остеоартрозом в течение 12 мес., эффективность и безопасность терапии были несколько выше при приеме нимесулида [40].
Одним из наиболее важных достоинств нимесулида является относительно низкая частота развития класс-специфических для НПВП осложнений со стороны ЖКТ, во многом определяющих соотношение риск/польза при лечении препаратами этой группы. Данные, свидетельствующие о благоприятной переносимости нимесулида в отношении ЖКТ, получены в ряде крупных эпидемиологических исследований.
Так, A. Conforti et al. (2001) проанализировали 10 608 сообщений о серьезных побочных эффектах, связанных с приемом различных НПВП. Согласно полученным данным, количество ЖКТ-осложнений на прием нимесулида составило 10,4% от их общего числа. При этом диклофенак был причиной осложнений в 21,2% случаев, кетопрофен – в 21,7%, а пироксикам – в 18,6% [41]. В масштабном эпидемиологическом исследовании J. Laporte et al. (2004) оценивался риск развития ЖКТ-кровотечений на фоне приема различных НПВП по результатам анализа причин 2813 опасных ЖКТ-кровотечений. Нимесулид показал большую безопасность, чем многие другие НПВП, популярные в Европе: относительный риск кровотечения для нимесулида составил 3,2, для диклофенака –3,7, мелоксикама – 5,7, а рофекоксиба – 7,2 [42].
При наличии факторов риска развития НПВП-индуцированных гастропатий (пожилой возраст, язвенная болезнь в анамнезе, прием кортикостероидов, дезагрегантов и антикоагулянтов) на протяжении всего курса НПВП для защиты ЖКТ целесообразно назначать ингибиторы протонной помпы (Омез 20 мг/сут). Следует помнить, что хотя при парентеральном и ректальном применении НПВП диспепсия возникает реже, чем при приеме таблетированных форм, риск развития язв и эрозий ЖКТ практически не зависит от пути введения препарата [27].
Оценка влияния нимесулида на риск сердечно-сосудистых катастроф проводилась в крупном эпидемиологическом исследовании, выполненном A. Helin-Salmivaara et al. (2006) на основе анализа 33 309 эпизодов инфаркта миокарда. Показатель относительного риска инфаркта для нимесулида составил 1,69 и был сопоставим с аналогичными показателями для мелоксикама, этодолака и неселективных НПВП [43].
В последние годы активно обсуждается безопасность нимесулида в контексте риска развития довольно редкого лекарственного осложнения – НПВП-гепатопатии, представляющей собой проявление метаболической идиосинкразии. Объективный анализ имеющихся литературных данных показывает, что гепатотоксичность нимесулида не выше, чем у многих других представителей класса НПВП [44].
Таким образом, нимесулид (Найз) обладает выраженным анальгетическим и противовоспалительном действием, благоприятным профилем безопасности терапии, прежде всего в отношении риска развития НПВП-индуцированных гастропатий, и может быть с успехом использован при лечении неспецифических болей в спине, как острых, так и хронических, в т. ч. обусловленных фасеточным синдромом.
Наряду с консервативной терапией (НПВП, миорелаксанты, антидепрессанты) в лечении фасеточного синдрома могут быть использованы специфические малоинвазивные вмешательства на суставах. В частности, у пациентов с положительным эффектом от диагностических блокад и отсутствием противопоказаний к применению глюкокортикоидов выполняют интра- и периартикулярные лечебные блокады с местными анестетиками и гормонами (дексаметазон 4 мг, бетаметазон 2–4 мг, метилпреднизолон 40 мг). Данные об эффективности блокад противоречивы. Считается, что наиболее отчетливый и продолжительный (до 3 мес.) эффект они могут давать у пациентов с выраженным воспалительным процессом на фоне дегенеративных изменений [46, 47], а также у пациентов с положительным эффектом от предшествующих диагностических блокад [7].
В настоящее время достоверные данные в пользу или против применения физиотерапевтических методов лечения при обострениях фасеточного синдрома отсутствуют [24], однако многими авторами рекомендуется использование магнитотерапии, синусоидально-модулированных токов, фонофореза с гидрокортизоном для снятия отека и воспаления в фасеточных суставах. Считается, что применение методов мануальной терапии при обострении фасеточного синдрома может приводить к восстановлению мобильности в фасеточных суставах и снятию болевого синдрома [24]. Учитывая ведущую патогенетическую роль дегенерации ткани хряща в развитии фасеточного синдрома, широко обсуждается возможность использования в терапии и профилактике спондилоартроза хондропротекторов в качестве структурно- и симптом-модифицирующей терапии, однако рандомизированные клинические исследования, подтверждающие их эффективность именно при фасеточном синдроме, отсутствуют.
При частых и тяжелых обострениях фасеточного синдрома, неэффективности медикаментозной терапии, лечебных блокад применяются методы оперативного лечения, среди которых наиболее эффективным и широко используемым во всем мире является радиочастотная денервация (деструкция, аблация) фасеточных суставов (РЧД). РЧД – миниинвазивная нейрохирургическая операция, которая может быть проведена под местной анестезией в амбулаторных условиях. При РЧД пункционным способом под интраоперационным рентген-контролем периартикулярно вводятся специальные электроды, через которые производится коагуляция нервных окончаний, находящихся в капсуле фасеточных суставов. Следует отметить, что РЧД не влияет на состояние фасеточных суставов, а лишь оказывает симптоматический эффект, приводя к регрессу болевого синдрома. В многочисленных неконтролируемых исследованиях эффективности РЧД при фасеточном синдроме на поясничном уровне положительный эффект отмечается у 50–80% пациентов [20, 48]. Результаты плацебо-контролируемых исследований не столь многочисленны и не столь оптимистичны [49–51]. В систематическом обзоре эффективности РЧД отмечено, что эффективность метода зависит от тщательности отбора пациентов, прежде всего от точности установления источника боли [52].
Проведение РЧД фасеточных суставов оправданно при отсутствии эффекта от медикаментозной терапии (или наличии противопоказаний к ее проведению), при частых (чаще, чем 1 раз в 3–4 мес.) обострениях, отсутствии противопоказаний к РЧД (возраст старше 80 лет, выраженная депрессия, зависимость от анальгетических или психотропных препаратов) и положительном результате диагностической периартикулярной блокады [8].
Основным преимуществом метода РЧД является быстрое купирование болевого синдрома и восстановление двигательной активности. Осложнения и побочные эффекты процедуры наблюдаются редко. Спустя 6–12 мес. после операции практически облигатно возникает рецидив болевого синдрома вследствие спонтанной реиннервации фасеточных суставов, что может потребовать выполнения повторной РЧД. Среди других методов оперативного лечения можно отметить операцию артродеза фасеточных суставов [53, 54], а также перспективные методики пульсовой РЧД [56] и криодеструкции [56].
Профилактика обострений фасеточного синдрома в период ремиссии включает в себя прежде всего занятия кинезиотерапией, плаванием, направленные на укрепление мышечного корсета (в особенности мышц нижнегрудного и поясничного отделов), связочного аппарата, восстановление нарушенной биомеханики позвоночного столба, правильной осанки. Определенную пользу может принести использование ортопедических подушек, шейного воротника, ортопедического матраса. Снятию мышечного спазма, явлений отека, воспаления в суставах могут способствовать применение рефлексотерапии, физиотерапии, массажа, курсовой прием хондропротекторов и витаминов. Как и при хронической боли любой локализации, обязательным этапом обследования пациента является диагностика нарушений в эмоциональной сфере и их коррекция с помощью психотерапии и приема антидепрессантов [2, 7, 8].