Узлы регенераторы в печени что это
«Резервный» механизм восстановления печени
«Резервный» механизм восстановления печени
Слева — ладонь здорового человека; справа — ладонь человека, больного желтухой.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Быстрая утомляемость, потеря аппетита, тошнота, пожелтение кожных покровов и даже частые головные боли — все эти симптомы могут быть косвенными свидетельствами патологий печени. Несмотря на высокую способность клеток печени к восстановлению, в некоторых тяжелых случаях они просто не справляются с болезнью. Новое исследование команды ученых из Центра регенеративной медицины в Эдинбурге, Массачусетского технологического института и Сколковского института науки и технологий показывает, как с помощью блокирования основного пути восстановления клеток печени удалось открыть резервных «ремонтников».
Конкурс «био/мол/текст»-2017

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Открытие, предсказанное мифами: регенерация у рептилий
Способность организмов к регенерации, то есть восстановлению структуры и функций органов, является одной из важных загадок медицины, которую человек давно пытается разгадать. Наблюдения за животным миром позволили сформулировать следующую закономерность: чем проще устроено животное, тем легче ему восстановить утраченные органы. И если дождевой червь способен «достроить» половину собственного тела, а ящерица — отрастить новый хвост, то у человека способности к регенерации представлены в более узком диапазоне [1], [2].
Сказочных существ, способных отрастить себе новую голову или хвост, довольно много. Но и Лернейская гидра (рис. 1), и горгона Медуза, и даже Змей Горыныч имеют вполне реального «родственника» — тритона. Этот представитель хвостатых амфибий считается одним из древнейших видов фауны на Земле. Тритоны успешно восстанавливают не только хвост и лапы, но даже поврежденные сердце и спинной мозг. Однако амфибии — далеко не единственные существа, которым доступна функция «саморемонта». Например, рыбок данио рерио используют не только в аквариумистике, но и для изучения регенерации тканей сердца. А первым животным, благодаря которому появился термин «регенерация», стал речной рак. Изучением восстановления утраченных ног у раков занимался французский ученый Рене Реомюр, предложивший новый термин еще в 1712 году.
Рисунок 1. «Сражение Геракла с Лернейской гидрой» Антонио дель Поллайоло (1475 г.).
Неудивительно, что ученым хочется понять, почему ящерица, например, может восстановить утерянный хвост, а человек отрастить новую руку не может. Изучение структуры и состава тканей сразу после потери ящерицей хвоста позволило обнаружить модель регенерации у рептилий. В период заживления базальные клетки эпидермиса активно делятся, постепенно «закрывая» собой рану. Дополнительная агрегация делящихся клеток на дистальном конце позвоночника способствует разрастанию бластемы — скоплению неспециализированных клеток. В этот момент запускаются процессы образования новых кровеносных сосудов, а следом — и новых периферических аксонов. Наиболее поздно в дело вступают новообразования костной ткани и мышц. Однако точный механизм регенерации хвоста у ящериц не изучен до конца. Недавнее исследование Университета штата Аризона и Института геномных исследований позволило обнаружить молекулы микро-РНК, способствующие регенерации мышц, хрящей и позвоночника [3]. Возможно, эта работа позволит разработать методы лечения, основанные на управлении экспрессией генов с помощью микро-РНК.
Открытие, сделанное случайно: регенерация у мышей
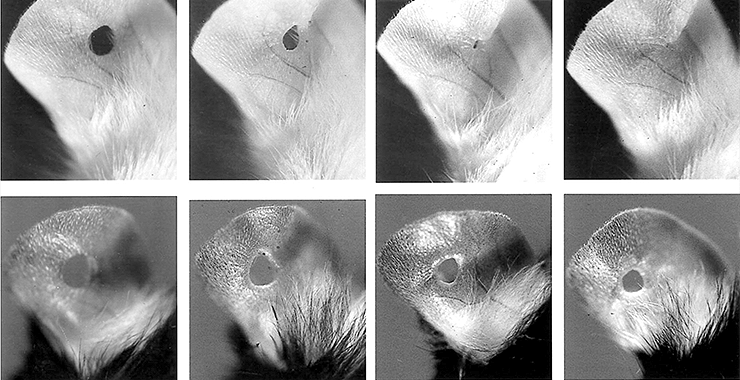
Но как обстоят дела с возможностями регенерации на уровне целых органов у более высокоорганизованных, чем ящерицы, организмов? Еще недавно ученые были уверены, что млекопитающие не способны восстанавливать утраченные органы. Но это убеждение пошатнуло открытие, сделанное в лаборатории иммунолога Эллен Хебер-Кац из исследовательского центра в Филадельфии. Там проводили различные эксперименты на особых «пациентах» — генетически модифицированных мышах линии Murphy Roth Large (MRL). Такие особи отличались от обычных тем, что у них не работали Т-клетки иммунной системы. Однажды доктор Хебер-Кац дала своему лаборанту несложное задание: пометить выбранных для очередного эксперимента мышей, сделав у них небольшие двухмиллиметровые отверстия в ушах. Через несколько недель выяснилось, что дырочек в ушах подопытных нет. Структура кровеносных сосудов, хрящей, тканей выглядела неповрежденной. Однако лаборант заверил доктора, что задача по «мечению» мышей была своевременно выполнена. После повторения эксперимента с ушной раковиной эффект был таким же: уже через четыре недели на «проколотых» участках ушей образовалась бластема (рис. 2) [4]. Следующим «опытным» объектом стал хвост — и вновь удалось продемонстрировать частичную регенерацию тканей. Однако восстановительные способности MRL мышей не безграничны: например, вырастить новую лапку такая мышь, увы, не смогла. Причина заключается в различном расположении и количестве кровеносных сосудов в органах и тканях животного. Без прижигания мышь просто погибнет от большой потери крови — задолго до запуска регенерационных процессов. А прижигание на месте ампутированной конечности исключает появление бластемы.
Рисунок 2. Этапы восстановления ткани уха у обычной лабораторной мыши (снизу) и трансформированной линии MRL (сверху).
В результате серии наблюдений за трансгенными мышами удалось показать, что секрет их успеха — в определенном белке. Так, у мышей линии MRL заблокирована экспрессия гена, кодирующего белок р21 (ингибитор циклинзависимой киназы 1А), который регулирует процесс нормального деления клеток. Подавление активности этого гена у нормальных мышей показывает аналогичную способность к регенерации повреждений [5]. Но проводить подобные манипуляции следует с большой аккуратностью: «отключение» гена р21 может привести к нарушению нормального размножения клеток, что способно привести к катастрофическому делению всех клеток тела.
Повседневная реальность: возможности регенерации у человека
А как обстоят дела с регенерацией у людей? Даже без «выключения» гена, кодирующего белок р21, организм человека может восстанавливать некоторые органы. Например, кожу, чья регенерирующая способность привычна для нас так же, как и воздух. Самый большой по площади орган нашего тела постоянно обновляет собственную структуру за счет омертвения и отторжения клеток эпидермиса с последующей заменой их новыми клетками. Сходным образом происходит процесс восстановления других эпителиальных тканей — например, слизистых оболочек дыхательных путей, а также желудка и кишечника. На втором месте в иерархии регенерирующих способностей находится костная ткань. Известно, что переломы довольно успешно заживляются в течение определенного периода неподвижности.
А среди внутренних органов заслуженным лидером по регенерации является печень. Легенда о титане Прометее, у которого всего за одну ночь выклеванная печень вырастала вновь (рис. 3), имеет в себе рациональное зерно.
Рисунок 3. «Прикованный Прометей». Скульптура Никола-Себастьяна Адама, 1762 г. (Лувр).
Действительно, печень обладает уникальным свойством восстанавливаться до своего первоначального объема, даже если разрушено более 70% печеночной ткани. Подобный процесс происходит за счет работы клеток печени — гепатоцитов. Эти клетки играют ключевую роль в модификации и выводе из организма токсичных веществ. В здоровом органе, не тронутом патологическими процессами, эти клетки обычно находятся в состоянии покоя. Но при необходимости восстановления целостности органа, например, после частичной резекции (удаления части органа), почти все гепатоциты активируются и приступают к делению. Причем делятся они 1–2 раза, а затем снова возвращаются в покоящееся состояние. Это свойство лежит в основе лечения некоторых заболеваний, например, цирроза печени или гепатита, когда пациенту пересаживают часть здоровой печени от донора. Однако такие манипуляции могут привести к ряду проблем со здоровьем, в том числе расширению вен пищевода и желудка, почечной недостаточности и желтухе. Более того, появление в печени пациента быстро делящихся клеток донора может привести к возникновению ракового заболевания. Справиться же своими силами при прогрессирующей болезни гепатоциты уже не могут, ведь к делению способны лишь здоровые клетки, которых в организме больного остается все меньше и меньше.
Получается, что, несмотря на мощный регенеративный потенциал, восстановительные способности печени имеют предел. В случаях, когда патологический процесс заходит слишком далеко, эффект от работы гепатоцитов оказывается недостаточным. Например, когда здоровая печень поражается в результате токсических или вирусных воздействий, что провоцирует разрастание соединительной ткани (фиброз). Существуют ли другие способы восстановления структуры этого жизненно важного органа без участия гепатоцитов? На этот вопрос позволяет ответить совместное исследование команды ученых из Эдинбургского университета, Массачусетского технологического института и Сколковского института науки и технологий [6].
Перспективная реальность: ускоренная регенерация печени
Для изучения процессов регенерации печени использовали трансгенных мышей линии tdTomato (tdTom). Эта линия модифицирована красными флуоресцентными белками, что позволяет визуализировать клетки печени [7]. Однако поиск других «спасательных» клеток осложняет то, что гепатоциты в пораженном организме продолжают работать. Для идентификации «не-гепатоцитов» исследователи использовали технологию нокдауна генов у мышей. Эффект нокдауна заключается в том, что позволяет временно снижать активность конкретных генов, не внося изменения в структуру хромосом и последовательность ДНК. Для «выключения» генов, ответственных за деление и миграцию гепатоцитов, создали особые липидные наночастицы с короткими интерферирующими РНК (siRNA) [8], [9]. С их помощью удалось заблокировать экспрессию необходимых генов.
Снижение пролиферации гепатоцитов за счет «выключения» интересующих ученых генов проводили на двух моделях. В первом случае временно блокировали ген ITGB1, который кодирует β1-интегрин. Вторая модель — одновременное блокирование β1-интегрина и стимуляция избыточной экспрессии белка р21. Обе модели обладали сходным эффектом, однако их механизмы отличались: β1-интегрин вызывает некроз гепатоцитов, а избыточная экспрессия р21 подавляет их пролиферацию.
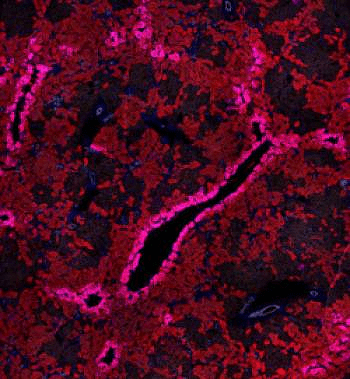
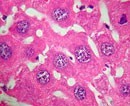
Рисунок 4. Регенерация печени с помощью клеток желчных протоков (выделены белым цветом).
Подобная «блокада» основных функциональных клеток печени привела к необычному эффекту: при выключении главного механизма регенерации запускался резервный способ с участием клеток желчных протоков. Так, потеря β1-интегрина и повышение уровня белка р21 привели к значительному увеличению численности гепатоцитов, полученных из холангиоцитов. Эти эпителиальные клетки внутрипеченочных желчных протоков составляют всего 2–3% от общей популяции, однако дальнейшие наблюдения показали, что именно они способны «перепрограммироваться» и превращаться в гепатоциты, тем самым восстанавливая печень (рис. 4). Более того, холангиоциты показали лучшую, чем гепатоциты, способность к делению. Ранее обнаружили, что они близки к овальным клеткам печени — своеобразным «стволовым» агентам данного органа [10].
Для того чтобы отследить регенеративные способности холангиоцитов, использовали три независимых пути:
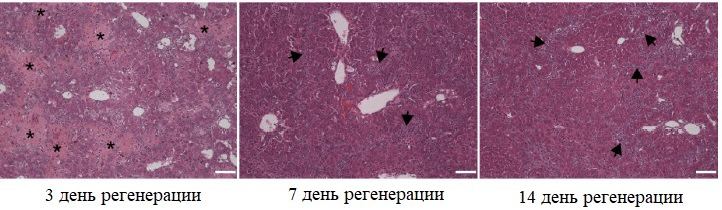
Для изучения регенерации печени за счет не-гепатоцитов по всем трем путям визуализировали отдельные участки печени. Оказалось, что за счет холангиоцитов восстанавливается примерно 20–30% гепатоцитов, причем малые пролиферативные гепатоциты идентифицировали уже с 7 дня, а к 14 дню регенерации их количество значительно увеличивалось (рис. 4–6).
Рисунок 5. Динамика восстановления печеночной ткани с помощью холангиоцитов (на примере модели холестатической болезни печени). Звездочками показаны некротические области; стрелками обозначены области с клеточным инфильтратом.
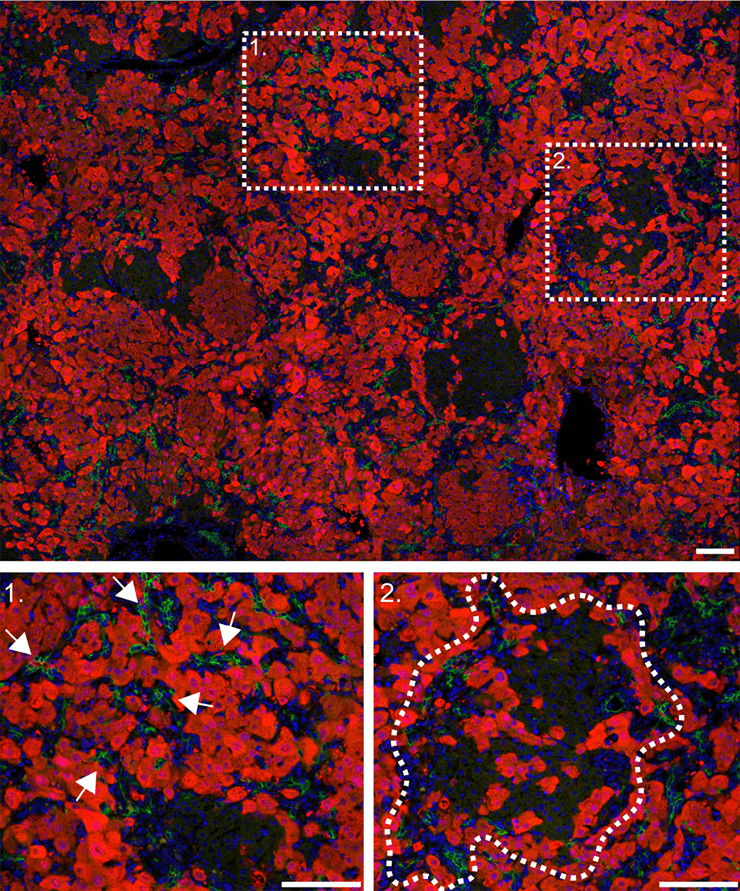
Рисунок 6. Клетки печени мыши, трансформированной по гену ITGB1 (14 день регенерации). Визуализация с помощью красных флуоресцентных белков. 1 — стрелками показаны инвазивные клетки; 2 — пунктиром обведена область регенеративного узла.
Получается, что в печени существует резервный механизм регенерации: трансформация клеток желчных протоков в функциональные гепатоциты при блокировании β1-интегрина. Возможно, в организме существуют и другие гены-мишени, «выключение» которых стабилизирует процессы, связанные с развитием фиброза и дальнейшего цирроза печени. Ученым еще предстоит раскрыть механизмы сигналов, побуждающих желчные клетки запускать процессы «перепрограммирования». Однако результаты исследования уже сегодня открывают новое направление клеточной регенеративной медицины: разработку препаратов, стимулирующих холангиоциты. Возможно, в будущем медицина избавится от необходимости проводить сложные и дорогостоящие операции по пересадке печени. Взамен этого распространится более доступная технология: «включение» сигналов о необходимости регенерации, когда с помощью наиболее активных холангиоцитов будут запускаться процессы активного деления клеток печени.
Регенерация печени – это несложно!
Результаты недавно проведенного исследования указывают на то, что регенерация печени происходит не под действием факторов транскрипции, как считалось, а благодаря активации обычного деления клеток.
Печень является одним из немногих органов, способных восстанавливать первоначальный размер даже при сохранении всего лишь 25% нормальной ткани. Механизмы, лежащие в основе регенерации ее ткани, изучены не до конца. Полученные ранее результаты указывали на то, что клетки, обеспечивающие регенерацию тканей, ведут себя подобно клеткам развивающегося эмбриона.
Многие белки, участвующие в регенерации органов, известны, и ученые активно изучают возможности их стимуляции для восстановления утраченных органов. Исследователи Гарвардской медицинской школы, работающие под руководством доцента Сета Карпа (Seth Karp), сконцентрировали свое внимание на поиске белков, участвующих в регенерации печени, восстановление которой спасло бы жизни многих пациентов с неоперабельными из-за большого объема опухолями печени.
С помощью ДНК-микрочипов и специального программного обеспечения авторы проанализировали активность генов в клетках регенерирующей печени взрослых мышей (которым предварительно удаляли две трети органа) и развивающейся печени мышиных эмбрионов, находящихся на разных этапах развития.
К удивлению ученых оказалось, что совпадают только несколько белков, участвующих в процессах эмбриональной и взрослой регенерации. Факторы транскрипции – белки, влияющие на содержащуюся в ядрах клеток ДНК, – высокоактивны только при регенерации эмбриональной печени, а стимулирующие деление клеток белки активны как в развивающейся, так и в регенерирующей печени.
Таким образом, регенерирующая печень ведет себя не как развивающийся эмбриональный орган, а увеличивается в размерах за счет обычной пролиферации клеток. Манипуляции c факторами транскрипции гораздо сложнее, чем изменение активности других белков, и полученные результаты указывают на то, что, стимулировать регенерацию печени – реальная задача.
В ближайшем будущем ученые планируют заняться идентификацией клеток, обеспечивающих регенерацию печени. Известно, что восстановление многих органов и тканей происходит за счет взрослых стволовых клеток, однако в случае печени в процесс вполне могут быть вовлечены обычные гепатоциты.
Статья Hasan H. Otu et al. «Restoration of Liver Mass after Injury Requires Proliferative and Not Embryonic Transcriptional Patterns» опубликована в Journal of Biological Chemistry от 13 апреля 2007 года.
NAME] => URL исходной статьи [
Ссылка на публикацию: Cbio
Код вставки на сайт
Регенерация печени – это несложно!
Результаты недавно проведенного исследования указывают на то, что регенерация печени происходит не под действием факторов транскрипции, как считалось, а благодаря активации обычного деления клеток.
Печень является одним из немногих органов, способных восстанавливать первоначальный размер даже при сохранении всего лишь 25% нормальной ткани. Механизмы, лежащие в основе регенерации ее ткани, изучены не до конца. Полученные ранее результаты указывали на то, что клетки, обеспечивающие регенерацию тканей, ведут себя подобно клеткам развивающегося эмбриона.
Многие белки, участвующие в регенерации органов, известны, и ученые активно изучают возможности их стимуляции для восстановления утраченных органов. Исследователи Гарвардской медицинской школы, работающие под руководством доцента Сета Карпа (Seth Karp), сконцентрировали свое внимание на поиске белков, участвующих в регенерации печени, восстановление которой спасло бы жизни многих пациентов с неоперабельными из-за большого объема опухолями печени.
С помощью ДНК-микрочипов и специального программного обеспечения авторы проанализировали активность генов в клетках регенерирующей печени взрослых мышей (которым предварительно удаляли две трети органа) и развивающейся печени мышиных эмбрионов, находящихся на разных этапах развития.
К удивлению ученых оказалось, что совпадают только несколько белков, участвующих в процессах эмбриональной и взрослой регенерации. Факторы транскрипции – белки, влияющие на содержащуюся в ядрах клеток ДНК, – высокоактивны только при регенерации эмбриональной печени, а стимулирующие деление клеток белки активны как в развивающейся, так и в регенерирующей печени.
Таким образом, регенерирующая печень ведет себя не как развивающийся эмбриональный орган, а увеличивается в размерах за счет обычной пролиферации клеток. Манипуляции c факторами транскрипции гораздо сложнее, чем изменение активности других белков, и полученные результаты указывают на то, что, стимулировать регенерацию печени – реальная задача.
В ближайшем будущем ученые планируют заняться идентификацией клеток, обеспечивающих регенерацию печени. Известно, что восстановление многих органов и тканей происходит за счет взрослых стволовых клеток, однако в случае печени в процесс вполне могут быть вовлечены обычные гепатоциты.
Статья Hasan H. Otu et al. «Restoration of Liver Mass after Injury Requires Proliferative and Not Embryonic Transcriptional Patterns» опубликована в Journal of Biological Chemistry от 13 апреля 2007 года.
Вторичные (метастатические) опухоли печени
Общее число больных с метастазами в печень составляет приблизительно одну треть от общего количества больных злокачественными опухолями.
В России ежегодно выявляют около 450 тысяч новых больных раком.
У значительной части из них уже имеются метастазы в печени, у других пациентов метастазы в печень могут быть выявлены в разные сроки после установления диагноза рака.
Количество всех больных с метастазами в печени в России составляет более 100 тысяч, что в десятки раз превосходит количество всех больных первичными опухолями печени и внутрипеченочных желчных протоков.
Метастазы в печень наиболее часто наблюдаются у больных с первичной опухолью толстой кишки, легких, желудка, поджелудочной железы, молочной железы. Рак желчевыводящих путей, пищевода, яичников, предстательной железы, почек, а также меланома реже поражают печень.
Чаще всего метастазы в печени повторяют строение первичных опухолей. Однако в ряде случаев метастазы отличаются от первичных опухолей по степени дифференцировки (созревания) опухолевых клеток, что затрудняет установление принадлежности первичной опухоли.
Как правило, метастатическое опухоли печени редко наблюдаются у больных циррозом печени. Это можно объяснить плохими условиями для фиксации и размножения опухолевых клеток в рубцовоизмененном органе.
Метастатический рак печени обычно характеризуется быстрым прогрессированием и отсутствием специфических лабораторных и клинических признаков.
Всех больных с метастазами в печени делят на две группы независимо от источников метастазирования:
(Более трех метастазов считаются множественными).
У больных с единичными метастазами симптомы заболевания напоминают проявления первичного рака печени (увеличение печени и тупые боли в правом подреберье при незначительных размерах опухоли).
У пациентов с множественными метастазами местные и общие симптомы более выражены и характеризуются нарастающей печеночной недостаточностью и осложнениями в виде механической желтухи.
У некоторых больных возникает отек нижних конечностей и расширение вен передней брюшной стенки в результате сдавления нижней полой вены. У 30% больных уже в момент установления диагноза имеется асцит (скопление жидкости в животе) за счет поражения брюшины.
Диагностика
Регулярное наблюдение и обследование больных, перенесших лечение по поводу злокачественной опухоли, позволяет относительно рано выявить метастазы в печени и провести соответствующее лечение. Прогноз (исход) заболевания лучше в случае обнаружения метастазов в печени после окончания лечения первичного рака различных локализаций по сравнению с больными, у которых метастазы выявлены в момент диагностики первичной опухоли.
Ультразвуковое исследование (УЗИ) позволяет решить большинство диагностических задач: размеры метастазов, связь их с крупными сосудами и протоками печени. Использование УЗИ во время операции дает возможность выявить дополнительные очаги опухоли внутри печени и помогает использовать методы местного воздействия на метастазы.
Рентгеновская компьютерная томография (РКТ) и магнитно-резонансная томография (МРТ) обычно не более эффективны, чем УЗИ, однако могут дать дополнительную полезную информацию, особенно при решении вопроса о хирургическом лечении метастазов в печени.
Пункционная биопсия (взятие кусочка ткани) печени показана в тех случаях, когда природа очагов в печени вызывает сомнения.
Ангиография (контрастное исследование сосудов) печени целесообразна при хорошо кровоснабжающихся метастазах и может помочь в уточнении локализации опухолевых очагов и их происхождении.
Всестороннее обследование позволяет решить комплекс вопросов, связанных с первичной опухолью, и определить план лечения по поводу метастатического поражения печени.
Лечение и прогноз (исход)
Лечение больных с метастазами в печень имеет особенности, отличные от лечения больных с первичными злокачественными опухолями печени и внутрипеченочных желчных протоков.
Ввиду биологических особенностей рака толстой кишки и его метастазирования, больные этой группы с метастазами в печень выделены в отдельную группу.
При хирургическом лечении метастазов рака толстой кишки большое значение придается прогностическим факторам, позволяющим судить об исходе заболевания.
К таким факторам относятся:
5-летняя выживаемость больных с метастазами рака толстой кишки в печень, перенесших частичное удаление печени, составляет 25-35%. При первично неоперабельных (неудалимых) метастазах рака толстой кишки в печени возможно проведение системной (внутривенной) и регионарной (через сосуды печени) химиотерапии. При этом после такого лечения у 15% больных удается выполнить операцию.
В первые два года у 40-60% оперированных больных может развиться рецидив (возврат) заболевания в печени. К концу третьего года без рецидива остаются около 30% оперированных больных.
К локальным методам лечения метастазов рака толстой кишки в печени относятся: радиочастотная термодеструкцая (разрушение опухоли высокой температурой), криодеструкция (уничтожение метастазов низкими температурами), введение в опухолевые узлы этанола и др.
Для системной химиотерапии больных с метастазами рака толстой кишки используют различные противоопухолевые препараты и их комбинации: фторурацил, тегафур, капецитабин, иринотекан, оскалиплатин, ралтитрексед. Эффект от химиотерапии наблюдается у 14-50% больных.
Комбинированное (сочетанное) лечение больных с метастазами рака толстой кишки в печень дает наилучшие отдаленные результаты.
Лечение метастазов других опухолей в печень
Выживаемость больных при хирургическом лечении не зависит от сроков обнаружения метастазов после удаления первичной опухоли, объема оперативных вмешательств, размеров и количества метастазов. Показатели отдаленной выживаемости лучше после резекции печени, чем при химиотерапии. Непременным условием резекции печени по поводу метастазов является полное удаление первичной опухоли. Криодеструкция, микроволновая гипертермическая коагуляция, внутриопухолевое введение этанола, уксусной кислоты, ультразвуковая фокусная, лазерная, радиочастотная термодеструкция метастазов в печени в сочетании с местной или системной химиотерапией и резекцией печени носят паллиативный характер и направлены на увеличение продолжительности жизни. Все указанные методы лечения характеризуются удовлетворительной переносимостью больными.
Комбинированное лечение
У больных с химиочувствительными метастазами в печени (рак молочной железы, рак яичка, рак яичников) оптимальным является применение операции с предварительной химиотерапией и возможной химиотерапией после операции по поводу изолированного поражения печени.
Другим вариантом лечения может быть операция в комбинации с местным воздействием (радиочастотная термодеструкция, криодеструкция, введение в опухоль этанола и др.)