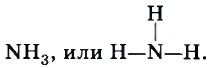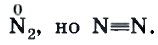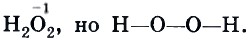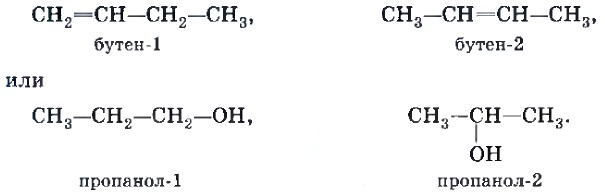Установил что углерод в органических соединениях всегда четырехвалентен
(1829-96), немецкий химик-органик. Показал, что углерод четырехвалентен (1857) и его атомы могут соединяться друг с другом в цепи (1858). Предложил (1865) циклическую формулу бензола
Последняя бука буква «е»
Ответ на вопрос «(1829-96), немецкий химик-органик. Показал, что углерод четырехвалентен (1857) и его атомы могут соединяться друг с другом в цепи (1858). Предложил (1865) циклическую формулу бензола «, 6 (шесть) букв:
кекуле
Альтернативные вопросы в кроссвордах для слова кекуле
Определение слова кекуле в словарях
Примеры употребления слова кекуле в литературе.
Например, Кекуле увидел во сне бензольное кольцо в виде змеи, кусающей свой хвост.
Упоминание Воронина о Кекуле и Менделееве привело главу Института Фоксхола к пугающим аналогиям.
Это сновидение помогло Кекуле понять, что структура бензола представляет из себя замкнутое карбонное кольцо.
Стоит обратить внимание и на намеки Кекуле, что он уже видел подобные сновидения до того, как понимание их значения пронзило его.
Узнав о том, Соколов вздохнул с облегчением: лаборатория доставалась в хорошие руки, а что до разницы во взглядах, то Абашев упустил из виду, что Соколов на лекциях одинаково подробно освещал и свою, и бутлеровскую теории, и взгляды Августа Кекуле, и многое множество иных мнений современных ученых, оставляя в сторонен лишь бездоказательные измышления, сколь бы заманчивы они ни были.
Источник: библиотека Максима Мошкова
Формирование органической химии как науки. Теория строения органических соединений А.М. Бутлерова. Углеродный скелет. Радикалы. Функциональные группы
Формирование органической химии как науки. Теория строения органических соединений А.М. Бутлерова. Углеродный скелет. Радикалы. Функциональные группы
1. Провести первичный инструктаж по правилам техники безопасности при работе в химическом кабинете. Познакомить с основными историческими фактами в развитии органической химии, основными положениями теории строения органических соединений А.М. Бутлерова. Ввести понятия «углеродный скелет», «радикалы», «функциональные группы» (предметный результат).
2. Развивать умение генерировать идеи, выявлять причинно-следственные связи, искать аналогии и работать в команде, пользоваться альтернативными источниками информации (метапредметный результат).
3. Формирование умений управлять своей учебной деятельностью, подготовка к осознанию выбора дальнейшей образовательной траектории (личностный результат).
Первичный инструктаж по правилам техники безопасности (5 мин).
Ознакомление с плакатами постоянной экспозиции в кабинете химии, ознакомление с порядком эвакуации из кабинета химии в случае возникновения чрезвычайной ситуации.
Изучение нового материала (30 мин).
В середине 19 века установлено, что в состав всех орг. в-в входит углерод. Органическая химия – химия соединений углерода. Число известных органических веществ: свыше 25 млн.
Демонстрационные опыты: «Образцы органических веществ и материалов», «Модели молекул органических веществ», «Растворимость органических веществ в воде и неводных растворителях», «Плавление, обугливание и горение органических веществ».
В 1858 году Кекуле установил, что углерод в органических соединениях всегда четырехвалентен. Углерод может объединяться в цепи и циклы.
Структурные формулы – химические формулы, условно изображающие строение молекул органических соединений с учетом геометрического расположения атомов.
Теория строения органических соединений А.М. Бутлерова.
В 1861 году Александр Михайлович Бутлеров сформулировал основные идеи теории:
1. Все атомы, образующие молекулы органических веществ, связаны в определенной последовательности согласно их валентностям.
Радикалы – свободные атомы или группы атомов с неспаренными электронами, неустойчивые и способные быстро вступить в химические превращения.
Функциональные группы – группы атомов, обусловливающие характерные химические свойства органических веществ. Карбоксильная, карбонильная, спиртовая и др.
2. Свойства веществ зависят не только от качественного и количественного состава, но и от порядка соединения атомов в молекуле.
Изомерия – явление существования нескольких веществ, имеющих один и тот же состав и одну и ту же молекулярную массу, но различающихся строением молекул.
3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства.
Этан и этилен. Обесцвечивание раствора перманганата калия.
4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
Уксусная и хлоруксусная кислоты.
Подведение итогов учебного занятия, рефлексия (10 мин).
Решение задач по Рябов Сборник задач, упражнений и тестов по химии. 10 класс. – С.8.
Домашнее задание: §1, §2, с. 10 №4.
Практическое занятие по теме «Изготовление моделей молекул органических веществ
Данная работа проводится с учащимися, которые пришли получать профессиональное образование. Очень часто знания по химии у них слабые, поэтому нет заинтересованности к предмету. Но в каждом ученике есть желание учиться. Даже слабоуспевающий, ученик проявляет интерес к предмету, когда ему что-нибудь удается сделать самому.
Задания в работе составлены с учетом пробелов в знаниях. Каткий теоретический материал позволяет быстро вспомнить необходимые понятия, что помогает учащимся выполнить работу. Построив модели молекул, ребятам легче написать структурные формулы. Для более сильных учащихся, которые быстрее выполняют практическую часть работы, даны расчетные задачи. Каждый учащийся при выполнении работы добивается результата: одни успевают построить модели молекул, что делают с удовольствием, другие выполнить большую часть работы, третьи делают все задания, и оценку получает каждый учащийся.
формирование навыков самостоятельной работы;
обобщить и систематизировать знания учащихся о теории строения органических соединений;
закрепить умение составлять структурные формулы углеводородов;
отработать навыки давать названия по международной номенклатуре;
повторить решение задач на определение массовой доли элемента в веществе;
развивать внимание и творческую активность;
развивать логическое мышление;
воспитывать чувство ответственности.
“ Изготовление моделей молекул органических веществ.
Составление структурных формул углеводородов”.
Научиться составлять модели молекул органических веществ.
Научиться записывать структурные формулы углеводородов и назвать их по международной номенклатуре.
Суффиксы в названии углеводородов указывают на наличие кратной связи:
ан одинарная связь между атомами углерода (С 
ен двойная связь между атомами углерода (С = С);
ин тройная связь между атомами углерода (С 
диен две двойных связи между атомами углерода (С = С 
Пример. Составьте модель молекулы пропана.
Молекула пропана C 3 H 8 содержит три атома углерода и восемь атомов водорода. Атомы углерода соединены между собой. Суффикс – ан указывает на наличие одинарной связи между атомами углерода. Атомы углерода располагаются под углом 109 
Молекула имеет форму пирамиды. Атомы углерода изображайте черными кругами, а атомы водорода – белыми, атомы хлора – зелеными.
При изображении моделей соблюдайте соотношение размеров атомов.
Молярную массу находим, пользуясь периодической таблицей
Что бы назвать углеводород надо:
Выбрать самую длинную цепочку.
Пронумеровать, начиная с того края, к которому ближе радикал или кратная связь.
Указать радикал, если радикалов несколько указывают каждый. (Цифра перед названием).
Назвать радикал, начиная с меньшего радикала.
Назвать самую длинную цепочку.
Указать положение кратной связи. (Цифра после названия).
При составлении формул по названию надо:
Определить число атомов углерода в цепочке.
Определить положение кратной связи. (Цифра после названия).
Определить положение радикалов. (Цифра перед названием).
Записать формулы радикалов.
В последнюю очередь определить количество и расставить атомы водорода.
Массовая доля элемента определяется по формуле:


n – число атомов химического элемента;
Ar – относительная атомная масса химического элемента;
Mr – относительная молекулярная масса.
При решении задачи примените формулы расчета:
Оборудование : Набор шаростержневых моделей молекул, пластилин разных цветов, спички, таблица “Предельные углеводороды”, периодическая таблица. Индивидуальные задания.
Ход работы. Выполнение заданий по вариантам.
Задание №1 . Составьте модели молекул: а) бутана, б) циклопропана. Зарисуйте модели молекул в тетради. Напишите структурные формулы этих веществ. Найдите их молекулярные массы.
Задание №2. Назовите вещества:
Задание №3. Составьве структтурные формулы веществ:
Задание №4. Решите задачи:
Задача 1 Определить массовую долю углерода и водорода в метане.
Задача 2. Сажа применяется для производства резины. Определить сколько г сажи (С) можно получить при разложении 22 г пропана?
Задание №1 . Составьте модели молекул: а) 2-метилпропана, б) циклобутана. Зарисуйте модели молекул в тетради. Напишите структурные формулы этих веществ. Найдите их молекулярные массы.
Задание №2. Назовите вещества:
Задание №3 Составьве структурные формулы веществ:
а) 2-метилбутен-1, напишите его изомер;
б) пропин.
Задание №4. Решите задачи:
Задача 1. Определить массовую долю углерода и водорода в этилене.
Задача 2. Сажа применяется для производства резины. Определить массу сажи (С), которую можно получить при разложении 36г пентана?
Задание №1 . Составьте модели молекул: а) 1,2-дихлорэтана, б) метилциклопропана
Зарисуйте модели молекул в тетради. Напишите структурные формулы этих веществ. Определите во сколько раз дихлорэтан тяжелее воздуха?
Задание №2. Назовите вещества:
Задание №3. Составьве структурные формулы веществ:
а) 2-метилбутен-2 напишите его изомер;
б) 3,4-диметилпентин-1.
Задание №4. Решите задачи:
Задача 1. Найти молекулярную формулу вещества, содержащего 92,3% углерода и 7,7% водорода. Относительная плотность по водороду равна 13.
Задача 2. Какой объем водорода выделится при разложении 29 г бутана (н.у.)?
Задание №1 . Составьте модели молекул: а) 2,3-диметилбутана, б) хлорциклопропана. Зарисуйте модели молекул в тетради. Напишите структурные формулы этих веществ. Найдите их молекулярные массы.
Задание №2. Назовите вещества
Задание №3. Составьве структурные формулы веществ:
а) 2-метибутадиентен-1,3; напишите изомер.
б) 4-метилпентин-2.
Задание №4. Решите задачи:
Задача 1. Найти молекулярную формулу вещества, содержащего 92,3% углерода и 7,7% водорода. Относительная плотность по водороду равна 39.
Задача 2. Какой объем углекислого газа выделится при полном сгорании 72 г автомобильного топлива, состоящего из пропана?
§ 2. Теория строения органических соединений А. М. Бутлерова
Органическая химия как наука оформилась в начале XIX в. Первая теория в органической химии — теория радикалов. Химиками было обнаружено, что при химических превращениях группы из нескольких атомов в неизменном виде переходят из молекулы одного вещества в молекулу другого вещества, подобно тому как переходят из молекулы в молекулу атомы элементов. Такие «неизменяемые» группы атомов и получили название радикалов.
Однако далеко не все учёные были согласны с теорией радикалов. Многие вообще отвергали идею атомистики — представления о сложном строении молекулы и существовании атома как её составной части. То, что неоспоримо доказано в наши дни и не вызывает ни малейших сомнений, в XIX в. было предметом ожесточённых споров.
Теорию радикалов сменила теория типов, в соответствии с которой предполагалось, что реакции органических веществ сходны с реакциями простейших неорганических соединений. Основоположник этой теории Ш. Жерар предложил разделить органические вещества на группы, близкие по своему типу к воде, хлороводороду, аммиаку и т. д. Во многих случаях одно и то же соединение изображали десятками типических формул. По мере накопления экспериментального материала теория типов зашла в тупик.
Потерпело поражение и учение о витализме, которое, как вы уже знаете, не устояло перед достижениями практической химии.
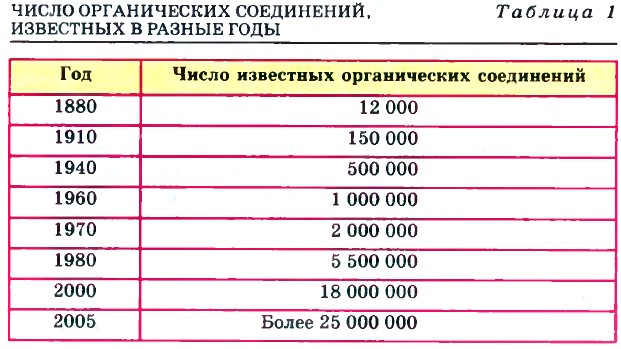
Органическая химия накапливала всё больше фактов о соединениях углерода, число которых постоянно росло (табл. 1).
Объяснить причины многообразия органических веществ учёные не могли. Ещё больше вопросов вызывало существование изомеров. Эти вещества имели совершенно одинаковый состав, но проявляли при этом разные физические и химические свойства. Уже известный вам Ф. Вёлер в одном из писем Й. Я. Берцелиусу так описывал органическую химию того времени: «Органическая химия может сейчас кого угодно свести с ума. Она кажется мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть. »
Большое влияние на развитие химии в это время оказали работы английского химика Э. Франкланда, который, опираясь на идеи атомистики, в 1853 г. ввёл понятие «валентность». Однако валентность углерода во многих соединениях, например в этане С2Н6 и пропане С3Н8, вызывала ещё больше вопросов. В 1857 г. немецкий химик Ф. А. Кекуле отнёс углерод к четырёхвалентным элементам, а в 1858 г. он одновременно с шотландским химиком А. Купером (1831—1892) отметил, что атомы углерода способны соединяться друг с другом в различные цепи.
Однако за уже установленными фактами и частными выводами и Франкланд, и Кекуле не увидели общей концепции. Оставался открытым вопрос, как определять строение молекулы. Была необходима научная теория органических соединений. Такая теория была создана русским учёным Александром Михайловичем Бутлеровым. Именно его пытливый ум «осмелился проникнуть» в «дремучий лес» органической химии и начать преобразования этой «безграничной чащи» в залитый солнечным светом регулярный парк с системой дорожек и аллей.
Основные идеи новой теории впервые были высказаны Бутлеровым в 1861 г. в докладе «О химическом строении веществ» на съезде немецких естествоиспытателей и врачей в г. Шпейере.
Тест с ответами на тему: “Органическая химия”
1. Понятие «органическая химия» ввёл:
а) Антуан Лоран Лавуазье
б) Йёнс Берцелиус +
в) Фридрих Вёлер
2. Вклад Александра Бутлерова в органическую химию:
а) синтезировал мочевину, развеяв миф, что органические соединения нельзя синтезировать +
б) выявил, что получаемые из живых организмов вещества содержат углерод, водород, кислород, азот
в) разработал теорию химического строения
3. Количество органических веществ во всем мире:
а) 121 миллион
б) 141 тысяча
в) 141 миллион +
4. Структурные изомеры это:
а) соединения, отличающиеся химическим строением, но имеющие одинаковый качественный и количественный состав +
б) соединения, отличающиеся химическим строением, качественным и количественным составом
в) соединения, отличающиеся качественным и количественным составом, но имеющие одинаковое химическое строение
5. В состав органических веществ входят:
а) сера
б) фосфор
в) все перечисленные +
6. К углеводам относятся:
а) спирты
б) арены +
в) сложные эфиры
7. Нуклеиновые кислоты относятся к:
а) кислородсодержащим
б) азотсодержащим
в) фосфорорганическим +
8. Соединения, имеющие замкнутую, неоткрытую цепь атомов:
а) циклические +
б) ациклические
в) насыщенные
9. Алканы классифицируются как:
а) насыщенные алифатические соединения +
б) ненасыщенные алифатические соединения
в) карбоциклические алициклические соединения
10. Органические вещества, структурные циклы которых образуют только атомы углерода:
а) предельные
б) непредельные
в) карбоциклические +
11. C7H8 относится к:
а) алканы +
б) алкены
в) алкины
12. Наименее полярная связь у:
а) углерод и водород
б) углерод и углерод +
в) углерод и фтор
13. Формулы, которые показывают порядок соединения атомов в молекуле:
а) структурные +
б) молекулярные
в) эмпирические
14. Органическая химия состоит из соединений:
а) азота
б) кислорода
в) углерода +
15. Укажите органическое вещество:
а) CO2
б) CH4 +
в) Na2CO3
16. В настоящее время насчитывается органических веществ:
а) около 10 млн
б) около 5 млн
в) более 25 млн +
17. Валентности углерода в пропане С3Н8:
а) IV +
б) IV и III
в) IV и II
18. Сахаристые вещества из формальдегида впервые получил:
а) Бертло
б) Кекуле
в) Бутлеров +
19. Кто впервые установил, что углерод в органических соединениях всегда четырехвалентен:
а) Вёлер
б) Кальбе
в) Кекуле +
20. Верны ли суждения?
А. Органические вещества горючи.
Б. Органические вещества не разлагаются при нагревании.
а) верно только А +
б) верно только Б
в) верны оба суждения
21. Верны ли суждения?
А Органические вещества имеют, как правило, высокие температуры плавления.
Б. Органические вещества имеют, как правило, молекулярную кристаллическую решетку.
а) верно только А
б) верно только Б +
в) оба суждения неверны
22. Верны ли суждения?
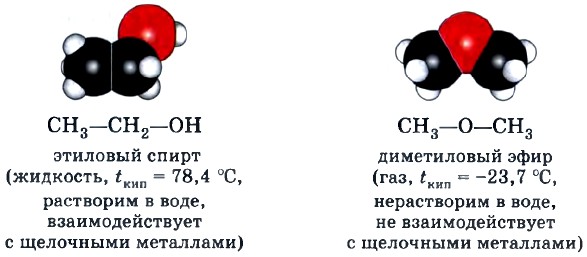
А. Этиловый спирт и диметиловый эфир имеют одинаковую молекулярную формулу С2Н6O.
Б. Одинаковую молекулярную формулу С6Н12O6 имеют и глюкоза, и сахароза.
а) верно только А +
б) верно только Б
в) верны оба суждения
г) оба суждения неверны
23. В каком ряду органических соединений находятся только углеводороды:
а) С2Н6, С4Н8, С2Н5ОН;
б) СН3СООН, С6Н6, СН3СОН;
в) С2Н2, С3Н8, С17Н36 +
24. Общую формулу CnH2n имеет следующее соединение:
а) бензол
б) циклогексан +
в) гексан
26. Общая формула гомологов алкадиенов:
а) СnH2n+2
б) СnH2n
в) СnH2n-2 +
27. Каучук получают реакцией:
а) гидрогенизация
б) полимеризация +
в) изомеризация
28. Чем отличаются изомеры?
а) химическими свойствами
б) химической активностью +
в) физическими свойствами
29. Чем гомологи отличаются друг от друга?
а) числом атомов углерода +
б) химической структурой
в) качественным и количественным составом
30. Чем являются метаналь и формальдегид?
а) гомологами
б) структурными изомерами +
в) геометрическими изомерами
§ 2. Теория строения органических соединений
Подобно тому как в неорганической химии основополагающей теоретической базой являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, так в органической химии ведущей научной основой служит теория строения органических соединений Бутлерова—Кекуле—Купера.
Как и любая другая научная теория, теория строения органических соединений явилась результатом обобщения богатейшего фактологического материала, который накопила органическая химия, оформившаяся как наука в начале XIX в. Открывались все новые и новые соединения углерода, количество которых лавинообразно возрастало (табл. 1).
Объяснить это многообразие органических соединений ученые начала XIX в. не могли. Еще больше вопросов вызывало явление изомерии.
Например, этиловый спирт и диметиловый эфир — изомеры: эти вещества имеют одинаковый состав С2Н6O, но разное строение, т. е. различный порядок соединения атомов в молекулах, а потому и разные свойства.
Уже известный вам Ф. Вёлер в одном из писем к Й. Я. Берцелиусу так описывал органическую химию: «Органическая химия может сейчас кого угодно свести с ума. Она кажется мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть. »
Большое влияние на развитие химии оказали работы английского ученого Э. Франкланда, который, опираясь на идеи атомистики, ввел понятие валентность (1853).
В молекуле водорода Н2 образуется одна ковалентная химическая связь Н—Н, т. е. водород одновалентен. Валентность химического элемента можно выразить числом атомов водорода, которые присоединяет к себе или замещает один атом химического элемента. Например, сера в сероводороде и кислород в воде двухвалентны:
а азот в аммиаке трехвалентен:
В органической химии понятие «валентность» является аналогом понятия «степень окисления», с которым вы привыкли работать в курсе неорганической химии в основной школе. Однако это не одно и то же. Например, в молекуле азота N2 степень окисления азота равна нулю, а валентность — трем:
Обычно по отношению к ионным соединениям (хлорид натрия NaCl и многие другие неорганические вещества с ионной связью) не используют термин «валентность» атомов, а рассматривают их степень окисления. Поэтому в неорганической химии, где большинство веществ имеют немолекулярное строение, предпочтительнее применять понятие «степень окисления», а в органической химии, где большинство соединений имеют молекулярное строение, как правило, используют понятие «валентность».
Теория химического строения — результат обобщения идей выдающихся ученых-органиков из трех европейских стран: немца Ф. Кекуле, англичанина А. Купера и русского А. Бутлерова.
В 1857 г. Ф. Кекуле отнес углерод к четырехвалентным элементам, а в 1858 г. он одновременно с А. Купером отметил, что атомы углерода способны соединяться друг с другом в различные цепи: линейные, разветвленные и замкнутые (циклические).
Работы Ф. Кекуле и А. Купера послужили основой для разработки научной теории, объясняющей явление изомерии, взаимосвязь состава, строения и свойств молекул органических соединений. Такую теорию создал русский ученый А. М. Бутлеров. Именно его пытливый ум «осмелился проникнуть» в «дремучий лес» органической химии и начать преобразование этой «безграничной чащи» в залитый солнечным светом регулярный парк с системой дорожек и аллей. Основные идеи этой теории впервые были высказаны А. М. Бутлеровым в 1861 г. на съезде немецких естествоиспытателей и врачей в г. Шпейере.
Кратко сформулировать основные положения и следствия теории строения органических соединений Бутлерова—Кекуле—Купера можно следующим образом.
1. Атомы в молекулах веществ соединены в определенной последовательности согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи (линейные, разветвленные и циклические).
Органические соединения можно расположить в ряды сходных по составу, строению и свойствам веществ — гомологические ряды.
Нетрудно заметить, что для гомологических рядов можно вывести общую формулу ряда. Так, для алканов эта общая формула СnН2n + 2.
2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
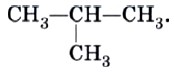
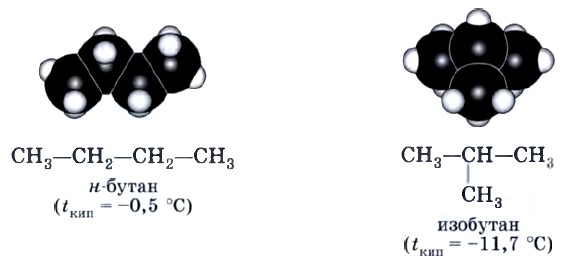
Это положение теории строения органических соединений объясняет явление изомерии. Очевидно, что для бутана С4Н10, помимо молекулы линейного строения СН3—СН2—СН2—СН3, возможно также и разветвленное строение:
Это уже совершенно новое вещество со своими индивидуальными свойствами, отличными от свойств бутана линейного строения.
Бутан, в молекуле которого атомы расположены в виде линейной цепочки, называют нормальным бутаном (н-бутаном), а бутан, цепь атомов углерода которого разветвлена, называют изобутаном.
Существует два основных типа изомерии — структурная и пространственная.
В соответствии с принятой классификацией различают три вида структурной изомерии.
Изомерия углеродного скелета. Соединения отличаются порядком расположения углерод-углеродных связей, например рассмотренные н-бутан и изобутан. Именно этот вид изомерии характерен для алканов.
Изомерия положения кратной связи (С=С, С=С) или функциональной группы (т. е. группы атомов, определяющих принадлежность соединения к тому или иному классу органических соединений), например:
Межклассовая изомерия. Изомеры этого вида изомерии относятся к разным классам органических соединений, например рассмотренные выше этиловый спирт (класс предельных одноатомных спиртов) и диметиловый эфир (класс простых эфиров).
Различают два вида пространственной изомерии: геометрическую и оптическую.
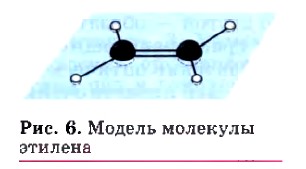
Геометрическая изомерия характерна, прежде всего, для соединений с двойной углерод-углеродной связью, так как по месту такой связи молекула имеет плоскостное строение (рис. 6). Например, для бутена-2, если одинаковые группы атомов у атомов углерода при двойной связи находятся по одну сторону от плоскости С=С-связи, то молекула является цисизомером, если по разные стороны — трансизомером.
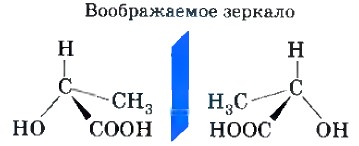
Оптической изомерией обладают, например, вещества, молекулы которых имеют асимметрический, или хиральный, атом углерода, связанный с четырьмя различными заместителями. Оптические изомеры являются зеркальным изображением друг друга, подобно двум ладоням, и не совместимы. (Теперь вам, очевидно, стало понятным второе название этого вида изомерии: греч. хирос — рука — образец несимметричной фигуры.) Например, в виде двух оптических изомеров существует 2-оксипропановая (молочная) кислота, содержащая один асимметрический атом углерода.
У хиральных молекул возникают изомерные пары, в которых молекулы изомеров относятся по своей пространственной организации одна к другой так же, как соотносятся между собой предмет и его зеркальное отображение. Пара таких изомеров всегда обладает одинаковыми химическими и физическими свойствами, за исключением оптической активности: если один изомер вращает плоскость поляризованного света по часовой стрелке, то другой — обязательно против. Первый изомер называют правовращающим, а второй — левовращающим.
Значение оптической изомерии в организации жизни на нашей планете очень велико, так как оптические изомеры могут существенно отличаться как по своей биологической активности, так и по совместимости с другими природными соединениями.
3. Атомы в молекулах веществ влияют друг на друга. Взаимное влияние атомов в молекулах органических соединений вы рассмотрите при дальнейшем изучении курса.
Современная теория строения органических соединений основывается не только на химическом, но и на электронном и на пространственном строении веществ, которое подробно рассматривается на профильном уровне изучения химии.
В органической химии широко используют несколько видов химических формул.
Молекулярная формула отражает качественный состав соединения, т. е. показывает число атомов каждого из химических элементов, образующих молекулу вещества. Например, молекулярная формула пропана: С3Н8.
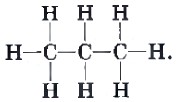
Структурная формула отражает порядок соединения атомов в молекуле согласно валентности. Структурная формула пропана такова:
Часто нет необходимости детально изображать химические связи между атомами углерода и водорода, поэтому в большинстве случаев используют сокращенные структурные формулы. Для пропана такую формулу записывают так: СН3—СН2—СН3.
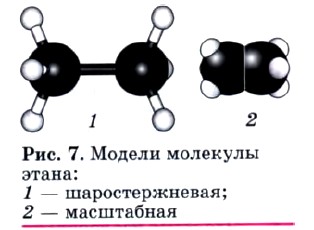
Строение молекул органических соединений отражают с помощью различных моделей. Наиболее известны объемные (масштабные) и шаростержневые модели (рис. 7).
1. Что такое валентность? Чем она отличается от степени окисления? Приведите примеры веществ, в которых значения степени окисления и валентности атомов численно одинаковы и различны.
2. Определите валентность и степень окисления атомов в веществах, формулы которых Сl2, СO2, С2Н6, С2Н4.
3. Что такое изомерия; изомеры?
4. Что такое гомология; гомологи?
5. Как, используя знания об изомерии и гомологии, объяснить многообразие соединений углерода?
6. Что понимают под химическим строением молекул органических соединений? Сформулируйте положение теории строения, которое объясняет различие в свойствах изомеров. Сформулируйте положения теории строения, которые объясняют многообразие органических соединений.
7. Какой вклад внес каждый из ученых — основоположников теории химического строения — в эту теорию? Почему ведущую роль в становление этой теории сыграл вклад русского химика?
8. Возможно существование трех изомеров состава С5Н12. Запишите их полные и сокращенные структурные формулы.
9. По представленной в конце параграфа модели молекулы вещества (см. рис. 7) составьте его молекулярную и сокращенную структурную формулы.