Умифеновир или нобазит что лучше
Противовирусные препараты при коронавирусе: факты и ответственное фармконсультирование
Коронавирус продолжает задавать тон продажам в аптеках. Повышенным спросом пользуются безрецептурные препараты, стимулирующие иммунитет. Это всем известные Арбидол, Ингавирин, Циклоферон, Кагоцел, Эргоферон, Трекрезан, Амиксин с собратьями, Триазавирин и другие. Эти ЛС приносят большую долю дохода, продаются легко, поскольку практически не требуют рекомендации: о них знают благодаря рекламным кампаниям. А еще очень удобно, что эти препараты, согласно инструкциям, помогают бороться против всего спектра вирусов гриппа и ОРВИ. Суть действия такова: надо активировать иммунитет, и организм справится с вирусами, в том числе и с вирусом SARS-CoV-2. Логично. Но так ли это на самом деле?
Как говорится, в медицинской науке не должно быть мнений, а должны быть факты. Поэтому мы собрали фактическую информацию по тройке активно продаваемых лекарств из этой группы.
Умифеновир
Согласно инструкции к действующему веществу препарат способен подавлять коронавирус (SARS-CoV), ассоциированный с тяжелым острым респираторным синдромом (ТОРС) in vitro. Вирус SARS-CoV, вызывающий ТОРС, хоть и происходит из одного семейства с вирусом SARS-CoV-2, но является самостоятельным представителем.
Недавнее ретроспективное исследование, проведенное в китайской больнице Цзиньитан, не показало связи применения умифеновира с улучшением результатов лечения COVID-19.
Индийская компания Glenmark Pharmaceuticals объявила о результатах своего исследования с участием препарата умифеновир: добавление умифеновира к терапии фавипиравиром не показало лучших клинических результатов. В исследование было включено 158 госпитализированных пациентов с COVID-19 средней степени тяжести.
В настоящий момент умифеновир единственный из всех представителей группы входит во временные методические рекомендации Минздрава по профилактике, диагностике и лечению новой коронавирусной инфекции с оговоркой о невозможности сделать однозначный вывод об эффективности или неэффективности умифеновира и других этиотропных средств.
В сухом остатке: имеющихся исследований умифеновира недостаточно для оценки его эффективности в отношении вируса SARS-CoV-2.
Витаглутам
С таким действующим веществом зарегистрирован препарат Ингавирин. Вышедшая во время пандемии реклама акцентировала внимание на эффективности препарата против коронавируса. В самой инструкции препарата видим, что препарат показал эффективность по отношению к коронавирусу в доклинических исследованиях.
В адрес Минздрава, ФАС РФ и компании-производителя в мае направлен запрос по уточнению доказательной базы и комментариев по вышеизложенному. Ответы пока не опубликованы.
В сухом остатке: клинические исследования данного препарата по его применению для профилактики и лечения COVID-19 пока не заявлялись.
Кагоцел
В отличие от первых двух препаратов слово коронавирус в инструкции к нему не упоминается.
Имеются данные эксперимента, проведенного в ФГБУ «48 Центрaльный нaучно-исследовaтельский институт» Министерствa обороны Российской Федерaции по изучению противовирусной активности кагоцела in vitro. При внесении субстанции в культуру клеток показано стопроцентное подавление цитопатической активности вируса SARS-CoV-2, а также подавление репродукции вируса. Результаты опубликованы в научном журнале «Антибиотики и химиотерапия» в 2020 году. Для исследования противовирусной активности препарата в отношении SARS-CoV-2 исследователи обещают дальнейшие клинические исследования на пациентах.
В сухом остатке: необходимой доказательной базы, которая могла бы послужить основанием для использования препарата Кагоцел для профилактики и лечения COVID-19 на сегодняшний день также нет.
Адекватное фармконсультирование
Напомним: пациентам с подтвержденным диагнозом COVID-19 назначать терапию должен врач. В качестве профилактики основными рекомендованными мерами остаются гигиенические: ограничение контактов, ношение масок, социальная дистанция и т.д. Ожидается введение в гражданский оборот двух зарегистрированных вакцин. Методические рекомендации Минздрава допускают применение рекомбинантного интерферона альфа2b интраназально отдельно или в комбинации с умифеновиром для медикаментозной профилактики инфицирования вирусом COVID-19
Отвечаем на вопросы в прямых эфирах Вконтакте: https://vk.com/pharmznanie
Обсудить последние новости со всеми коллегами России вы можете в чатах:
Современные препараты для лечения ОРВИ и гриппа
Острые респираторные инфекции (ОРВИ) являются наиболее распространенными среди всех инфекционных заболеваний. На долю ОРВИ, а также гриппа приходится не менее 70% инфекционных заболеваний. В России ежегодно регистрируется около
Острые респираторные инфекции (ОРВИ) являются наиболее распространенными среди всех инфекционных заболеваний. На долю ОРВИ, а также гриппа приходится не менее 70% инфекционных заболеваний. В России ежегодно регистрируется около 50 млн инфекционных заболеваний, из которых до 90% случаев приходится на ОРВИ и грипп.
Почти 90% населения как минимум один раз в году переносят одну из респираторных инфекций вирусной этиологии, что в целом предопределяет высокую заболеваемость и даже влияет на показатель смертности [2].
Столь высокая частота заболеваний респираторного тракта объясняется многообразием этиологических факторов (вирусы гриппа, парагриппа, аденовирусы, риновирусы, реовирусы, респираторно-синцитиальные (РС) вирусы, микоплазмы, хламидии, бактериальные агенты), а также легкостью передачи возбудителя и высокой изменчивостью вирусов.
Дифференциальная диагностика гриппа и ОРВИ затруднена из-за сходства клинической картины этих заболеваний, но вполне возможна. Основными отличиями можно считать начальные признаки заболевания, симптомы интоксикации, характер катаральных явлений и лихорадки, тип развивающихся осложнений и др. Клинический диагноз, подтвержденный данными лабораторных анализов, и определяет выбор терапии.
Клиническая картина ОРВИ и гриппа зависит от вируса-возбудителя (см. таблицу).
Следует отметить, что осложнения при ОРВИ, особенно в период эпидемии, регистрируются в 20–30% случаев. Основными причинами осложнений являются нарушения иммунной защиты, приводящие к длительной недостаточности в работе иммунной системы. Снижение антибактериальной резистентности организма приводит к затяжным периодам реконвалесценции и обусловливает возможность осложнений в течение длительного времени. Особое место среди осложнений занимает так называемый синдром послевирусной астении (СПА), который может развиваться у 65% больных в течение 1 мес от начала заболевания. Ведущими симптомами СПА являются усталость, эмоциональные нарушения и различные психические расстройства.
Круг препаратов, используемых при лечении ОРВИ и гриппа, широк и разнообразен. Он включает живые и инактивированные вакцины, химиопрепараты этиотропного действия, а также средства, применяющиеся для иммунокорригирующей и патогенетической терапии.
Тем не менее течение гриппа и других ОРВИ по-прежнему плохо поддается контролю. Это связано не только с полиэтиологичностью данных заболеваний, но и с уникальной изменчивостью вирусов и глобальным характером эпидемий. Распространение ОРВИ в значительной степени зависит от экологической, социально-экономической ситуации, наличия у пациентов аллергических заболеваний и ряда других факторов.
Противовирусные препараты
Химиопрепараты
Механизм действия этой группы препаратов основан на избирательном подавлении отдельных звеньев репродукции вирусов, без нарушения жизнедеятельности клетки макроорганизма. При респираторных инфекциях используются две группы препаратов — блокаторы М2-каналов и ингибиторы нейроаминидазы, а также рибавирин, активный против РС-вируса.
Блокаторы М2-каналов
В 1961 г. был синтезирован симметричный амин — амантадин, а затем и ряд его производных (римантадин, мидантан, дейтифорин). В нашей стране получил широкое применение римантадин, который используется для лечения и профилактики гриппа, вызванного вирусом типа А. Эффективность этого средства составляет 70–90%.
Противовирусный эффект реализуется путем блокирования особых ионных каналов (М2) вируса, что сопровождается нарушением его способности проникать в клетки и высвобождать рибонуклеопротеид. Тем самым ингибируется важнейшая стадия репликации вирусов. Примерно в 30% случаев может развиваться резистентность к римантадину [6].
Римантадин выпускается в форме ремантадина в таблетках по 50 мг и сиропа для детей от 1 до 7 лет альгирем—2 мг/мл. С лечебной целью препарат назначается с момента регистрации первых симптомов. Длительность терапии не должна превышать 5 дней во избежание появления резистентных форм вируса. Профилактически римантадин необходимо принимать не менее 2 нед.
Ингибиторы нейроаминидазы
Препараты этой группы эффективны не только против вирусов гриппа типа А, но и против вирусов типа В.
Нейроаминидаза (сиалидаза) — один из ключевых ферментов, участвующих в репликации вирусов гриппа. При ингибировании нейроаминидазы нарушается способность вирусов проникать в здоровые клетки, снижается их устойчивость к защитному действию секрета дыхательных путей и таким образом тормозится дальнейшее распространение вируса в организме. Ингибиторы нейроаминидазы способны уменьшать продукцию цитокинов (ИЛ-1 и фактора некроза опухоли), препятствуя развитию местной воспалительной реакции и ослабляя такие системные проявления вирусной инфекции, как лихорадка, боли в мышцах и суставах, потеря аппетита [7].
Предварительные исследования показали, что эффективность такого ингибитора в качестве профилактического средства составляет 70–80%. Прием этих препаратов позволяет сократить длительность болезни на 1–1,5 дней (если препарат начать принимать не позднее, чем через 36–48 ч с момента появления первых симптомов). В начале заболевания и на ранних его стадиях средняя продолжительность репликации вируса сокращается в среднем на 3 дня, а число тяжелых форм ОРВИ и гриппа, характеризующихся повышенной температурой, — на 85%. Препараты не оказывают вредного воздействия на центральную нервную систему. Однако следует отметить, что далеко не всегда представляется возможность их применения в первые 48 ч: из-за сложностей, связанных с дифференциальной диагностикой гриппа и других ОРВИ.
Представителями ингибиторов нейроаминидазы являются озельтамивир и занамивир.
Озельтамивир (тамифлю) назначается по 75–150 мг 2 раза в день в течение 5 дней. Для профилактики — по 75 мг 1 или 2 раза в день в течение 4–6 нед. У пациентов с клиренсом креатинина менее 30 мл/мин доза снижается в 2 раза.
Занамивир (реленца) является структурным аналогом сиаловой кислоты — естественного субстрата нейроаминидазы вирусов гриппа — и, следовательно, обладает способностью конкурировать с ней за связывание с активным центром. Ингалируется с помощью специального устройства — дискхалера. С лечебной целью назначается по 10 мг 2 раза в день (с интервалом 12 ч) в течение 5 дней, для профилактики — по 10 мг 1 раз в день в течение 4–6 нед. Ингаляционный способ введения имеет преимущество, так как обеспечивает достаточно быстрый противовирусный эффект в зоне первичного очага инфекции.
Побочные реакции данной группы препаратов составляют не более 1,5% случаев. Чаще всего это головная боль, головокружение, тошнота, диарея, явления синусита. У пациентов с обструктивными бронхолегочными заболеваниями возможно развитие бронхоспазма.
Препараты, активные против других вирусов
Рибавирин (виразол, ребетол), действующий на многие РНК- и ДНК-содержащие вирусы, в аэрозольной лекарственной форме используется при лечении инфекций, вызванных РС-вирусом. Предполагается, что препарат ингибирует ранние этапы вирусной транскрипции, нарушая синтез рибонуклеопротеидов, информационной РНК, блокируя РНК-полимеразу. Применяется ингаляторно с помощью небулайзера только в условиях стационара.
При приеме рибавирина могут отмечаться бронхоспазм, сыпь, раздражение глаз, причем не только у пациентов, но и у медперсонала. В редких случаях наблюдаются лейкопения, бессонница, раздражительность. Существует риск кристаллизации препарата в дыхательных путях и интубационных трубках. Обладает тератогенным действием.
Перспективным противовирусным препаратом является недавно разработанный в США пленоконарил. В исследованиях in vitro и в экспериментах на животных выявлена его активность против энтеровирусов и риновирусов. Данные первых плацебо-контролируемых исследований свидетельствуют об эффективности препарата при респираторных инфекциях и энтеровирусном менингите [8].
В России применяются оригинальные противовирусные препараты, созданные на основе отечественных разработок. Наиболее широко известный из них — арбидол. Он оказывает ингибирующее действие на вирусы гриппа типа А и В и другие респираторные вирусы, механизм которых до конца не выяснен. Предполагают, что подобное воздействие связано и с интерферониндуцирующими и с иммуномодулирующими свойствами препарата. В частности, арбидол стимулирует активность фагоцитарных клеток. Выпускается в таблетках по 0,1 г. В лечебных целях назначается по 0,2 г 3–4 раза в день в течение 3–5 дней. С профилактической целью применяется по 0,2 г/сут в течение 10–14 дней.
Интерфероны
Интерфероны (ИФН) относятся к числу регуляторов иммуногенеза. Они продуцируются различными клетками и не только реализуют противовирусный ответ, но и регулируют иммунологические реакции. Основные эффекты интерферонов можно подразделить на антивирусные, антимикробные, антипролиферативные, иммуномодулирующие и радиопротективные.
Несмотря на разнообразие генетического материала вирусов, ИФН подавляют их репродукцию на стадии, обязательной для всех вирусов: они блокируют начало трансляции, т. е. синтез вирусспецифических белков. Этим можно объяснить универсальность антивирусного действия интерферона. Под воздействием интерферона в организме усиливается активность естественных киллеров, Т-хелперов, цитотоксических Т-лимфоцитов, фагоцитарная активность, интенсивность дифференцировки В-лимфоцитов, экспрессия антигенов МНС I и II типа [1].
Для лечения вирусных инфекций применяются α- и β-интерфероны. Хороший эффект при лечении дает комбинированное применение химиопрепаратов и препаратов ИФН.
β-интерферон (бетаферон) выпускается в форме порошка, во флаконах, содержащих по 9,5 млн ЕД ИФН. При гриппе его закапывают или распыляют в носовые ходы не менее 4–5 раз в сутки [2].
Человеческий лейкоцитарный интерферон представляет собой смесь интерферонов, синтезируемых лейкоцитами донорской крови в ответ на воздействие вирусного индуктора. Препарат вводят ингаляторно или закапывают в носовые ходы водный раствор, приготавливаемый из сухого вещества в ампуле или флаконе.
Виферон — рекомбинантный интерферон-α 2b — выпускается в форме ректальных свечей и применяется при лечении ОРВИ и гриппа. Повреждение клеточных мембран, наблюдаемое в ходе развития инфекционного процесса, является причиной снижения противовирусной активности интерферона. Токоферола ацетат и аскорбиновая кислота, входящие в состав виферона, являются мембраностабилизирующими компонентами, антиоксидантами, в сочетании с которыми противовирусная активность рекомбинантного интерферона-α 2b возрастает в 10–14 раз [1].
Особенности введения лекарственной формы обеспечивают длительную циркуляцию в крови интерферона-α 2b.
Препарат применяется как у новорожденных детей, так и у взрослых больных при ОРВИ и гриппе в возрастных дозировках. Детям до 7 лет назначается виферон-1, детям старше 7 лет и взрослым — виферон-2.
Индукторы интерферона
Амиксин — низкомолекулярный синтетический индуктор эндогенного интерферона ароматического ряда, относящийся к классу флуоренонов. Основными структурами, продуцирующими интерферон в ответ на введение амиксина, являются клетки эпителия кишечника, гепатоциты, Т-лимфоциты, гранулоциты. В лейкоцитах человека амиксин индуцирует образование интерферона, уровень в крови которого составляет 250 ЕД/мл. После приема амиксина внутрь максимум интерферона у человека определяется последовательно в кишечнике, печени, крови через 4–24 ч [2].
При лечении гриппа и ОРВИ амиксин назначается в первые часы заболевания, на курс достаточно 5–6 таблеток. С целью профилактики назначается 1 раз в неделю в течение 4–6 нед.
Циклоферон быстро проникает в кровь. Отмечается низкое связывание его с белками крови и в то же время широкое распространение в различных органах, тканях, биологических жидкостях организма.
Ввиду того что циклоферон является низкомолекулярным препаратом, он легко преодолевает гематоэнцефалический барьер, вызывая образование ИФН в мозге. Циклоферон быстро выводится из организма: 99% введенного препарата элиминируется почками в неизмененном виде в течение 24 ч.
Циклоферон хорошо переносится больными и назначается с первого дня от начала заболевания в виде таблетированной формы или парентерально [4].
Ридостин — высокомолекулярный индуктор ИФН природного происхождения. Ридостин представляет собой двуспиральную РНК, полученную из лизата киллерных дрожжей Saccharamyces cervisiae.
Системное введение ридостина стимулирует продукцию раннего ИФН. Максимальное накопление ИФН в сыворотке отмечается через 6–8 ч после инъекции; через 24 ч в кровотоке не определяется [1].
Препарат проявляет выраженный иммуномодулирующий эффект. Он стимулирует Т-клеточное и гуморальное звенья иммунитета, пролиферацию стволовых клеток костного мозга и фагоцитарную активность макрофагов и нейтрофилов периферической крови. Ридостин повышает уровень кортикостероидных гормонов; применяется для лечения и профилактики гриппа и других ОРВИ.
В настоящее время незаслуженно забывают препарат дибазол, применяемый для лечения и профилактики гриппа и ОРВИ. Дибазол обладает иммуномодулирующей активностью и индуцирует выработку эндогенного интерферона. Для профилактики назначается по 1 таблетке (0,02–0,05 г) 1 раз в день — 3–4 нед, для лечения — по 1 таблетке 3 раза в день — 5 дней.
Незаменимы в лечении гриппа и ОРВИ такие комплексные препараты, как гриппостад, ринза, терафлю, фервекс, а также препараты для наружного и местного применения — мазь от простуды доктор Мом, туссамаг бальзам от простуды.
Несмотря на многообразие препаратов, представленных для лечения ОРВИ и гриппа на современном этапе, выбор лекарственного препарата остается актуальной задачей для практикующего врача. Выбор тактики назначения и ведения больного с ОРВИ или гриппом напрямую связан с тяжестью течения инфекционного процесса, формой заболевания и наличием осложнений. Успех лечения зависит от правильной оценки состояния больного и раннего начала лечения.
О. А. Мельников, кандидат медицинских наук
Л. В. Аверкиева
«ГУТА-Клиник», Москва
Иллюзия уверенности
Иллюзия уверенности
Автор
Редактор
Вопрос об эффективности ингибиторов нейраминидазы до сих пор не имеет внятного ответа, несмотря на то, что эти препараты — чуть ли не единственная зарекомендовавшая себя сегодня эффективная терапия для больных гриппом. Тем не менее научная журналистика относится к данному факту весьма скептически: все ждут новых исследований, однако, на мой взгляд, даже «старых» вполне достаточно, чтобы усомниться в общепринятой точке зрения.
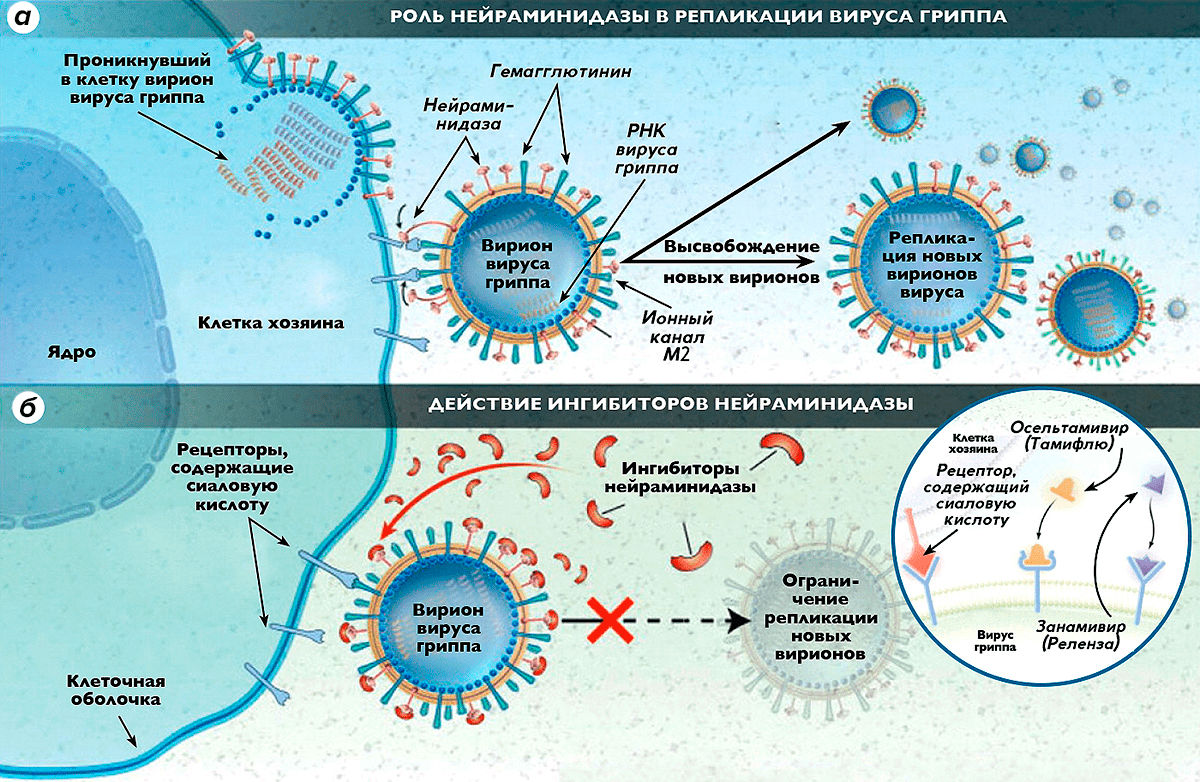
Нейраминидаза — один из ключевых ферментов, участвующих в репликации вирусов гриппа типов А и В (рис. 1) [1], [2]. Ингибиторы нейраминидазы, как утверждают производители, пресекают возможность проникновения этих вирусов в здоровые клетки, тормозят их выход из инфицированной клетки и снижают устойчивость к инактивирующему действию слизистого секрета дыхательных путей, содержащего иммуноглобулин А (IgA) [3]. Cуществует несколько веществ, обладающих подобными свойствами: осельтамивир («Тамифлю»), занамивир («Реленза»), перамивир и ланинамивир. Если доверять лабораторным тестам, то применение этих препаратов на ранней стадии заболевания должно как минимум сократить время течения болезни и снизить процент осложнений. Однако выводы многих исследований не столь оптимистичны.
Рисунок 1. Роль нейраминидазы в репликации вируса гриппа и действие ингибиторов нейраминидазы. а — В наружной липидной оболочке вириона вируса гриппа типа А имеются 3 основных белка (гемагглютинин, нейраминидаза и ионный канал М2), играющих основную роль в инфекционном процессе. Шипчики гемагглютинина объединяются с рецепторами восприимчивой клетки хозяина, связываясь с сиаловой кислотой, входящей в состав этих рецепторов. Нейраминидаза отщепляет концевые группы клеточных рецепторов, содержащих сиаловую кислоту, в результате чего клетка теряет способность распознавать антиген, и вирус проникает внутрь нее. Далее в клетке хозяина происходит сборка новых вирионов вируса, которые при помощи нейраминидазы выходят из поврежденной клетки, разносясь с кровотоком и заражая новые клетки. б — Ингибиторы нейраминидазы нарушают способность вирусов гриппа проникать в здоровые клетки, блокируют действие нейраминидазы внутри клетки хозяина, делая невозможным высвобождение из нее новых поколений вирионов вируса гриппа и, соответственно, препятствуя заражению новых клеток.
Каковы альтернативы?
Исследования этих препаратов делятся на два лагеря: доказавшие эффективность и доказавшие бесполезность. И тех, и других немало. Например, компания Roche — производитель всемирно известного противовирусного препарата «Тамифлю» (осельтамивир) — имеет в своем распоряжении более 70 (спонсируемых ей) клинических испытаний осельтамивира, доказавших его эффективность. Одно из них — рандомизированное контролируемое исследование 2000 года [4] — показало, что ранний прием этого препарата (в течение 36 часов после начала заболевания) способствовал сокращению длительности болезни в среднем на 30%, а степени тяжести — на 38%. Мало того, авторы заключили, что лечение осельтамивиром также будет уменьшать и частоту вторичных осложнений. А между тем уже в 1999 году было известно, что он «снижает длительность гриппозных заболеваний в среднем на 1,3 дня», и директор отдела противовирусных препаратов Управления по санитарному надзору за продуктами и лекарственными средствами США (FDA), доктор Хайди М. Джолсон, описывала его эффективность как весьма «скромную» [5]. Тем не менее осельтамивир не только получил одобрение FDA, но и был внесен ВОЗ сначала в список рекомендованных препаратов, а в 2010 году получил статус «жизненно важного лекарства» [6]. Правда, в 2017 году эксперты ВОЗ перенесли его из основного списка в дополнительный, рекомендовав только для госпитализированных пациентов с тяжелым течением гриппа [7], однако этот факт не умаляет признания его терапевтических свойств.
Обычно цитируют только эту строчку, однако далее в документе доктор Джолсон выражает уверенность, что «сокращение среднетяжелой и тяжелой симптоматики заболевания, включая лихорадку, даже на 1 день может иметь значительную клиническую пользу для многих пациентов. (. ) А в случаях тяжелого течения болезни, которые требуют более серьезной терапии, нежели стандартные методы, одобрение осельтамивира даст больному возможность получить эффективное и безопасное лечение» [5].
Тем не менее, кроме ингибиторов нейраминидазы, существуют и другие медикаменты: ингибиторы ионного канала М2 — римантадин и амантадин, — которые еще 15 лет назад широко применяли против вирусов гриппа типа А (тип В не имеет канала М2). Однако сейчас они малоэффективны, так как вследствие широкомасштабного использования (особенно в Китае и России, в том числе в сельском хозяйстве) вирус гриппа развил к ним высокую устойчивость [3], [9]. Кроме того, перспективными считают препараты, воздействующие на гемагглютинин — особый белок, помогающий вирусу гриппа прикрепиться к рецепторам клетки человека [10]. Между прочим, к числу подобных лекарственных средств принадлежит и российский умифеновир («Арбидол»), механизм действия которого сейчас изучают в США [11]. Возможно, эти препараты в ближайшие годы затмят славу ингибиторов нейраминидазы.
Что касается прививок, то в виду высокой антигенной изменчивости циркулирующих штаммов вируса гриппа их эффективность меняется год от года. Например, по промежуточной оценке американских Центров по контролю и профилактике заболеваний (СDC), в США общая эффективность вакцины против гриппа зимой 2016–2017 составила 48%, при этом «вакцинация почти вдвое снизила риск обращения за амбулаторной медицинской помощью» [12].
Эффективно? Нет?
До сих пор ингибиторы нейраминидазы принято считать препаратами с недоказанной эффективностью, обладающими к тому же выраженными побочными эффектами, и многие адепты доказательной медицины уверены в их полной бесполезности. Доказательством этой точки зрения обычно служат выводы метаанализа независимой исследовательской организации Cochrane (бывшая The Cochrane Collaboration). Однако — и это самое странное — именно они окончательно запутывают дело.
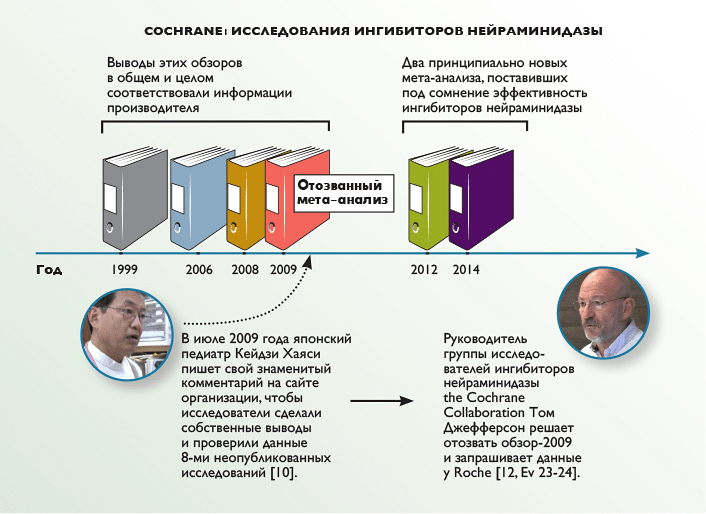
Эксперты из Cochrane анализировали ингибиторы нейраминидазы несколько раз (рис. 2), и до 2009 года их отчеты практически ничем не отличались от официальных выводов и информации Roche. Однако в 2009 году грянул гром: японский педиатр Кейдзи Хаяси усомнился в качестве их данных и провел собственное расследование.
Рисунок 2. Cochrane: исследования ингибиторов нейраминидазы.
Treatment trials with oseltamivir or zanamivir do not settle the question of whether the complications of influenza (such as pneumonia) are reduced, because of a lack of diagnostic definitions [15]. Мало того, в конце они замечают, что «если предполагать уровень заболеваемости гриппом в 2% (аналогичный тому, который был отмечен в группах, принимавших осельтамивир), для выявления 25-процентного клинически значимого сокращения пневмонии необходимо было исследовать 21 500 участников» [15]. При этом в исследованиях осельтамивира, включенных в обзор, участвовало всего 9623 пациента.
Забегая вперед, скажу, что эксперты из Cochrane, действительно, постарались сделать все возможное, чтобы в конце концов написать качественный отчет (который, кстати, в прессе поторопились окрестить самым «надежным и всеобъемлющим исследованием» противовирусных), но факт в том, что подходящего для анализа материала было недостаточно, и его качество (даже после строгого отбора) оставляло желать лучшего.
Тогда, в 2009 году, пообещав детально разобраться в ситуации, руководитель исследовательской группы ингибиторов нейраминидазы Cochrane — эпидемиолог Том Джефферсон поднял опубликованные материалы и с удивлением обнаружил, что оригиналы данных придется искать в архивах производителя. Тогда он обратился к Roche с просьбой предоставить необходимые материалы. Концерн долго артачился и даже предлагал Джефферсону подписать соглашение о неразглашении (тот, естественно, отказался), но в конце концов уступил и выслал семь небольших документов.
Однако к этому времени исследователи уже успели обнаружить, что существует 123 испытания осельтамивира, при этом 74 из них были в той или иной мере контролируемы производителем, а 23 вообще оказались неполными [16]. Поэтому в 2012 году они опубликовали «предварительный» отчет, для которого тщательным образом отобрали доступные на тот момент исследования, признав, что «не смогли получить полный набор клинических отчетов и данных от производителя, несмотря на то, что в период с июня 2010 года по февраль 2011 года было сделано пять запросов» [17]. Так что дело затянулось еще на два года, когда, наконец, получив документы от Roche и проверив все данные «на вшивость», Джефферсон отобрал для сравнительного анализа всего 20 исследований осельтамивира (9623 пациентов) и 26 занамивира (14 628 пациентов). На основании отобранной столь строгим образом информации он и сделал выводы о неэффективности ингибиторов нейраменидазы [15].
Критика «самого надежного» исследования
В пояснительной записке авторы обзора замечают, что они «не исключили» эти несостоятельные исследования (42 документа), а не «смогли их использовать», так как «не получили достаточной информации, чтобы определить их пригодность для включения в метаанализ» [16].
Исследовательская группа объяснила это решение следующим образом: «. мы рассматривали клинические исследования как основную единицу анализа, потому что отчеты о клинических исследованиях часто отправляются национальным регуляторам лекарственных средств (FDA и EMA), а эти организации требуют придерживаться более строгих стандартов полноты и точности отчетности, нежели биомедицинские журналы. Помимо поиска отчетов о клинических исследованиях, мы решили прочитать и просмотреть нормативную документацию» [15].
Что ж, эксперты Cochrane учли это замечание и в апреле 2014 года опубликовали обновленный метаанализ, включавший материалы, которые раньше были недоступны [15]. Но, по большому счету, и он — далеко не последняя точка в разговоре об эффективности ингибиторов нейраминидазы. И когда читаешь его размытые формулировки — «не было достаточно информации, чтобы сравнить эти эффекты», «гриппоподобное заболевание не может быть оценено из-за неполноты данных» [15], — создается впечатление, что либо у авторов действительно было недостаточно данных для более четких выводов, либо предоставленные материалы были крайне некачественными. Кстати, косвенно авторы в этом признаются, замечая, что «были отмечены проблемы в оформлении многих исследований, включенных в обзор, а это, в свою очередь, отразилось на уверенности в их результатах» [15].
И наконец, в метаанализе-2014 есть некоторые двусмысленные выводы. Например, было замечено, что «среди пациентов, принимавших осельтамивир, доля участников с четырехкратным увеличением титров антител была значительно ниже, чем в группе контроля», а «слабый иммунный ответ с низким уровнем провоспалительных цитокинов, вызванный действием препарата, уменьшал симптомы гриппа, не связанные с подавлением размножения (репликации) вируса» [15]. Скорее всего, авторы отнесли это к неблагоприятным эффектам, так как традиционно считается, что снижение активности иммунной системы — это плохо, потому что она должна бороться с инфекцией, но при этом они забывают об обратной связи: воздействии инфекции на иммунную систему. Мало того, они явно считают ингибиторы нейраминидазы иммуносупрессорами, игнорируя факт того, что для увеличения концентрации провоспалительных цитокинов важна репликация вируса [18] — соответственно, чем меньше вируса, тем меньше цитокинов. Таким образом, почему бы не рассмотреть низкий уровень цитокинов и снижение выработки антител через призму косвенного подтверждения эффективности данных препаратов (они быстро уменьшают вирусный титр, а это в свою очередь уменьшает количество цитокинов)?
Развивая теорию о негативном влиянии ингибиторов нейраминидазы на иммунную систему, авторы метаанализа-2014, в основном, ссылаются на три исследовательские работы: Скотта Фритца [18], Ребекки Кокс [19] и Мартина Мура [20]. Первые два исследования проведены на людях — 15 и 40 добровольцев соответственно; работа Мартина Мура [20] посвящена мышам и ингибированию внутриклеточной сиалидазы (гомолога вирусной нейраминидазы, которая, напротив, необходима Т-клеткам для выполнения антивирусных функций). Судя по всему, именно благодаря этому исследованию Том Джефферсон и его коллеги пришли к заключению, что ингибиторы нейраминидазы являются иммуносупрессорами и лишь ослабляют симптоматику, не оказывая влияния на сам вирус (кстати, по идее, это должно задерживать выздоровление и, возможно, влиять на осложнения, однако выводы метаанализа говорят об обратном). В общем, заразив мышей респираторно-синцитиальным вирусом (RSV), у которого отсутствует ген нейраминидазы, доктор Мур пришел к выводу, что «осельтамивир вызывает противовоспалительный эффект, ингибируя сиалидазу (. ) Т-клеток, которая способствует антивирусному иммунитету». При этом «если препарат также ингибирует сиалидазу человека (. ) есть основания предполагать, что он может продлить пролиферацию вируса, в котором отсутствует ген нейраминидазы» [20]. Тем не менее на каком основании эксперты из Cochrane предполагают, что при гриппе осельтамивир активно воздействует на сиалидазу [15]? Кроме того, данное исследование все-таки проводилось на мышах, и авторы не делают сенсационных заявлений, предлагая альтернативную интерпретацию своих результатов: «возможно, чувствительная к осельтамивиру сиалидаза действует на субстрат, отличный от GSL (гликосфинголипидов), для регуляции антивирусного иммунитета. Например, известно, что активированные Т-клетки обладают повышенной сиалидазной активностью, а также несут молекулы МНС I. В нашей экспериментальной системе лечение осельтамивиром не влияло на активность сиалидазы легочных мононуклеарных клеток, индуцированную вирусом RSV. Причины этого неясны, но могут быть связаны с относительно коротким периодом полураспада активной формы лекарственного средства» [20]. В целом, авторы резюмируют, что этот вопрос надо изучать.
Таких как IL-6, IL-10, IFN-γ, TNF-α, MIP-1α и −1β, MCP-1.
Ребекка Кокс [19] изучала влияние занамивира на иммунный ответ на противогриппозную вакцину. И это, наверное, единственное исследование, которое может косвенно говорить в пользу теории об иммуносупрессорном действии ингибиторов нейраминидазы. Его авторы отметили, что «группа плацебо показала более высокий антительный ответ к вирусу гриппа H1N1 после вакцинации» [19], однако на второй вакцинный штамм вируса гриппа типа А (H3N2) и к вирусу гриппа типа В обе группы ответили более-менее одинаково (авторы объясняют это тем, что молодые добровольцы были, скорее всего, инфицированы H1N1 в детстве, а «влияние занамивира на иммунный ответ может наблюдаться в ситуации относительно близкого антигенного соответствия между штаммом вакцины и оригинальным прайминг-вирусом» [19]). Так что никаких выводов об угнетении препаратом иммунной системы в исследовании нет, наоборот, в заключении написано, что «вакцинируемым во время эпидемии гриппа желательно проводить профилактику занамивиром в течение 12 дней, пока не разовьется полноценный иммунный ответ на антигены» [19]. В целом этот эффект малоизучен, точнее практически не изучен, так как работе Ребекки Кокс предшествовало всего одно подобное исследование [21], не отметившее, впрочем, разницы в иммунном ответе между исследуемыми группами, а более поздние аналогичные испытания, по всей видимости, не проводились. Получается, что и здесь для далеко идущих выводов о негативной роли ингибиторов нейраминидазы на иммунный ответ необходимы дальнейшие исследования на добровольцах из разных возрастных групп.
И еще кое-что про пониженные титры антител. Не удивительно, что в конечном итоге этот феномен сказывается на риске дальнейшего повторного заражения: Том Джефферсон и его коллеги отмечают, что снижение титров защитных антител у пациентов из групп лечения согласуется с данными испытаний на животных, показавших, что по сравнению с группой контроля, применение препарата у подопытных мышей привело к выделению недостаточного уровня секреторного иммуноглобулина IgA (а также подавлению индукции IgA-образующих клеток) на слизистой носа, но при этом не оказало значительного влияния на системный IgG-ответ [22]. А это может означать, что существует риск повторного заражения пациента, у которого вследствие терапии осельтамивиром выработался недостаточный иммунный ответ слизистой оболочки (IgA) [22]. Однако эти данные не указывают на отсутствие лечебного эффекта. Что же касается риска повторного заражения, то он может быть естественным процессом вследствие низкого уровня выработанных защитных антител.
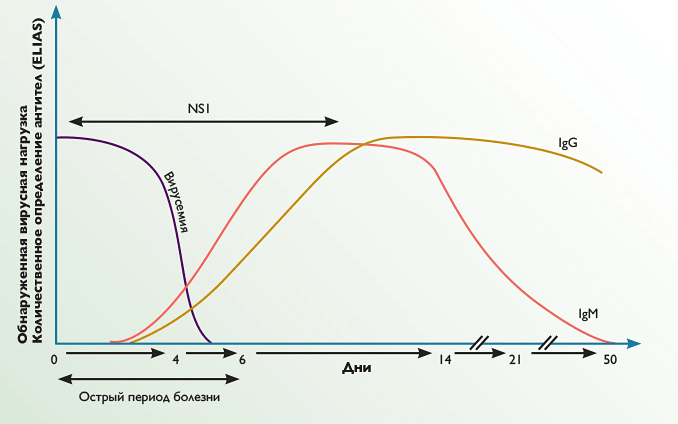
В общем, чтобы подтвердить негативное действие ингибиторов нейраминидазы на иммунный ответ, необходимо хотя бы изучить различие количества антител при разной концентрации вируса, а также понять, спустя какое время после момента заражения регистрировалось это различие, и как параллельно снижалась вирусная нагрузка (рис. 3 и 4). В целом, снижение указанных параметров по сравнению с группой контроля может быть как следствием иммуносупрессивного действия препаратов, так и результатом быстрого подавления репликации вируса, не позволяющего развиться полноценному иммунному ответу.
Рисунок 3. Временнáя кривая накопления антител.