Углерод для чего используется
Углерод
Углерод — это, пожалуй, основной и самый удивительный химический элемент на Земле, ведь с его помощью формируется колоссальное количество разнообразных соединений, как неорганических, так и органических. Углерод является основой всех живых существ, можно сказать, что углерод, наравне с водой и кислородом, — основа жизни на нашей планете! Углерод имеет разнообразие форм, которые не похожи ни по своим физико-химическим свойствам, ни по внешнему виду. Но всё это углерод!
История открытия углерода
Углерод был известен человечеству ещё с глубокой древности. Графит и уголь использовались ещё древними греками, а алмазы нашли применение в Индии. Правда, за графит частенько принимали похожие по внешнему виду соединения. Тем не менее, графит имел широкое применение в древности, в частности для письма. Даже его название происходит от греческого слова «графо» — «пишу». Графит сейчас используется в карандашах. Алмазами начали впервые торговать в Бразилии в первой половине 18 века, с этого времени открыто множество месторождений, а в 1970 году была разработана технология получения алмазов искусственным путём. Такие искусственные алмазы применяются в промышленности, натуральные же, в свою очередь, в ювелирном деле.
Углерод в природе
Содержание углерода в земной коре составляет всего около 0,15%. Казалось бы, один из основных элементов, а так мало… На самом деле, углерод подвержен постоянному круговороту из земной коры через биосферу в атмосферу и наоборот. Из углерода состоят природный газ, нефть, уголь, торф, известняки и многие другие соединения.
Наиболее значимое количество углерода собрано в атмосфере и гидросфере в виде углекислого газа. В атмосфере углерода содержится около 0,046%, а еще больше — в растворенном виде в Мировом Океане.
Кроме того, как мы видели выше, углерод является основой живых организмов. Например, в теле человека массой 70 кг содержится около 13 кг углерода! Это только в одном человеке! А углерод содержится также во всех растениях и животных. Вот и считайте…

Аллотропные модификации углерода
Углерод — уникальный химический элемент, который образует так называемые аллотропные модификации, или, проще говоря, различные формы. Эти модификации подразделяются кристаллические, аморфные и в виде кластеров.

в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
ж) однослойная нанотрубка
Аморфные формы образованы углеродом с небольшими примесями других химических элементов. Основные представители этой группы: уголь (каменный, древесный, активированный), сажа, антрацит.
Самыми сложными и высокотехнологичными являются соединения углерода в виде кластеров. Кластеры — это особая структура, при которой атомы углерода расположены таким образом, что образуют полую форму, которая заполнена изнутри атомами других элементов, например, воды. В этой группе не так уж и много представителей, в неё входят углеродные наноконусы, астралены и диуглерод.

Применение углерода
Углерод и его соединения имеют огромное значение в жизнедеятельности человека. Из углерода образованы главные виды топлива на Земле — природный газ и нефть. Соединения углерода широко применяются в химической и металлургической промышленности, в строительстве, в машиностроении и медицине. Аллотропные модификации в виде алмазов используют в ювелирном деле, фуллерит и лонсдейлит в ракетостроении. Из соединений углерода изготавливаются различные смазки для механизмов, техническое оборудование и многое другое. Промышленность в настоящее время не может обойтись без углерода, он используется везде!
Углерод в природе; его опасность и сферы применения
В природе углерода не так уж и много, но он есть везде: 
— углекислый газ выделяется в атмосферу с вулканическими газами, из горячих источников, из поверхностных слоев рек и океанов, при сгорании топлив, при дыхании растений и животных;
— в тоже время, углекислый газ поглощается растениями, переходит в организм животных и людей, а после их смерти возвращается в почву.
В чистом виде и в значимых количествах углерод встречается только в виде алмазов и графитов. Но он — составная часть ископаемого топлива (уголь, нефть, газ, сланцы), торфа, битумов, природных минералов (мел, известняк, доломиты, карбонаты).
Токсическое действие

Угарный газ и углекислый газ обладают токсическим действием, превышение ПДК этих газов в воздухе может вызвать летальный исход. Поэтому в закрытых помещениях большое внимание должно уделяться поглощению и удалению из воздуха углекислоты, выделяемой при дыхании.
Токсическим действием обладает радиоактивный изотоп С-14. Встраиваясь в молекулы белков, особенно в ДНК и РНК, он может оказывать мутагенное воздействие, поэтому для него тоже установлены ПДК содержания в воздухе рабочего помещения.
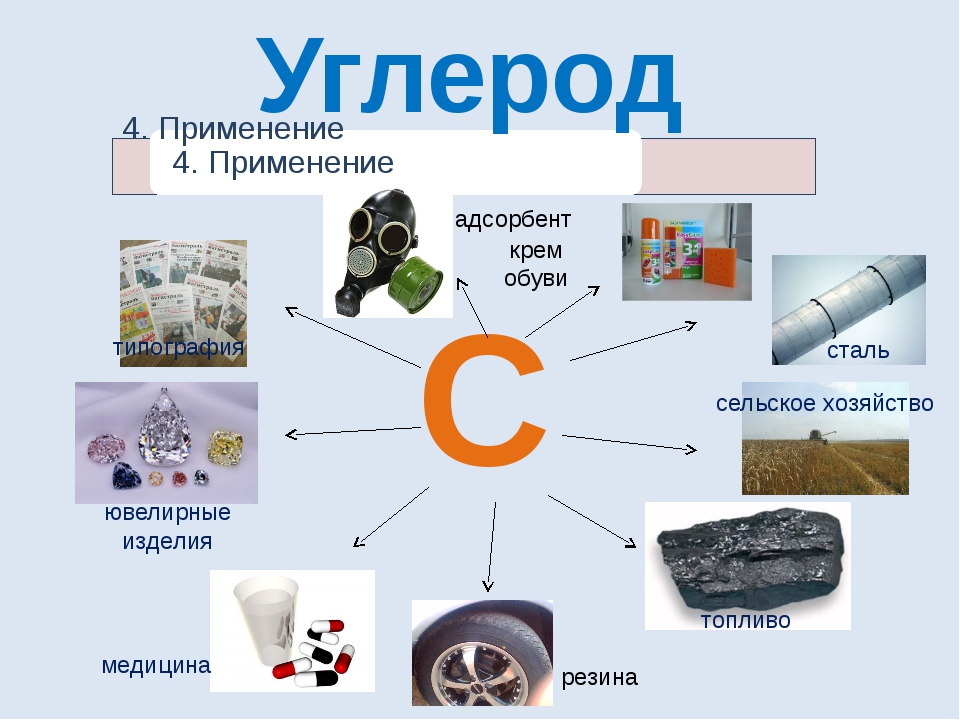
Применение
Нет ни одной области промышленности, в которой в той или иной степени не использовался бы углерод. Расскажем об основных сферах его использования:
• Основные виды ископаемого топлива на земле: нефть, уголь и газ — это соединения углерода. Они нужны для получения тепла, энергии, огромного количества химических материалов.
• В сельском хозяйстве, в медицине, энергетике, в ядерной отрасли.
• В промышленной индустрии очень востребованы карбонаты.
• Графит используется при изготовлении карандашей, электродов, высокотемпературных и низкотемпературных смазок, красителей; тиглей для металлических заготовок, углепластиков, углеродных волокон, стеклоуглерода и других углеграфитовых материалов, отличающихся особо высокой жаростойкостью.
• Стеклоуглерод идет на производство тиглей и электродов.
• Техуглерод применяется как наполнитель при производстве резин для шин и пластмасс. Придает им прочность, долговечность и некоторые особые свойства.
• Алмазы применяются в технике, сверлении, лазерных установках, в ювелирном деле. Технические алмазы используются для получения абразивных материалов. Только сложность обработки и высокая стоимость мешают алмазам стать лучшим материалом для подложек процессоров.
• В медицине используется активированный уголь для вывода токсинов, а графит — в мазях для лечения болезней кожи.
• Фильтры на основе угля применяются в противогазах, респираторах, лицевых масках и сменных патронах для них; системах очистки воды.
• В научных исследованиях радиоуглеродный анализ на основе изотопа С-14 — один из самых важных анализов в археологии, геологии, палеонтологии.
• Большие перспективы у применения новых неорганических материалов на основе углерода. Об этом — следующая статья.
Углерод элемент. Свойства углерода. Применение углерода
Его называют основой жизни. Он есть во всех органических соединениях. Только он способен формировать молекулы из миллионов атомов, такие, как ДНК.
Столько не наберется у всех остальных, вместе взятых элементов. Не удивительно, что один из двух разделов химии изучает исключительно соединения углерода и проходится в старших классах.
Предлагаем вспомнить школьную программу, а так же, дополнить ее новыми фактами.
Что такое углерод
В устаревшем варианте системы, углерод стоит в главной подгруппе 4-ой группы.
Обозначение элемента – буква С. Порядковый номер вещества – 6, относится к группе неметаллов.
Различия во внешности обусловлены несколькими типами строения кристаллической решетки. От нее зависят и полярные характеристики минерального углерода.
Графит, к примеру, мягок, не зря же добавляется в пишущие карандаши, а алмаз тверже всех остальных камней на Земле. Поэтому, логично рассмотреть свойства самого углерода, а не его модификаций.
Свойства углерода
Начнем со свойств, общих для всех неметаллов. Они электроотрицательны, то есть, оттягивают на себя общие электронные пары, образованные с другими элементами.
Получается, углерод может восстановить оксиды неметаллов до состояния металлов.
Однако, делает это 6-ой элемент лишь при нагреве. В обычных условиях вещество химически инертно.
На внешних электронных уровнях неметаллов больше электронов, чем у металлов.
Именно поэтому, атомы 6-го элемента стремятся достроить толику собственных орбиталей, чем отдавать свои частицы кому-то.
Металлам же, с минимумом электронов на внешних оболочках проще отдать отдаленные частицы, чем перетягивать на себя чужие.
Главная форма 6-го вещества – атом. По идее, речь должна идти о молекуле углерода. Из молекул составлено большинство неметаллов.
Однако, углерод с бором и кремнием – исключения, имеют атомную структуру. Именно за счет нее соединения элементов отличаются высокими температурами плавления.
Раз разговор зашел о формах 6-го вещества, укажем, что кристаллическая – лишь одна из.
Атомы углерода не всегда выстраиваются в кристаллическую решетку. Встречается аморфная разновидность.
Если же вещество соединено с другими, могут получиться и газы. Кристаллический углерод переходит в них при температуре в 3700 градусов.
В обычных условиях элемент газообразен, если это, к примеру, оксид углерода.
В народе его именуют угарным газом. Однако, реакция его образования активнее и быстрее, если, все же, поддать жару.
Газообразных соединений углерода с кислородом несколько. Есть еще, к примеру, монооксид.
Этот газ бесцветный и ядовитый, причем, при обычных условиях. Такая окись углерода имеет тройную связь в молекуле.
Реакция возможна и с водородом. Углерод вступит во взаимодействие, если «сыграет» один из факторов, или все вместе: температура, аллотропное состояние, дисперсность.
Под последней, подразумевается отношение площади поверхности частиц вещества к занимаемому ими объему.
Аллотропия – возможность нескольких форм одного и того же вещества, то есть, имеется в виду кристаллический, аморфный, или газообразный углерод.
Однако, как не совпадай факторы, с кислотами и щелочами элемент не реагирует вовсе. Игнорирует углерод и почти все галогены.
Чаще всего, 6-ое вещество связывается само с собой, образовывая те самые масштабные молекулы из сотен и миллионов атомов.
Сформированные молекулы, углерода реагируют с еще меньшим числом элементов и соединений.
Применение углерода
Применение элемента и его производных столь же обширно, как их число. Содержание углерода в жизни человека больше, чем может казаться.
Активированный уголь из аптеки – 6-е вещество. Бриллиант в кольце из ювелирного магазина – он же.
Графит в карандашах – тоже углерод, нужный, так же, в ядерных реакторах и контактах электрических машин.
Метановое топливо тоже в списке. Диоксид углерода нужен для производства соды и может быть сухим льдом, то есть, хладагентом.
Углекислый газ служит консервантом, заполняя овощные хранилища, а еще, нужен для получения карбонатов.
Формула углерода соответствует еще и коксу. Он пригождается металлургам.
Кокс служит восстановителем во время переплавки руды, извлечения из нее металлов.
Не задумывались, почему автомобильные шины черного цвета? Это сажа. Она придает резине прочность.
Сажа, так же, входит в крема для обуви, краски для печати, туши для ресниц. Народное название употребляется не всегда. Промышленники зовут сажу техническим углеродом.
Это твердый и прочный материал. Звучит увесисто. Но, на самом деле, аэрогель легче воздуха.
В железо углерод добавляют, чтобы получить так называемую углеродистую сталь. Она тверже обычной.
Однако, массовая доля 6-го элемента в сплаве не должна превышать пары, тройки процентов. Иначе, свойства стали идут на спад.
Список можно продолжать бесконечно. Но, где бесконечно брать углерод? Добывают его или синтезируют? На эти вопросы ответим в отдельной главе.
Добыча углерода
Газ углерод и его твердые модификации проще и дешевле добывать попутно с каменным углем.
Из земных недр этого ископаемого извлекают примерно 2 миллиарда тонн ежегодно. Хватает, чтобы обеспечить мир техническим углеродом.
Месторождения графита, напротив, горизонтальны, располагаются у поверхности.
Поэтому, добыча минерала довольно проста и не затратна. В год из недр извлекают около 500 000 тонн графита.
Чтобы получить активированный уголь, приходится нагреть каменный уголь и обработать струей водяного пара.
Ученые даже разобрались, как воссоздать белки человеческого тела. Их основа – тоже углерод. Азот и водород – аминогруппа, к нему примыкающая.
Нужен, так же, кислород. То есть, белки построены на аминокислоте. Она не у всех на слуху, но для жизни куда важнее остальных.
Популярные серная, азотная, соляная кислоты, к примеру, организму нужны куда меньше.
Так что, углерод – то, за что стоит платить. Узнаем, на сколько велик разброс цен на разные товары из 6-го элемента.
Цена углерода
Для жизни, как несложно понять, углерод бесценен. Что же касается остальных сфер бытия, ценник зависит от наименования продукции и ее качества.
Образцы аэрогеля, пока, стоят десятки долларов за несколько квадратных сантиметров.
Но, в будущем, производители обещают поставлять материал рулонами и просить недорого.
Технический углерод, то есть, сажа, реализуется по 5-7 рублей за кило. За тонну, соответственно, отдают около 5000-7000 рублей.
Однако, углеродный налог, вводимый в большинстве развитых стран, может обеспечить рост цен.
Углеродную промышленность считают причиной парникового эффекта. Предприятия обязывают платить за выбросы, в частности, CO2.
Это главный парниковый газ и, одновременно, индикатор загрязнения атмосферы. Эта информация – ложка дегтя в бочке меда.
Она позволяет понять, что у углерода, как и всего в мире, есть обратная сторона, а не только плюсы.
Углерод и его значение и применение
Но шутки в сторону. Углерод заслуживает вежливого и серьезного отношения. Хотя бы потому что «элементами жизни» иногда называют и калий, и фосфор, и азот. Но если так, то какого определения заслуживает элемент, на основе которого действительно построено все живое?
Как восстановитель углерод применяют не только в производстве чугуна, но и многих цветных металлов. Практически в роли восстановителя выступает кокс, в котором углерода 97—98%. А вот древесный уголь — первый, видимо, восстановитель в черной металлургии — в цветной металлургии нашего времени выступает в ином качестве. Из него делают так называемый покровный слой, предохраняющий расплавленный металл от окисления.
Не обходится без углерода и производство алюминия — металл нарастает на графитовом катоде.
А в доменном процессе обычно участвует не только элементный углерод (в виде кокса), но и одно из соединений элемента № 6. Обыкновенные плотные известняки применяют в качестве флюсов при выплавке чугуна из железных руд, содержащих в качестве пустой породы кремнезем и глинозем.
Впрочем, еще раньше, в феврале 1953 г., первые искусственные алмазы получила группа Эрика Гуннара Лундблада (Швеция), но шведские ученые не торопились с публикацией результатов своих трудов.
С тех пор, с середины 50-х годов XX в., успешные работы по промышленному синтезу алмазов ведутся в ряде стран. В нашей стране эту работу возглавляли В. Н. Бакуль и академик Л. Ф. Верещагин. Известно, например, что в середине 70-х годов Горьковский автомобильный завод расходовал в год до 400 тыс. каратов искусственных алмазов. Один завод — 80 кг алмазов! Примерно столько же «тратил» их Сестрорецкий инструментальный завод и некоторые другие предприятия.
В мире уже производятся и синтетические алмазы ювелирного качества; обходятся они намного дороже природных.
Промышленный синтез алмазов — большое достижение науки и техники. Ученые шли к нему многие десятилетия. Большинство попыток, предпринимавшихся в прошлом, заканчивались неудачей. Но были и проблески. О двух из них и о синтезе алмаза в метеоритном веществе рассказывают следующие заметки.
возможности образования алмазов вне земной коры послужило обнаружение алмазных крупинок в метеорите, упавшем 10 (по старому стилю) сентября 1886 г. возле деревни Новый Урей Краснослободского уезда Пензенской губернии (ныне — Мордовская АССР).
Крупинки алмаза были обнаружены в метеоритном веществе преподавателями Петербургского лесного института доцентом-минералогом Михаилом Васильевичем Ерофеевым и профессором химии Павлом Александровичем Лачиновым (известен больше всего работами по холестерину, которыми занимался в последние годы жизни).
Осколки метеорита «Новый Урей» были присланы в Петербург бывшим студентом Лесного института учителем Павлом Ивановичем Барышниковым.
Приводим выдержки из его письма директору Лесного института: «. Рано поутру несколько новоурейских крестьян верстах в трех от деревни пахали свое поле. Вдруг совершенно неожиданно сильный свет озарил всю окрестность; затем через несколько секунд раздался страшный треск, подобный пушечному выстрелу или взрыву, за ним второй, более сильный. Вместе с шумом в нескольких саженях от крестьян упал на землю огненный шар; вслед за этим шаром невдалеке над лесом опустился другой, значительно больше первого. Все явление продолжалось не более минуты.
Обезумевшие от страха крестьяне не знали, что делать, они попадали на землю и долго не решались сдвинуться с места. Наконец один из них, несколько ободрившись, отправился к тому месту. и, к удивлению своему, нашел неглубокую яму; в середине ее, углубившись до половины в землю, лежал очень горячий камень черного цвета. Тяжесть камня поразила крестьян..
Затем они отправились к лесу разыскать второй, больший камень, но все усилия их были напрасны: лес в этом месте представляет много болот и топей, и найти аэролита им не удалось: по всей вероятности, он упал в воду.
На следующий день один из крестьян того же Урейского выселка отправился на свое поле посмотреть копны гречихи. Здесь совершенно случайно им найден был такой же точно камень, какой принесли накануне его соседи. Камень тоже образовал вокруг себя ямку; часть камня была в земле. Дальнейшие поиски крестьян в окрестностях Нового Урея не привели ни к чему. Следовательно, выпало всего три куска. Самый большой из них упал, без сомнения, в лесу в болото; второй по величине, упавший при крестьянах на пашне, приобретен мною и отослан Вам для минералогического кабинета института и, наконец, третий, найденный крестьянином в гречихе, съеден. Крупинки аэролита считались положительно универсальным лекарством. Распространились нелепые слухи о «чудесном исцелении», требования на «христов камень» усилились; счастливый владелец метеорита пользовался случаем и продавал камешек чуть не на вес золота, выказывая при этом слабости настоящего завзятого аптекаря. Прием «христова камня» производился таким образом: пациент, купивши ничтожный кусочек метеорита, толок и растирал его в порошок и затем, смешав с водой, благоговейно выпивал, творя молитву и крестное знамение.»
За открытие алмазов в метеорите Российская Академия наук присудила Ерофееву и Лачинову Ломоносовскую премию. А каких-либо следов того, что хоть кто-нибудь обратил внимание на беспросветную темноту крестьян, история не сохранила.
Небесное тело (вернее, часть его), присланное Барышниковым в институт, весило 1762,3 г; позже были получены еще два осколка — весом 21,95 и 105,45 г. Не считая двух десятков граммов, израсходованных Ерофеевым и Лачиновым на анализы, метеорит сохранился.
Его можно видеть и сейчас в Ленинградском горном музее.
В начале 90-х годов Хрущов предпринял попытку повторить «эксперимент» природы, приводящий к появлению в метеоритах алмазных крупинок (после открытия Ерофеева и Лачинова, исследовавших каменный метеорит, такие же находки были сделаны в веществе железных метеоритов). Но для этой попытки стальная «бомба» уже не годилась.
Вот выдержки из доклада К. Д. Хрущова, сделанного им 4 марта 1893 г. на заседании Санкт-Петербургского императорского минералогического общества: «На основании находок в метеорите можно было прийти к мысли, что под сильным давлением углерод может выделяться из раствора в металле в виде алмаза. Мы проделали такой опыт. Насытив кипящее серебро углеродом, которого растворилось шесть процентов, я быстро охладил массу. Давление в ее середине не могло не повыситься под действием корки, сразу же затвердевшей снаружи. Последовавшее затем растворение получившегося слитка показало, что часть выделившегося углерода имеет свойства алмаза.
Порошок его состоит из прозрачных бесцветных кристаллических осколков и пластинок, сильно преломляющих свет, совершен но изотропных, царапающих корунд и сгорающих в углекислоту с незначительным остатком золы».
Располагая лучшим из возможных по тому времени источников нагрева — изобретенной им электрической дуговой печью, Муассан решил растворить углерод (сахарный уголь) в кипящем железе. Глубоким убеждением этого выдающегося ученого (кстати иностранного члена-корреспондента Российской Академии наук) было сформулированное им научное правило: «Опыт должен получаться всегда!» Это значит, что результаты эксперимента, настоящего эксперимента, отвечающего незыблемым законам природы должны быть так же постоянны, как и эти законы. А раз так, то все, что не относится к самой сути опыта, особого значения не имеет.
Вероятно, исходя из этого убеждения, Муассан и применил в своем опыте несколько необычную для научной лаборатории, но зато предельно простую «систему охлаждения» расплавленного железа. Он поставил на полу в лаборатории табурет, на него деревянную лохань, в лохань палил водопроводную воду. И когда пришло время охлаждать кипящее железо с растворенным в нем углеродом, профессор поднял клещами тигель и вылил его содержимое в лохань с водой! К счастью, Муассан все-таки надел перед этим очки и фартук, а загоревшуюся на нем одежду удалось потушить.
Когда бесформенный слиток, оставшийся в лохани после взрыва, был растворен в кислотах, из пего выделили несколько крупинок. Они тонули в жидкости с удельным весом три, царапали рубин и корунд, почти целиком сгорали в кислороде.
Таковы два происшествия из истории искусственного алмаза.
Что нужно, чтобы материал был очень прочным? Во-первых, высокие значения энергии химических связей. Во-вторых, направления этих связей должны по возможности совпадать и идти вдоль оси кристалла. В-третьих, если вещество полимерного строения, нужно, чтобы степень его полимеризации была высокой. Четвертое обязательное условие — отсутствие в макромолекуле «слабых мест» и слабых связей. Все эти условия соблюдены в карбине, поэтому рекордные значения расчетной теоретической прочности, в общем, не удивительны.
Углерод-14 — один из природных радиоактивных изотопов, период его полураспада 5570 лет.
Поток космических протонов, летящих со скоростью, близкой к скорости света, непрерывно бомбардирует Землю. Уже в верхних слоях атмосферы протоны сталкиваются с ядрами азота и кислорода. При таких столкновениях атомы разрушаются, в результате чего получаются свободные нейтроны, моментально захватываемые ядрами элементов воздуха, в первую очередь, конечно, ядрами атомов азота. И тогда происходит одно из чудес, признаваемых наукой, — взаимопревращение элементов: азот становится углеродом, только не простым, а радиоактивным углеродом-14.
Ядра углерода-14, распадаясь, испускают электроны и вновь превращаются в ядра азота.
Зная период полураспада изотопа, нетрудно подсчитать, сколько его теряется за любой промежуток времени. Подсчитали, что за год на Земле распадается примерно 7 кг радиоуглерода. Это означает, что на нашей планете естественным путем поддерживается постоянное количество этого изотопа — в результате ядерных реакций, идущих в атмосфере, Земля ежегодно «приобретает» около 7 кг 14 C.
Земная атмосфера углеродом не богата. В ней всего 0,03% (по объему) двуокиси углерода CO2. Но в пересчете на вес это не так уж мало: общее содержание углерода в атмосфере — около 600 млн. т. И в каждом биллионе молекул атмосферной CO2 есть один атом 14 C. Эти атомы вместе с обычными усваиваются растениями, а оттуда попадают в организмы животных и человека. В любом живом организме есть радиоуглерод, который постепенно распадается и обновляется. В грамме «живого» углерода каждую минуту происходят 14 актов радиоактивного распада. Опыт показывает, что концентрация этого изотопа одинакова во всем живом на пашей планете, хотя в силу некоторых геофизических причин радиоуглерод «приземляется» преимущественно в полярных районах.
Но вот организм гибнет и перестает быть звеном непрерывно идущего на Земле круговорота углерода. Новый радиоуглерод в него уже не поступает, а радиоактивный распад продолжается. Через 5570 лет количество радиоуглерода в отмершем организме уменьшится вдвое, и в грамме углерода, извлеченного из дерева, срубленного 5570 лет назад, чувствительные счетчики за минуту зафиксируют уже не 14, а лишь 7 актов распада. Поэтому с помощью радиоуглерода можно определить возраст практически любого предмета, сделанного из материалов растительного
или животного происхождения.
Датировка предметов древности по радиоуглероду в высшей степени удобна и достаточно точна. Причиной тому период полураспада 14 C — 5570 лет. Возраст человеческой культуры — величина того же порядка.
Этот метод помог определить даты древних вулканических извержений и время вымирания некоторых видов животных. Он помог разоблачить не одну археологическую подделку, когда за свидетельства древности выдавались, например, черепа с подпиленными зубами.
Но главной заслугой метода следует, видимо, считать установление времени ледниковых периодов.
Радиоуглеродные измерения показали: за последние 40 тыс. лет на Земле было три ледниковых периода. Самый поздний — примерно 10 400 лет назад. С тех пор на Земле относительно тепло.