Удалить яичники или колоть золадекс что лучше
Удалить яичники или колоть золадекс что лучше
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Удалить яичники или колоть золадекс что лучше
ДокторПитер
Петербургский врач рассказал, стоит ли удалять яичники по примеру Анджелины Джоли
Как отметила Анджелина Джоли в своей колонке в The New York Times, удаление яичников и фаллопиевых труб менее сложная операция, чем мастэктомия, которую она пережила несколько лет назад. Однако последствия двусторонней сальпинго-оварэктомии куда более серьезные — после операции у женщины наступает принудительная менопауза. Джоли смирилась с тем, что больше не сможет иметь детей, а ее тело будет претерпевать физические изменения. Актриса в очередной раз отметила, что хочет обратить внимание других женщин из групп риска на возможные варианты профилактики рака.
Напомним, к операции актрису подтолкнули результаты анализов, показавшие у нее высокую степень предрасположенности к развитию рака яичников, которую врачи оценили в 50%. Дело в том, что у Джоли обнаружена мутация гена BRCA1, которая указывает на высокий риск развития рака груди и женской репродуктивной системы. Напомним, мать, тетя и бабушка актрисы умерли из-за онкологических заболеваний.
Врач считает, что актриса приняла верное решение: «К сожалению, у нас в России профилактические операции не в почете, а вот в западной медицине это не является чем-то необычным или пугающим. Прибегать к сальпинго-оварэктомии можно женщинам после 40 лет, у которых обнаружен высокий риск развития рака яичников. После удаления яичников для женщин в возрасте от 40 до 50 лет допускается применение гормонозаместительной терапии. А после 50 лет подобная операция вообще никак не сказывается на качестве жизни — как правило, к этому возрасту яичники перестают выполнять свою работу, и их удаление абсолютно безболезненно для организма».
Золадекс и прекращение работы яичников
Золадекс и прекращение работы яичников
Рост многих типов рака молочной железы зависит от наличия женского полового гормона — эстрогена, циркулирующего в крови. Как всплески эстрогена вызывают пролиферацию протоков ткани в груди с каждым менструальным циклом, так и клетки рака молочной железы также реагируют на его рост. Только клетки рака молочной железы, которые экспрессируют гормональные рецепторы, эстроген или рецепторы прогестерона, чувствительны к стимулирующему росту эффектов эстрогена. Приблизительно 70 % рака молочной железы — гормоно-чувствительные. Рак молочной железы, который отрицателен для эстрогена и рецепторов прогестерона, не отвечает на гормональное воздействие.
Основным источником эстрогена у предклимактерических женщин являются яичники, маленькая железа, которая находится в задней части таза по обе стороны от верхней части матки. Яичники производят зрелые яйцеклетки с каждым менструальным циклом, но они являются также машинным отделением для производства эстрогена и прогестерона. Уровни эстрогена в крови приблизительно в 10 раз выше у предклиматерических женщин по сравнению с женщинами, которые находятся в периоде менопаузы. В постменопаузе эстроген главным образом производится в надпочечниках и жировой ткани тела, но на значительно более низких уровнях, чем произведенные предклиматерическими яичниками. Если мы хотим заставить голодать клетки эстрогенного рака молочной железы в пременопаузе у женщин самый легкий путь — отключить их от основного питания — то есть яичников. Самый простой способ сделать это — удалить яичники.
Удаление яичников
Овариоэктамия — самый старый способ отключить производство эстрогена у предклиматерических женщин. Этот способ все еще один из самых эффективных. Он осуществляется в настоящее время путем простой “key-hole” («лапароскопической») процедуры через один маленький разрез в нижней части брюшной стенки, ниже линии бикини. Это процедура «одного дня», которая выполняется под легкой общей анестезией. У большинства женщин бывают небольшие проблемы впоследствии, наряду с некоторыми незначительными проявлениями может быть легкий тазовый дискомфорт на следующий день после операции, боль во время менструации. Женщины, которым производилась процедура в пятницу, обычно чувствуют себя в порядке для того, чтобы пойти на работу уже в понедельник.
Иногда овариэктомия проводится крупной открытой операцией, нередко с удалением матки одновременно. Это обычно делается только в том случае, когда есть причина удалить матку, такая как обильное кровотечение или фиброзные опухоли.
Почему мы обычно не удаляем матку
Причина состоит в том, что это большая операция с большим количеством побочных эффектов. Пока это безопасно, мы предпочитаем не делать более рискованную операцию, если для этого нет никаких оснований. Удаление яичников «key-hole» методом чрезвычайно безопасно.
Недостаток овариэктомии — необратимость
Менопауза, вызванная овариэктомией, постоянная и необратимая. Это значительная проблема для молодой женщины, которая может все еще планировать семью.
Быстрое начало менопаузальных признаков
Если климактерические симптомы возникают, они могут происходить более быстрыми темпами после овариэктомии, в то время как использование Золадекса (Гозерелина) имеет тенденцию вызывать более щадящую менопаузу.
Золадекс (Гозерелин)
Золадекс — это гормональное вещество, которое впрыскивается в депо-форме под кожу нижней части живота один раз в месяц. Гормон действует на гипофиз, чтобы предотвратить секрецию сигнала из этой железы, которая необходима для стимуляции яичников при производстве эстрогена. Некоторые называют это «медицинской менопаузой». Как следствие этого впрыска, будут проявляться все симптомы менопаузы: прекращение менструального цикла (обычно сразу, хотя некоторые женщины имеют один менструальный цикл после первой депо-инъекции.)
Как долго применять Золадекс
Для женщин, принимающих Золадекс в качестве адъювантного лечения после раннего рака молочной железы, длительность лечения составляет, как правило, ежемесячно в течение двух лет.
Когда я должна начать применять Золадекс
Обычно мы советуем начинать первую инъекцию в течение первых 10 дней после нормального менструального цикла. Для женщин с очень нерегулярными периодами это может быть невозможно.
Будучи используемым в качестве адъювантного лечения для рака молочной железы на ранней стадии, применять Золадекс обычно начинают после того, как курсы химиотерапиии и радиотерапии были закончены. Это вызвано тем, что гормональная манипуляция может вмешаться в эффективность химиотерапии и радиотерапии, и, кроме того, клинические испытания показали, что это лучшая последовательность действий.
Для женщин, применяющих Золадекс-терапию в качестве лечения прогрессирующего или метастатического рака молочной железы, продолжительность лечения зависит от индивидуальных особенностей, и вы должны обратиться за советом к своему онкологу.
Какова нормальная доза
Обычная доза составляет 3,6 мг ежемесячно путем депо-инъекции. Инъекции обычно впрыскивается лечащим врачом.
Обратимость
Эффекты Золадекс обратимы. Если вы решите по некоторым причинам, что хотите остановить прием Золадекса, например, из-за невыносимых менопаузальных признаков, то ваш менструальный цикл обычно возвращается в течение трех месяцев после прекращения депо-инъекций. Помните, что все женщины испытывают менопаузу обычно в возрасте около 50 лет, а у некоторых это может произойти на 10 лет раньше. Это устанавливается «биологическими часами» вашего организма, и Золадекс не изменит те «часы». Если, скажем, вы находитесь на Золадексе в течение нескольких лет, и ваше тело достигло своего предопределенного времени менопаузы, то ваши месячные могут не возвратиться, когда вы прекратите прием Золадекса. Мы не можем знать, когда наступит наша «биологическая» менопауза.
Удалить яичники или колоть золадекс что лучше
Т.Ю. Семиглазова, И.В. Берлев, Е.А. Ульрих, В.В. Семиглазов, Е.А. Коробейникова, С.А. Проценко, П.В. Криворотько, В.Ф. Семиглазов
ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Эволюция эндокринотерапии рака молочной железы
Рак молочной железы (РМЖ) занимает первое место в структуре онкологической заболеваемости у женщин и является второй причиной смерти после сердечно-сосудистых заболеваний. Каждый год в мире регистрируют более 1 млн. новых случаев РМЖ. По прогнозам ВОЗ к 2020 году число заболевших РМЖ превысит 2 млн. новых случаев. Пик заболеваемости РМЖ приходится на возрастной промежуток 60-80 лет, однако у 40% женщин РМЖ выявляется в трудоспособном возрасте, когда они ведут активный образ жизни [1].
В настоящее время определена предиктивная и прогностическая роль экспрессии рецепторов стероидных гормонов. Во многих исследованиях доказано, что при высокой экспрессии рецепторов эстрогенов и прогестерона вероятность ответа на гормональную терапию достигает 60% [2, 3]. Эстрогены взаимодействуют с рецепторами и образуют комплексы, обладающие стимулирующим действием. Разрушение механизма по созданию этих комплексов лежит в основе гормонотерапии [4]. Гормональная терапия является, по сути, первой таргетной терапией, которая применяется как на ранних стадиях, так и при диссеминированных формах РМЖ.
О роли эстрогенов в патогенезе РМЖ начали задумываться давно. Необратимая овариальная супрессия (кастрация) впервые была выполнена более 120 лет назад хирургом G. Beatson в 1896 году [5]. Эту дату можно считать началом эры гормонотерапии РМЖ. Хирургическая кастрация еще долгое время была единственным методом лечения у больных распространенным РМЖ. Положительный эффект от нее наблюдался почти у каждой третьей больной. Затем в 1922 году французский врач F. Courmelles выполнил облучение яичников больным РМЖ, которое, однако, оказалось менее эффективным, чем овариоэктомия [6]. В 1953 году C. Huggins выдвинул предположение о том, что надпочечники, наряду с яичниками, являются дополнительным источником стероидных гормонов, в том числе эстрогенов, продолжая продуцировать их с наступлением естественной или искусственной менопаузы. С. Huggins впервые рекомендовал больным РМЖ выполнение двусторонней адреналэктомии после овариоэктомии, за что в 1966 году получил Нобелевскую премию [7]. Вслед за ним R. Luft предложил выполнять гипофизэктомию при различных состояниях, включая сахарный диабет и РМЖ [8].
Развитие лекарственной гормональной терапии началось в 1939 году, когда ученый P. Ulrich описал положительный опыт применения тестостерона у двух больных РМЖ [9]. Затем, благодаря A. Haddow, в 1944 году в клиническую практику были впервые внедрены высокие дозы эстрогенов (диэтилстилбестрола). Описано наблюдение 14 больных метастатическим РМЖ в возрасте от 31 до 80 лет, которые получали диэтилстилбестрол в течение нескольких месяцев [10]. В 1951 году G. Escher опубликовал данные об эффективности применения прогестинов при распространенном РМЖ. Однако их использование ограничивала относительно низкая частота ответа по сравнению с тестостероном и эстрогенами, а применение часто сопровождалось серьезными выраженными локальными реакциями в месте введения препарата [11]. В 1962 году впервые было сообщено о существовании рецепторов к эстрогенам, которые были обнаружены с помощью радиоактивного эстрадиола, а несколько позднее, в 1985 году, стали определять и рецепторы к прогестерону [12].
В 70-е годы XX века начинается современный этап эволюции гормональной терапии РМЖ. В 1971 году Walpole и M. Cole впервые исследовали эффективность тамоксифена в клинических исследованиях, что позволило внедрить его в клиническую практику. Тамоксифен и по сей день остается «золотым стандартом» гормональной терапии РМЖ [13]. Сообщалось, что эффективность тамоксифена была высокой, но при этом препарат обладал меньшим количеством нежелательных явлений, чем, например, прогестины. Поэтому в 1977 году тамоксифен был утвержден FDA в качестве препарата для лечения метастатического РМЖ. В 1973 году C. Griffiths впервые применил ингибиторы ароматазы (аминоглютетимид) как альтернативу адреналэктомии, считавшейся эффективной, но сопровождавшейся большим количеством операционных рисков [14]. В 1982 году J. Klijn применил агонисты гонадотропин-релизинг-гормона (аГнРГ) вместо хирургической овариоэктомии у больных метастатическим РМЖ с сохраненной менструальной функцией. Было показано, что добавление овариальной супрессии к терапии тамоксифеном улучшает выживаемость без прогрессирования и общую выживаемость по сравнению с монотерапией тамоксифеном [15]. В 1994 году A. Howell представил результаты первого применения антагониста рецепторов эстрогена у 19 больных метастатическим РМЖ, у которых наблюдалась прогрессия при приеме тамоксифена. При этом у 69% (13 пациентов) наблюдалась стабилизация заболевания или частичный ответ на лечение, что положило начало изучению еще одного класса препаратов в лечении РМЖ [16].
Особенности синтеза эстрогенов в пре- и постменопаузу
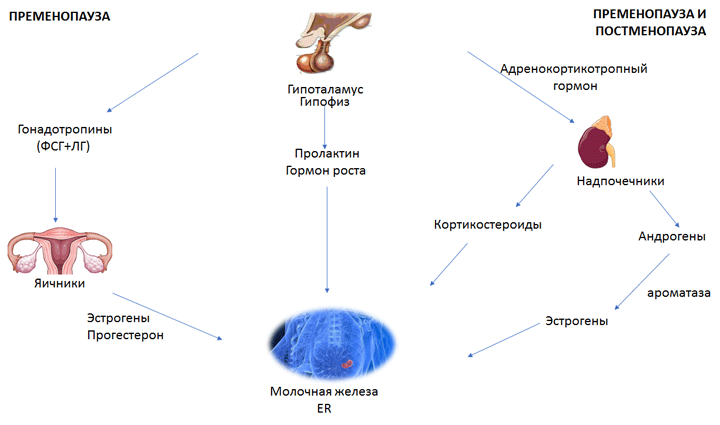
Известно, что выбор эндокринной терапии у больных РМЖ зависит от гормональной регуляции синтеза гормонов в организме женщины, осуществляемой гипоталамо-гипофизарно-яичниковой осью. Синтез эстрогенов в пременопаузу происходит преимущественно в яичниках (рис.1). Лютеинизирующий гормон (ЛГ) стимулирует синтез андрогенов тека-клетками фолликулов яичника, а фолликулостимулирующий гормон (ФСГ) оказывает влияние на продукцию эстрогенов в клетках гранулезы путем ароматизации андрогенов, образовавшихся в тека-клетках. У женщин в постменопаузе концентрация наименее активного эстрогена (эстрона) в плазме крови становится в 3-4 раза выше, чем активного эстрадиола. Эстрон в постменопаузе образуется в жировой и мышечной ткани из адростендиона, который в большей степени синтезируется надпочечниками, а не яичниками. Таким образом, в пременопаузе основными источниками эстрогенов являются яичники и периферические ткани, а в постменопаузе остаются только периферические ткани. Это оказывает влияние и на выбор гормональной терапии [17].
Рисунок 1. Синтез эстрогенов в пре- и постменопаузе [17].
Возрастные изменения в репродуктивной системе в основном определяются процессами, происходящими в гипоталамусе, гипофизе и яичниках. К концу репродуктивного периода снижение числа гранулезных клеток сопровождается истощением запаса ооцитов, прекращением фолликулогенеза и снижением продукции эстрадиола, что соответствует периоду перехода в менопаузу. В этот период недостаточность фолликулов имеет непостоянный характер, но в результате заканчивается аменореей. После наступления финальной менструации и в период менопаузы уровень эстрадиола стабильно низкий ( 30, эстрадиол может быть высоким из-за повышенной ароматазной активности клеток жировой ткани. В то же время у курящих женщин никотин и его метаболит котинин, ингибирующий ароматазу, приводят к снижению уровня эстрадиола.
Одним из факторов, негативно влияющих на определение истинной гормональной активности яичников, является химиотерапия (ХТ). Прямое цитотоксическое повреждение яичников часто приводит к снижению эстрадиола и, как следствие, повышению уровня ФСГ независимо от возраста женщины. Результатом токсического действия ХТ на клетки яичников является овариальная дисфункция, которая клинически проявляется аменореей. Во многих случаях аменорея может быть необратимой и переходить в менопаузу. Даже при длительном отсутствии менструального цикла спустя какое-то время после окончания ХТ оставшиеся жизнеспособные фолликулы могут выходить из примордиального пула с восстановлением уровня гонадотропинов до пременопаузальных значений и возобновлением менструации. Для определения гормональной активности яичников на фоне противоопухолевой лекарственной терапии необходимо оценивать уровни эстрадиола [41].
Определение уровня этих гормонов в сыворотке крови и анализ полученных результатов в клинической практике – непростая задача. Чувствительность иммуногистохимического метода оценки недостаточно высока, и частота ложных результатов может достигать 25-40%. Одним из наиболее современных методов определения уровня биомаркеров является технология масс-спектрометрии в сочетании с высокоэффективной жидкостной хроматографией. Этот метод обеспечивает практически 100% специфичность, необходимую чувствительность и не требует трудоемкой подготовки исследуемого биологического материала. К сожалению, не все лаборатории оснащены таким оборудованием, и доступность этой технологии ограничена. Также не существует определенных пограничных количественных значений маркеров репродуктивной системы, которые отражали бы истинное состояние овариальной функции после проведения химиотерапии и позволяли отличить аменорею от менопаузы. Поэтому необходимо использовать дополнительные критерии оценки овариальной функции для определения гормональной активности яичников у пременопаузальных женщин после химиотерапии.
Согласно клиническим рекомендациям, в настоящее время в качестве адъювантной гормональной терапии у женщин в постменопаузе с первично-операбельным РМЖ применяются селективные антиэстрогены (тамоксифен) и ингибиторы ароматазы. Механизм действия ингибиторов ароматазы (ИА) таков, что при снижении синтеза эстрогенов в периферических тканях за счет блокирования фермента ароматазы повышается синтез эстрогенов в яичниках. ИА противопоказаны при сохранной функции яичников и могут назначаться только больным, достигшим стойкой менопаузы, в том числе с помощью медикаментозной или хирургической овариальной супрессии. В пременопаузе ингибиторы ароматазы необходимо использовать только в комбинации с овариальной супрессией [41, 18].
Методы овариальной супрессии, плюсы и минусы
Под термином «овариальная супрессия» обычно понимают достижение подавления функции яичников одним из 3-х методов: хирургическим, лучевым, лекарственным. Кроме того, используют термин «овариальная абляция», который обычно подразумевает хирургическую кастрацию или облучение, подчеркивая тем самым необратимость воздействия [41].
Методы овариальной супрессии (ОС):
Самым надежным и быстрым методом снижения циркулирующих эстрогенов до постменопаузального уровня является хирургическая овариоэктомия, эффективность метода достигает практически 100%. Главными недостатками хирургической ОС являются необратимый климакс у женщин и утрата детородного потенциала. Преждевременный климакс сопровождается не только тягостными симптомами (приливы, эмоциональная нестабильность и др.), но и такими осложнениями, как остеопороз и повышенный риск развития ишемической болезни сердца. Также остается риск осложнений как самого хирургического вмешательства, так и анестезиологического пособия. В настоящее время овариоэктомия обычно выполняется лапароскопическим доступом, и риск осложнений минимальный.
Впервые лучевая терапия была описана как средство для лечения РМЖ в качестве адъювантной терапии более 70 лет назад [43]. Облучение яичников было очень удобным для онкологов простотой исполнения и возможностью проводить лучевое воздействие амбулаторно. Исследования показали, что менструальный цикл возобновился у 13% женщин после облучения яичников, а в группе молодых женщин менструальный цикл восстановился у 35% больных [44, 45]. Проведение стандартного лучевого воздействия на яичники не всегда приводит к снижению циркулирующих эстрогенов до постменопаузального уровня. Поэтому, к сожалению, эффективность лучевого воздействия не достигает 100%, и наступление ОС зависит не только от дозы, но и от возраста пациента. Облучение яичников с целью ОС используется реже, чем другие методы.
Лекарственная овариальная супрессия достигается путем введения аналогов гонадотропин-рилизинг гормона (аГнРГ) – главного связующего звена между корой головного мозга и гипофизом в регуляции функции половых желез. За счет постоянного применения аГнРГ происходит снижение выделения гипофизом лютеинизирующего гормона, что в свою очередь ведет к снижению концентрации эстрадиола в сыворотке крови у женщин до постменопаузального уровня. У больных гормонопозитивным ранним РМЖ метод лекарственной овариальной супрессии аГнРГ вытеснил хирургическую кастрацию и облучение яичников, прежде всего, из-за потенциальной возможности восстановления детородной функции, уменьшения нежелательных последствий преждевременной менопаузы и достоверного улучшения прогноза жизни женщин.
Сохранение репродуктивного потенциала у пациентов со злокачественными новообразованиями
С развитием новых методов ранней диагностики и лечения увеличивается число молодых пациентов, излечившихся от основного заболевания, что является главным стимулом для развития технологий сохранения фертильности в онкологии. Бесплодие после химиотерапии у женщин репродуктивного возраста встречается от 30% до 70% случаев. В допубертатном возрасте воздействие химиотерапии на яичники менее выражено. Хорошо известно, что химиотерапия разрушает овариальный резерв яичников. Цитостатики вызывают деструкцию в ядрах клеток гранулезы, приводят к атрезии ооцита.
Методы сохранения фертильности развиваются стремительно. Еще недавно эту проблему считали неразрешимой. Онкологи всего мира, располагая как научным, так практическим опытом, при назначении противоопухолевой терапии детям или пациентам репродуктивного возраста информируют их о возможности сохранения фертильности.
Важно подчеркнуть, что большинство современных механизмов сохранения фертильности относятся к методам вспомогательных репродуктивных технологий (ВРТ), которые сформировались в ходе борьбы с уже существующим бесплодием. Задача, стоящая перед онкологами в настоящее время, – разработать тактику лечения таким образом, чтобы предотвратить возникновение бесплодия в случаях онкологической патологии у пациентов, используя методы ВРТ.
К методам вспомогательных репродуктивных технологий относятся:
Зависимость частоты наступления аменореи от возраста и режима химиотерапии
В большом количестве исследований международного уровня было доказано, что частота наступления аменореи напрямую зависит от возраста и выбора схемы химиотерапии (ХТ). Для лечения больных РМЖ детородного возраста должны использоваться надежные средства контрацепции в период лекарственной терапии и в ближайший срок после ее окончания. Врачам следует предупреждать пациентов о возможном отрицательном влиянии лекарственного лечения на функцию яичников и фертильность. В случае желания женщины иметь детей в будущем ей показана консультация врача-репродуктолога для решения вопроса о возможных вариантах реализации детородной функции в перспективе. Данные о возможности сохранения фертильности с помощью аГнРГ противоречивы.
Женщины моложе 40 лет менее всего подвержены наступлению аменореи (в 13-15% случаев), тогда как в возрасте старше 50 лет частота наступления менопаузы достигает 97% 21. В недавно опубликованных результатах исследования DATA, в которое были включены 329 пациенток с диагнозом РМЖ и установленной аменореей, в результате проведения ХТ было показано, что у 12% когорты произошло восстановление функции яичников в течение 30 мес. после назначения гормонотерапии селективным нестероидным ИА (анастрозолом) [22]. Также было отмечено, что у 5,1% пациентов с восстановленной менструальной функцией средний возраст составил более 50 лет на момент начала терапии ИА (у 25,2% пациентов средний возраст – менее 50 лет). Также было показано, что уровень эстрадиола при приеме ИА был выше у женщин с восстановленной функцией яичников по сравнению с группой пациентов с аменореей после химиотерапии, которые также принимали ИА.
Данные этого исследования в очередной раз подчеркивают необходимость определения уровней эстрадиола и ФСГ в крови при назначении гормональной терапии ИА; это связано с тем, что аменорея после проведения ХТ не является достаточным признаком достижения стойкой менопаузы. Учитывая эти данные, а также уровень заболеваемости РМЖ и структуру заболевания по возрасту, можно предполагать, что назначение препаратов, приводящих к ОС, показано приблизительно 10% больных РМЖ [23, 24].
Задачей терапии больных ранним РМЖ пременопаузального возраста является не только достижение клинического эффекта, но и сохранение фертильной функции женщины и поддержание качества жизни по завершению адъювантной химиотерапии. Это становится возможным при применении обратимой лекарственной ОС с использованием аГнРГ:
В 2016 году были изданы международные рекомендации по сохранению фертильности у женщин со злокачественными новообразованиями. Препараты, применяемые в онкологии, были разделены на 5 групп по степени влияния на овариальный резерв (табл.1) [25].
Таблица 1. Риск развития бесплодия, связанный с приемом противоопухолевых препаратов
(M. Lambertini, 2016) [25].
У пременопаузальных больных ранним РМЖ группы высокого риска добавление агонистов гонадотропин-рилизинг-гормона (аГнРГ) к терапии тамоксифеном или ингибиторами ароматазы снижает риск смерти, рецидива и контралатерального РМЖ по сравнению с монотерапией тамоксифеном.
К факторам, свидетельствующим в пользу назначения овариальной супрессии в комбинации с адъювантной гормонотерапией у больных ранним РМЖ в пременопаузе, относятся:
Необходимо отметить, что при завершении лекарственной овариальной супрессии у молодых женщин нормализуется менструальный цикл, а значит, возвращается исходное качество жизни, исчезают симптомы менопаузы, вызванные введением аГнРГ.
Преимущества применения аГнРГ заключаются не только в восстановлении фертильности у молодых женщин, но и в улучшении ее показателей в отличие от пациентов, не получивших дополнительно агонистов гонадотропин-релизинг-гормона.


Warning: Use of undefined constant expert_review_likes - assumed 'expert_review_likes' (this will throw an Error in a future version of PHP) in /var/www/www-ars1963/data/www/ck62.ru/wp-content/themes/colormag/comments.php on line 93