Участки кишечной метаплазии в желудке что это
Обзор современных концепций кишечной метаплазии желудка и рака желудка
Обзор современных концепций кишечной метаплазии желудка и рака желудка.
Кишечная метаплазия желудка является предраковым изменением слизистой оболочки желудка и связана с повышенным риском дисплазии и рака. В патогенезе прогрессирования от предраковых состояний к аденокарциноме желудка кишечного типа, согласно предложенного каскада Correa, считают переход от нормального эпителия желудка через воспаление, атрофию, внутрислизистую карциному, и наконец, к инвазивной карциноме. Множественные факторы риска были связаны с развитием взаимосвязи кишечной метаплазии желудка, включая инфекцию желудка H. pylori, генетических факторов, экологической среды, ревматических болезней, табакокурения, питания, желчного рефлюкса и кишечной микробиоты. Во всем мире в странах с высоким уровнем заболеваемости разработаны руководящие принципы скрининга.
Кишечная метаплазия желудка определяется как замена поверхностного, фовеолярного, и/или железистого эпителия кислотопродуцирующей или антральной слизистой желудка кишечным эпителием. Кишечная метаплазия желудка характеризуется анатомически как ограниченный процесс, если он находится в одной области желудка или как обширный, если вовлечены две области желудка. Гистологически кишечная метаплазия желудка считается либо полной, либо неполной. Полный (I тип) кишечная метаплазия определяется слизистой оболочкой тонкой кишки со зрелыми абсорбирующими клетками, бокаловидными клетками (Гоблета) и щеточной каймой. Неполная (II тип) кишечная метаплазия секретирует сиаломуцины и сходна с толстокишечным эпителием с цилиндрическими “промежуточными” клетками на различных стадиях дифференцировки, неравномерными каплями муцина и отсутствием щеточной каймы.
Самый высокий риск развития рака желудка связан с неполным и/или обширной кишечной метаплазией желудка. Систематический обзор, который включал 10 наблюдательных исследований по всей Европе, Азии и Латинской Америке в диапазоне от 10 месяцев до 19 лет наблюдения, показал, что риск рака желудка составляет в 4-11 раз выше при наличии неполной метаплазии по сравнению с ее отсутствием.
Первым изменением в гистологическом каскаде является либо активное хроническое воспаление неатрофического хронического гастрита, характеризующегося наличием желез, либо мультифокальный атрофический гастрит. Последующие гистологические изменения прогрессируют через появление полной метаплазии, неполной метаплазии, дисплазии низкой и высокой степени с последующей карциномой. В Нидерландах было проведено общенациональное когортное исследование для оценки риска развития рака желудка, связанного с различными предраковыми поражениями желудка. Атрофический гастрит, кишечная метаплазия, умеренно выраженная дисплазия, и высокая дисплазия были связаны с ежегодной заболеваемостью рака желудка в 0,1%, 0,25%, 0,6%, и 6,0%, соответственно. Заболеваемость раком желудка, ассоциированным с кишечной метаплазией желудка, в систематических обзорах колеблется от 0% до 10%, причем переменный диапазон обусловлен различными размерами выборки и периодами наблюдения.
Эндоскопический скрининг и наблюдение
Пациентам с высоким риском рекомендовано пройти эндоскопическое обследование с картированием биопсий по модифицированной Сиднейской системе (MSS) из 5 точек – антрального отдела (большая кривизна, малая кривизна), угол желудка и тело желудка (большая кривизна, малая кривизна). Следует отметить, что биопсии тела особенно ценны после длительного лечения ингибиторами протонной помпы, так как кислотопродуцирующая слизистая оболочка может быть изолировано инфицирована H. pylori. Биопсии с угла желудка также особенно важны, так как они, скорее всего, выявят максимальную атрофию, кишечную метаплазию и предраковую дисплазию. De Vries и его коллеги провели проспективное многоцентровое исследование в 2010 году. Золотым стандартом считалось получение 12 биопсий. На основе MSS (5 биопсий) выявили 90% пациентов с кишечной метаплазией желудка и 50% пациентов с дисплазией, в отличие от 97% и 100%, соответственно, когда было получено не менее 7 биопсий. De Vries и его коллеги пришли к выводу, что по крайней мере 9 биопсий, в том числе из кардии, необходимы для адекватного наблюдения предраковых поражений в популяции с низкой частотой рака желудка, к которым относятся европеоиды и белые американцы не испанского, африканского или восточноазиатского происхождения.
В настоящее время ASGE не рекомендуют общее наблюдение за людьми с кишечной метаплазией желудка, если не присутствуют другие факторы риска рака желудка, например, семейного анамнеза рака желудка и азиатского происхождения. Однако, европейский партнер, ESGE, рекомендует лечение H. pylori, если установлено, что пациент заражен бактериями, с последующим картированием биопсий по выявлению дисплазии каждые 3 года. Если слабая дисплазии (LGD) обнаруживается у пациента с кишечной метаплазией желудка, то ЭГДС с картированием необходима в течение 1 года для оценки эндоскопически видимых поражений. Пациентам с подтвержденной дисплазией высокой степени (HGD) при отсутствии эндоскопически видимого поражения рекомендуется повторное ЭГДC через 6-12 месяцев для наблюдения видимых поражений. Эти пациенты с поражениями должны пройти надлежащее либо хирургическую, либо эндоскопическую резекцию из-за высокой вероятности сосуществования инвазивной аденокарциномы, так как 25% пациентов с дисплазией высокой степени могут спрогрессировать до аденокарциномы в течение 1 года.
David S. Jencks, Jason D. Adam, Marie L. Borum, Joyce M. Koh, Sindu Stephen, David B. Doman. Overview of Current Concepts in Gastric Intestinal Metaplasia and Gastric Cancer. Gastroenterol Hepatol (NY). 2018 Feb; 14(2): 92–101.
Участки кишечной метаплазии в желудке что это
Определенные состояния связаны с повышенным риском развития рака желудка. К ним относят: пернициозную анемию, аденоматозные полипы, кишечную метаплазию, а также предшествующие хирургические вмешательства на желудке и, что особо важно с учетом количества больных, хронический гастрит, связанный с инфекцией Н. pylori.
Целесообразность эндоскопического скрининга в настоящее время не доказана, отчасти это связано с небольшой долей положительных результатов среди обследуемых пациентов, а отчасти с тем, что дисплазия или метаплазия не всегда переходят в злокачественный процесс.
Особая разновидность кишечной метаплазии — кишечная метаплазия III типа, характеризующаяся неполной клеточной дифференцировкой и секрецией сульфомуцина — наиболее тесно связана с развитием рака.
Однако скрининговое обследование этих больных проводиться не может до тех пор, пока не будут разработаны новые гистохимические или иммунологические методы исследования, так как используемый способ окраски слишком токсичен.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что делать при диагнозе “метаплазия желудка”?
1. Что такое метаплазия желудка и чем она опасна?
2. Симптомы метаплазии желудка
3. Обратима ли метаплазия желудка?
4. Как диагностируют метаплазию желудка?
5. Как лечат метаплазию желудка?
6. Где за рубежом лечат метаплазию желудка?
Метаплазия желудка – болезнь, которая часто предшествует раку. Согласно данным Всемирной Организации Здравоохранения, злокачественные опухоли желудка – пятая по распространенности онкология в мире. Ежегодно она становится причиной более 723,000 смертей. По отчетам больниц, до ¼ пациентов, которым проводится желудочная эндоскопия, имеют признаки желудочной метаплазии. Однако, далеко не у всех в последствии диагностируют рак. Стоит ли паниковать, услышав диагноз “метаплазия желудка”, как правильно подобрать лечение и обязательно ли проводить операцию – об этом можно узнать из нашей статьи.
Слушать статью:
Что такое метаплазия желудка и чем она опасна?
Метаплазия желудка – это заболевание, при котором слизистая оболочка желудка замещается “бокаловидными клетками”, которые обычно находятся на стенках кишечника. Заболевание считается опасным из-за того, что оно может перейти в злокачественное – рак желудка. Прогноз и план лечения метаплазии слизистой желудка зависит от степени поражения и общего состояния пациента.
Точная причина возникновения метаплазии желудка неизвестна. Заболевание обычно связывают с бактерией Helicobacter pylori, которую обнаруживают у 38-43% пациентов. К другим факторам риска относятся курение, прием алкоголя, копченого мяса, облучение, пожилой возраст, недостача витамина С и наличие близких родственником с раком желудка.
Если не лечить метаплазию желудка, существует риск прогрессирования заболевания. Это состояние называется дисплазией – 0 стадией рака желудка. Здоровые клетки при этом начинают заменяться аномальными. Болезнь редко обнаруживают на этом этапе, но она хорошо поддается лечению.
В зависимости от количества видоизмененных клеток, метаплазия желудка делится на 3 стадии: легкую, умеренную и выраженную. На более ранних этапах заболевания достаточно будет консервативного лечения, в то время как на последней стадии может быть рекомендована операция.
Если вы сомневаетесь в своем диагнозе, возможно получить второе врачебное мнение опытного иностранного гастроэнтеролога. Доктора проводят ревизию гистологии, диагностику, и формируют рекомендации к лечению на основе современных протоколов лечения. Чтобы заказать услугу, оставьте заявку на сайте.
Жители азиатских стран, таких как Китай, Монголия, Киргизстан и Корея имеют более высокий риск развития желудочной аденокарциномы в связи с их диетой и жизненными привычками. По этому протоколы лечения метаплазии желудка для этих групп – более строгие.
Симптомы метаплазии желудка
Большинство пациентов с метаплазией желудка не имеют симптомов. Заболевание может быть случайно обнаружено при проведении эндоскопии.
Другие люди могут обратиться к врачу с симптомами, характерными многим болезням желудочно-кишечного тракта. Они не обязательно указывают на метаплазию. К этим признакам относятся:
язвы желудка,
гастроэзофагеальная рефлюксная болезнь (ГЭРБ).
Можно ли вылечиться от метаплазии желудка?
Да, большинство врачей имеют причины считать, что при адекватном лечении и соблюдении рекомендаций врача метаплазия желудка может быть обратимой. Пациенту понадобиться оставаться под наблюдением гастроэнтеролога и проходить регулярные осмотры, пока доктор не подтвердит, что аномальное изменение ткани прошло. Обычно с момента постановки диагноза до “выздоровления” может уйти до трех-пяти лет. Однако, даже после этого пациенту следует придерживаться рекомендаций врача относительно питания, режима и приема медикаментов, чтобы не допустить рецидива болезни.
Как диагностируют метаплазию желудка?
Метаплазию желудка обычно обнаруживают во время верхней эндоскопии. Это – диагностическая процедура, во время которой доктор обследует пищевод и желудок с помощью камеры. Метаплазия имеет вид беловатых бляшек, пятен или однородного обесцвечивания. При обнаружении аномальных участков стенок органа проводится эндоскопия с биопсией, во время которой доктор с помощью иголки берет образец тканей для лабораторного обследования. Важно провести биопсию на правильном участке, по этому за эндоскопией следует обращаться к опытным гастроэнтерологам, чтобы не упустить заболевание. Точность метода в среднем составляет 71,3%.
В некоторых клиниках используется усовершенствованный вид диагностики – эндоскопия с использованием контрастного красителя – метиленового синего. Этот метод позволяет более детально обследовать желудок, но он занимает больше времени.
В течении лечения метаплазии желудка врачи проводят диагностические обследования, с помощью которых они следят за эффективностью терапии. К ним могут относиться:
Также в течении лечения нужно будет повторно проходить эндоскопию, в зависимости от рекомендаций врача – каждые 3-12 месяцев. Если эндоскопическая биопсия два раза подряд показала отсутствие метаплазии, можно считать, что болезнь отступила.
Чтобы записаться на диагностику и на нашем сайте. Наши врачи-координаторы помогут вам быстро получить ответ от клиники, которая вас интересует, и возьмут на себя организацию поездки.
Как лечат метаплазию желудка?
В лечении метаплазии желудка наиболее важный момент – оценить риск развития рака. В зависимости от этого, рекомендации врачей по наблюдению и лечению заболевания могут отличаться. К основным методам лечения метаплазии желудка относятся:
Лечение инфекции H. pylori
Так как бактерия Helicobacter pylori считается одним из основных факторов риска развития и прогрессирования рака желудка, ее уничтожение рекомендуется всем пациентам с метаплазией. Такие рекомендации предоставляет Британская Ассоциация Гастроэнтерологов (BSG), Американская Ассоциация Гастроэнтерологов (AGA) и другие организации.
Исследования врачей разных стран, включая Италию, Японию, Британию и Тайвань показывают, что уничтожение бактерии Helicobacter pylori в первый год заболевания существенно снижает риск последующего возникновения аденокарциномы желудка.
Большинству пациентов с метаплазией желудка нужно будет на несколько лет оставаться под наблюдением у гастроэнтеролога. В зависимости от наличия конкретных факторов риска, пациентам нужно будет реже или чаще проходить эндоскопию. К таким факторам относится: возраст старше 50 лет, дефицит витамина B12 и положительный результат антител к париетальным клеткам желудка или внутреннему фактору.
Пациентам с обширной метаплазией желудка, поразившей весь орган, рекомендуется оставаться под наблюдением в течении трех лет. Это также касается людей с резистентной инфекцией H. pylori и наличием родственников, перенесших рак желудка.
Хирургическое лечение метаплазии желудка предназначено для выраженной стадии заболевания. Операцию рекомендуется пройти после того, как двое патологов-гастроэнтерологов подтвердят диагноз после биопсии. Операция проводится эндоскопически, то есть врачу не понадобиться делать разрезы на теле пациента. Точно также, как и при диагностической эндоскопии, в желудок больного через рот вводится гибкая трубка с камерой. С помощью электрического потока доктор бескровно вырезает опухоль, которая может достигать 3 см в диаметре. Одновременно могут быть удалены полипы, если такие присутствуют в желудке. Резекция длится от 20 минут до часа и не требует госпитализации.
Во время и после лечения метаплазии желудка важно следовать рекомендациям врача, чтобы лечение оставалось эффективным и болезнь не вернулась. Они касаются изменений в диете и жизненных привычках, которые позволят убрать некоторые факторы риска развития желудочной карциномы. Врачи рекомендуют пациентам с метаплазией желудка:
Кишечная метаплазия слизистой оболочки желудка в практике гастроэнтеролога: современный взгляд на проблему
Ключевые слова: кишечная метаплазия, атрофия, хронический гастрит, Helicobacter pylori, рак желудка.
С учетом того, что проблема рака желудка на сегодняшний день чрезвычайно актуальна, а результаты огромного количества опубликованных исследований нередко противоречивы, практикующему врачу порой нелегко разобраться в этапах желудочного канцерогенеза, одну из ступеней которого и занимает кишечная метаплазия. Глубокое непонимание специалистами практического звена понятий «атрофия» и «кишечная метаплазия», незнание отдаленных последствий этих состояний и динамики морфологических изменений в слизистой оболочки желудка на фоне лечения по устранению инфекции Helicobacter pylori (H. pylori), побудило нас к написанию данной статьи.
Понятие о нарушении клеточного обновления
Как известно, эпителий желудка относится к тканям, которым свойственно непрерывное клеточное обновление: постоянство структуры эпителия обеспечивается только при координации фаз пролиферации, дифференцировки и апоптоза (рис. 1).
Рис. 1. Нарушения клеточного обновления
При любых повреждениях слизистой оболочки активируется пролиферация, ускоряется миграция клеток, что ведет к восстановлению структуры и возвращению клеточного обновления в исходное состояние. При хроническом гастрите процесс клеточного обновления в слизистой оболочке нарушается (дисрегенерация), что вызывает ускоренное перемещение клеток из генеративной зоны без полноценной дифференциации в зоны расположения зрелых специализированных эпителиоцитов. Следствием этого процесса является неспособность желудочных желез к полноценной функции [3].
Хронический гастрит и Helicobacter pylori
Одним из эффектов нейтрофильной инфильтрации является увеличение проницаемости эпителия для антигенов Н. pylori, вызывающих миграцию в собственную пластинку лимфоцитов, плазматических клеток и макрофагов. Важная особенность состоит в отсутствии эрадикации Н. pylori под воздействием антигеликобактерных антител, что, вероятно, объясняется «недоступностью» бактерии для антител в слое желудочной слизи, невозможностью выделения IgG в просвет желудка при относительном дефиците секреторных IgA, а также «антигенной мимикрией» Н. pylori. Таким образом, неэффективный гуморальный иммунный ответ на Н. pylori и его антигены вместо элиминации возбудителя становится одним из факторов патогенеза, формируя различные клинические варианты геликобактериоза. В результате прогрессирования воспаления закономерно возникают повреждения эпителия посредством индукции апоптоза или развития некрозов слизистой оболочки, опосредованных активными формами кислорода и оксидом азота нейтрофилов. Следует подчеркнуть, что для геликобактерного гастрита апоптоз является более характерной формой гибели клеток, чем некроз.
Рис. 2. Взаимосвязь кишечной метаплазии, атрофии и Н. pylori
Хронический гастрит как предраковое заболевание
При многих заболеваниях, характеризующихся хроническим воспалением (язвенный колит, болезнь Крона, хронический вирусный гепатит, хронический панкреатит и т. д.) существует высокий риск развития злокачественных новообразований. Наиболее вероятной причиной является клеточная пролиферация и/или повреждение генома, вызванное воспалением [49].
Как показал ряд исследований, такая взаимосвязь существует и в отношении рака желудка, развивающегося на фоне персистирующего хронического гастрита. Начиная с первого описания Н. pylori в слизистой оболочке желудка австралийскими учеными J. Warren и В. Marshall [59] значение данного открытия прогрессивно увеличивалось; в настоящее время эта инфекция признана в качестве главного этиопатогенетического фактора развития не только хронического гастрита и язвенной болезни, но и рака желудка.
Так как в здоровой слизистой оболочке рак практически не возникает [8], в последние годы сформировалось представление о предраковой патологии желудка [4], в спектре которой Н. pylori-ассоциированный хронический гастрит занимает центральное место (табл. 1).
Таблица 1. Предраковые изменения и заболевания желудка, риск малигнизации (по Е.К. Баранской, В.Т. Ивашкину с изменениями [4])
| Предраковое состояния и заболевания желудка | Риск | Величина риска, % |
| Дисплазия слизистой оболочки желудка Синдром Гарднера (семейный аденоматозный полипоз) Аденоматозные полипы желудка Пищевод Баррета |
Синдром Линча II (наследственный неполипозный колоректальный рак)
Хронический Н. pylori-ассоциированный атрофический гастрит с кишечной метаплазией
Резецированный желудок (по Бильрот II)
Аутоиммунный атрофический гастрит
Синдром Пейтца-Джигерса
Болезнь Менетрие
Гиперпластические полипы
Доброкачественные язвы желудка
Менее 5
Действительно, имеются данные, что персистенция инфекции Н. pylori увеличивает риск развития рака желудка в 4-9 раз, особенно в случаях инфицирования в детском возрасте [18,23,31,39]; в целом до 80% аденокарцином желудка связаны с Н. pilori-ассоциированным хроническим атрофическим пангастритом [4]. В 1994 г. Международное агентство по изучению рака (IARC) классифицировало H. pylori в качестве канцерогена I класса у человека, что свидетельствует о наличии достаточно надежных доказательств [34, 56].
Данный каскад патологических явлений в качестве модели развития рака желудка предложил в 1988 г. Р. Соrrеа [21], однако в то время в этой модели не нашлось места для H. pylori. Только двумя годами позже автор ввел H. pylori а качестве этиологической причины гастрита [23,25] и соответственно рака желудка. Указанная последовательность патологических явлений в последние годы стала широко известна и получила название парадигмы желудочного канцерогенеза (рис. 3). Молекулярных изменений, которые возникают при инфекции H. pylori и способны привести к развитию рака желудка, не установлено. Действительно, сведений, достоверно подтверждающих синтез или секрецию Н. pylori мутагенных или канцерогенных субстанций нет. Имеются отдельные экспериментальные исследования, показывающие способность Н. pylori стимулировать in vitro рост культуры, опухолевых клеток [17], не имеющих к раку желудка никакого отношения. Поэтому современные представления состоят в том, что Н. pylori скорее действует в качестве промотора, чем инициатора желудочного канцерогенеза. При инфицировании Н. pylori возникает воспалительная реакция в слизистой оболочке желудка, наблюдается продукция нейтрофильными лейкоцитами реактивных кислородных метаболитов и происходит высвобождение цитокинов клетками воспалительного инфильтрата, что приводит к повреждению ДНК и стимуляции рецепторов, вызывающих пролиферацию клеток.
Развитие дистального рака желудка по времени может занять несколько десятилетий, в течение которых у большинства пациентов последовательно сменят друг друга указанные нами стадии желудочного канцерогенеза, включающие заражение Н. pylori, развитие хронического активного гастрита, возникновение атрофии слизистой и кишечной метаплазии, дисплазии эпителия с последующей трансформацией в рак [21,35,50].
Однако приведенные выше факты не отвечают на ряд важнейших вопросов: почему Н. pylori вызывает и другие заболевания (язвенную болезнь двенадцатиперстной кишки, MALT-лимфому), крайне редко сочетающиеся с раком желудка [12-14,19,28,46,57], почему только у небольшого числа больных (1-2%) с H. pilory-ассоциированным гастритом развивается дистальный рак желудка [1,2], а также почему кишечная метаплазия (дифференцированный эпителий, не способный к делению) является фоном для возникновения рака желудка.
Вместе с тем антральный H. pylori-ассоциированный гастрит не предрасполагает к развитию кишечной метаплазии, а соответственно к дисплазии и раку желудка. Поверхностный гастрит с фундальной или мультифокальный локализацией приводит к потере желудочных желез с замещением их фиброзной тканью или (что более типично) метаплазированным эпителием. Именно этот вариант гастрита создаст фон для карциномы кишечного типа [10].
Рис. 4. Патогенез дистального рака желудка. Инициирующая роль Н. pylori, взаимосвязь с генетическими изменениями и нарушениями клеточного обновления
Целесообразно сказать об особенностях макроорганизма, определяющих риск развития дистального рака желудка, в частности о полимофизме генов цитокинов. Как мы отмечали ранее, экспрессия эпителиальными клетками IL-8 запускает цитокиновый провоспалительный каскад. Мобилизованные моноциты и нейтрофилы экспрессируют, в свою очередь, IL-10, являющийся одним из мощнейших ингибиторов кислотообразования. Таким образом, IL-10 потенцирует воспалительные изменения в слизистой оболочке и вызывает достаточно выраженную гипохлоргидрию, облегчающую колонизацию Н. pylori в желудке. После открытия полиморфизма генов цитокинов стало ясно: чем сильнее будут выражены провоспалительные и антисекреторные свойства IL-10, тем больше вероятность развития фундального гастрита, атрофии, кишечной метаплазии и дистального рака желудка. В обратной степени это относится и к полиморфизму антагониста IL-10, однако и в том, и в другом случае без участия Н. pylori полиморфизм генов цитокинов в плане развития рака не имеет никакого значения.
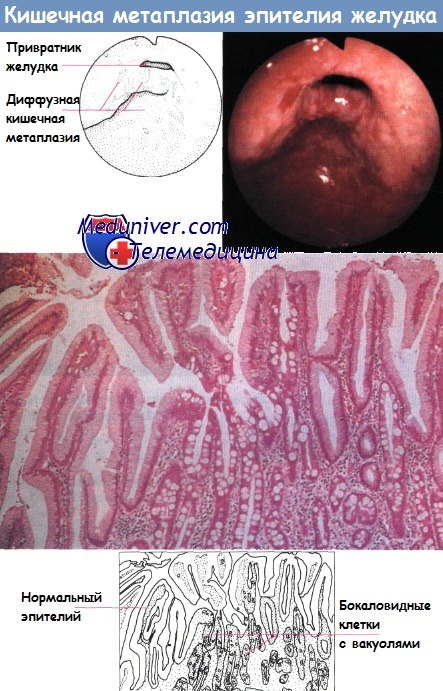
Типы кишечной метаплазии и риск развития рака желудка
Как следует из вышеизложенного, интерес к кишечной метаплазии обусловлен прежде всего ее связью с раком желудка кишечного типа. Однако широко известно существование разных типов и подтипов (вариантов) кишечной метаплазии в слизистой оболочке желудка и только в отношении толстокишечного варианта неполной кишечной метаплазии имеется взаимосвязь с раком желудка.
Рис. 5. Типы кишечной метаплазии
Главным диагностическим признаком кишечной метаплазии является наличие бокаловидных клеток, встречающихся при всех подтипах кишечной метаплазии, в то время как тип муцинов диагностического значения не имеет (табл. 2). Для выявления подтипов кишечной метаплазии имеет значение присутствие цилиндрических клеток с различными вариантами образования муцинов. При полной кишечной метаплазии муцины не обнаруживаются, типичным же является наличие выраженной щеточной каймы. Таким образом, наиболее часто используемым практическим подходом к классификации является разделение кишечной метаплазии по характеру гистохимической детекции муцинов в цилиндрических клетках на 3 группы:
Таблица 2. Основные отличия между подтипами кишечной метаплазии
| Признаки | Кишечная метаплазия | |||
| Полный тип (I) | Неполный тип (II, III) | |||
| тонкокишечная (IA) | толстокишечная (IB) | тонкокишечная (IIB) | толстокишечная (III) | |
| Бокаловидные клетки | ||||
Возможно ли обратное развитие атрофии и кишечной метаплазии?
Поскольку мы ранее отметили определенную взаимосвязь между Н. pylori, хроническим гастритом, атрофией и кишечной метаплазией, можно предположить, что устранение возбудителя должно привести к редукции гастрита. Происходит ли при этом обратное развитие дисрегенераторных изменений остается предметом оживленных дискуссий.
Имеются данные, что ликвидация Н. pylori способна не только предотвращать развитие и прогрессирование атрофии эпителия [51]. При успешной эрадикации возможно обратное развитие атрофии слизистой оболочки, однако уменьшение степени атрофии отмечается не у всех пациентов и лишь через несколько лет после антигеликобактериой терапии [30,33,36,39].
Обратное развитие кишечной метаплазии у Н. pylori-позитивных больных после эрадикации инфекции продемонстрировано в ряде исследований [33,38,58], в том числе рандомизированных [24,53]. При этом существенная роль в них отводилась как собственно антигеликобактерному лечению, так и длительному применению антиоксидантных витаминно-минеральных комплексов [24,58]. В крупном рандомизированном плацебо-контролируемом исследовании, включавшем 587 инфицированных Н. pylori пациентов, было показано, что отсутствие эрадикации инфекции, особенно у мужчин старше 45 лет и лиц, злоупотребляющих алкоголем, служило фактором, способствовавшим прогрессированию кишечной метаплазии. В то же время успешная эрадикация снижала темпы прогрессирования кишечной метаплазии, но не приводила к ее обратному развитию [40].
Диагностика и лечение
Как видно на рис. 6, стандартом диагностики кишечной метаплазии является гистологическое исследование. В качестве скрининг-теста и для определения объема поражения желудка целесообразно использовать хромоэндоскопию. При комбинации данных методов точность диагностики значительно повышается. Высокая частота ассоциации с инфекцией Н. pylori определяет необходимость выявления этого микроорганизма у больных с кишечной метаплазией.
Рис. 6. Диагностика кишечной метаплазии
Как следует из приведенных выше данных, схемы эрадикационной терапии являются стандартными в отношении как комбинации и суточных доз антибактериальных препаратов, так и двукратного применения ИПП. Однако в рекомендациях не отдается предпочтение какому-либо конкретному препарату из имеющихся на фармакологическом рынке, по всей видимости, этот выбор предоставляется практикующему врачу.
Необходимо отметить ряд важнейших моментов, определяющих эффективность лечения. Так, применение ИПП повышает рН в желудке и предотвращает разрушение ряда антителнкобактерных антибиотиков, снижает вязкость желудочной слизи, замедляет эвакуацию пищи из желудка, в ряде случаев способствует эрадикапии Н. pylori (даже при монотерапии). Хотя все препараты в конечном итоге обеспечивают полное ингибирование протонной помпы, время, в течение которого оно достигается, различно. Максимально быстро развивается эффект рабепразола (полное ингибированне происходит через 10 мин), Медленнее и примерно с одинаковой скоростью действуют лансопразол и омепразол (полное ингибирование через 20 мин). Дольше всего развивается аффект пантопразола: даже через 30 мин транспорт ингибируется лишь на 50%.
Наибольшая скорость наступления антисекреторного действия рабепразола в сравнении с другими ИПП отмечена в многочисленных клинических исследованиях [16,45,47,60]. По данным К. Baisley и соавт., одинаковая часть времени суток с внутрижелудочным рН>4 достигается применением минимальной дозы рабепразола (10 мг/сут) и стандартной дозы эзомепразола (20 мг/сут) как в первые, так и на пятые сутки приема препаратов [16]. При сравнении влияния на снижение желудочной секреции рабепразола и эзомепразола в дозе 20 мг/сут, как наиболее эффективных в настоящее время препаратов, было выявлено статистически достоверное отличие, заключавшееся в более высокой эффективности рабепразола как на первый (38,5 против 19,4%), так и на пятый день применения (52,8 против 42,5%) [60]. В результате становится понятным, почему при приеме рабепразола отмечается максимально быстрая редукция клинической симптоматики в сравнении с другими ИПП при лечении кислотозависимых заболеваний [11,27].
Рабепразол несколько иначе, чем другие ИПП, метаболизируется в организме. Как омепразол и эзомепразол, он элиминируется главным образом путем окисления в печени представителями двух изоформ цитохрома Р-450: CYP2C19 и CYP3A4. Но для рабепразола характерно также неферментативное окисление, что снижает долю лекарства, метаболизирующегося через названные изоформы цитохрома Р-450 [54]. В связи с этим по сравнению с омепразолом и лансопраэолом уменьшается риск взаимодействия рабепразола с лекарственными препаратами, метаболизируемыми главным образом через CYP2C19, например с варфарином, диклофенаком, фенитоином и толбутамилом. Совокупный анализ 63 контролируемых исследований, проведенных в Японии, Северной Америке и Европе и посвященных клинической эффективности рабепразола, показал его хорошую переносимость [37]. При различных суточных дозах (10, 20 и 40 мг/сут) установлена сопоставимость частоты побочных эффектов при приеме плацебо и рабепразола [20].
Кишечная метаплазия слизистой оболочки желудка в практике гастроэнтеролога: современный взгляд на проблему.
И.В. Маев, О.В. Зайратьянц, Ю.А. Кучерявый.
Московский государственный медико-стоматологический университет, кафедра пропедевтики внутренних болезней и гастроэнтерологии, кафедра патологической анатомии.
Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2006, № 4, с. 38-48.








